Kemiallinen termodynamiikka 29 Kemiallinen tasapaino Lauri Partanen Moduuli










- Slides: 14

Kemiallinen termodynamiikka 29 Kemiallinen tasapaino Lauri Partanen

Moduuli 29: Kemiallinen tasapaino Tämän moduulin jälkeen opiskelija: • Pystyy hyödyntämään kemiallisen potentiaalin käsitettä kemiallisten reaktioiden tarkastelussa • osaa kuvailla kemiallista potentiaalia partiaalisena moolisuureena • Kykenee soveltamaan yhteyksiä aktiivisuuksien, termodynaamisen tasapainovakion ja muiden termodynaamisten suureiden välillä.

Learning. Catalytics: Teekkari sekoittaa shottilasissa 50 ml puhdasta etanolia ja 50 ml limsaa, mitä voit sanoa liuoksen lopputilavuudesta V ? 1. V = 100 ml 2. V > 100 ml 3. V < 100 ml 4. Ei osaa sanoa

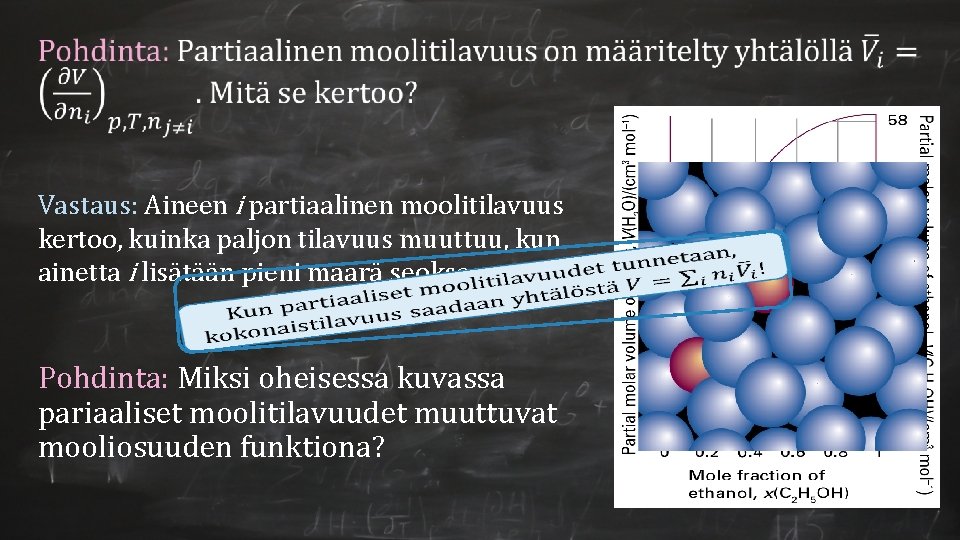
Vastaus: Aineen i partiaalinen moolitilavuus kertoo, kuinka paljon tilavuus muuttuu, kun ainetta i lisätään pieni määrä seokseen. Pohdinta: Miksi oheisessa kuvassa pariaaliset moolitilavuudet muuttuvat mooliosuuden funktiona?

Kemiallinen potentiaali on partiaalinen mooli Gibbsin energia

Kemiallinen potentiaali partiaalisena moolisuureena Yhdistetään aiempia tuloksia: Kuinka paljon Gibbsin energia muuttuu, kun ainetta i lisätään pieni määrä seokseen?

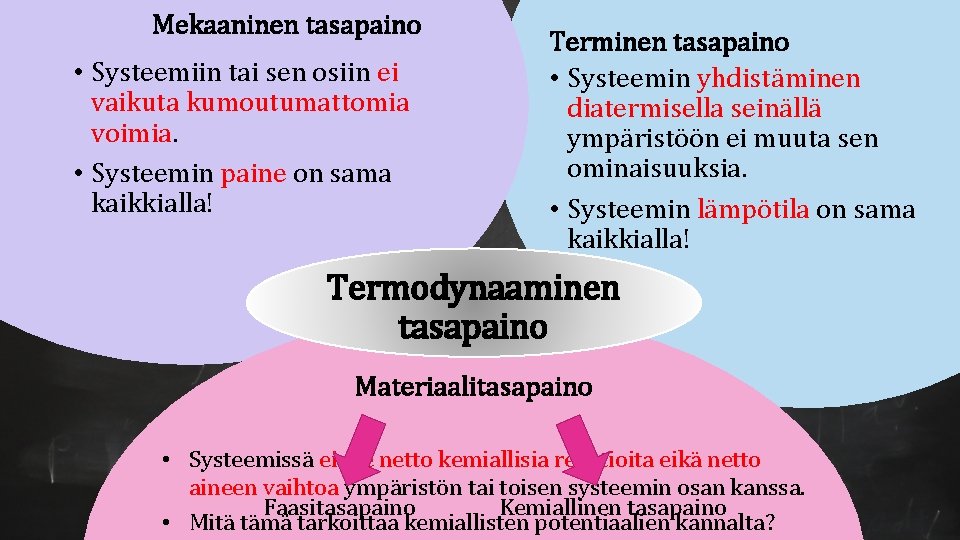
Mekaaninen tasapaino • Systeemiin tai sen osiin ei vaikuta kumoutumattomia voimia. • Systeemin paine on sama kaikkialla! Terminen tasapaino • Systeemin yhdistäminen diatermisella seinällä ympäristöön ei muuta sen ominaisuuksia. • Systeemin lämpötila on sama kaikkialla! Termodynaaminen tasapaino Materiaalitasapaino • Systeemissä ei ole netto kemiallisia reaktioita eikä netto aineen vaihtoa ympäristön tai toisen systeemin osan kanssa. Faasitasapaino Kemiallinen tasapaino • Mitä tämä tarkoittaa kemiallisten potentiaalien kannalta?

Miten kemiallinen potentiaali liittyy tasapainoon? Tarkastellaan saatua Gibbsin energian lauseketta vakiopaineessa ja –lämpötilassa: d. G < 0 d. G =0

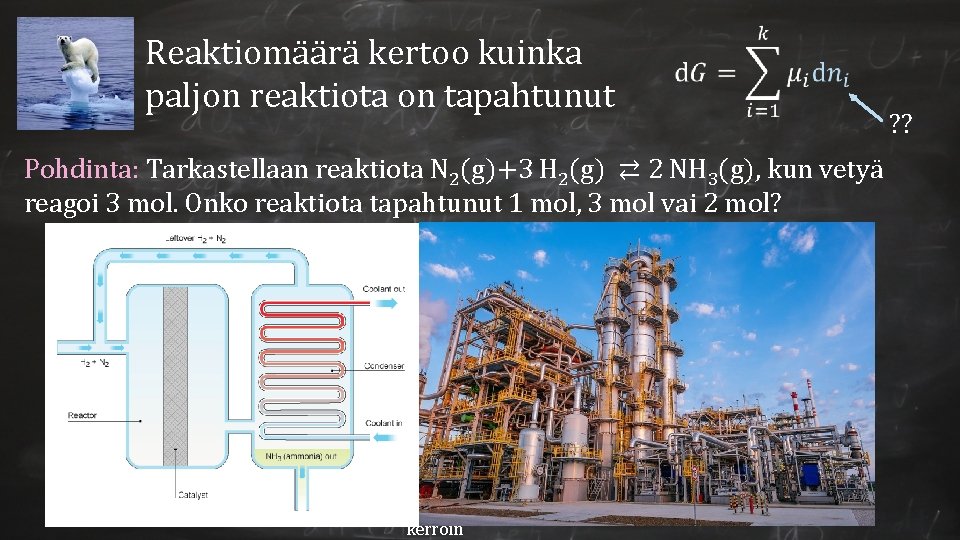
Reaktiomäärä kertoo kuinka paljon reaktiota on tapahtunut ? ? Pohdinta: Tarkastellaan reaktiota N 2(g)+3 H 2(g) ⇄ 2 NH 3(g), kun vetyä reagoi 3 mol. Onko reaktiota tapahtunut 1 mol, 3 mol vai 2 mol? Tarvitaan reaktion stoikiometriasta riippumaton mittari reaktion edistymisen kuvaamiseen! Ainemäärä alussa Reaktiomäärä Stoikiometrinen kerroin

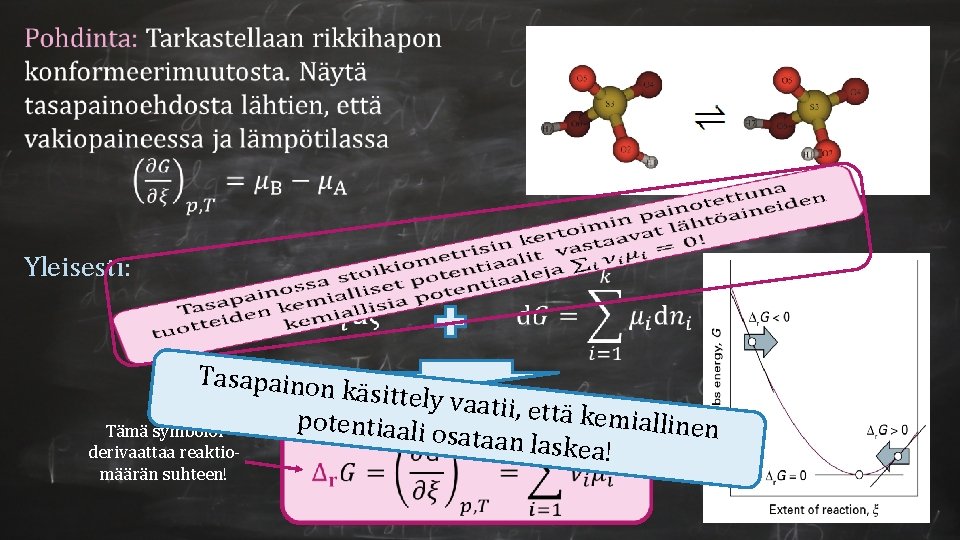
Yleisesti: Tasapainon Tämä symboloi derivaattaa reaktiomäärän suhteen! käsittely va atii, että kem potentiaali iallinen osataan lask ea !

Kemiallinen potentiaali tunnetaan jo kaikille systeemeille!!1! Standardipotentiaali • Liuokset: § Aks. I: Kaikille aineille puhtaan aineen kem. pot. § Aks. II: Liuottimelle puhtaan aineen ja liuenneille aineille hypoteettisen tilan kem. pot. • Kaasut: Puhtaan kaasun kem. pot. paineessa 1 bar • Kondensoidut faasit: Puhtaan kiinteän aineen kem. pot. paineessa 1 bar (Aks. = aktiivisuuskerroinsopimus) Aktiivisuus

Termodynaaminen tasapainovakio Tasapainovakio

Pohdinta: Alla olevan reaktion tasapainovakion arvo on 2∙ 1015 lämpötilassa 25 °C. Tapahtuuko reaktio tuotteiden suuntaan nopeasti vai hitaasti tasapainovakion perusteella? Mitä voit sanoa tasapainokoostumuksesta? Vastaus: Reaktion nopeudesta ei tasapainovakion perusteella voida tietää mitään. Tasapainossa reaktioastiassa on sekä lähtöaineita, että tuotteita, mutta tuotteita valtavan paljon enemmän.

Kuvalähteet: Kansidia. Tetäväinen T. , Partanen L. (2019), valokuva Diatausta. Viitaharju P. , Partanen L. (2019), valokuva Dialogo WWF Earthbook, (2012), Polar bear on melting ice platform, Viitattu 27. 8. 2019. Haettu osoitteesta https: //www. mirror. co. uk/incoming/gallery/wwf- earthbook-882936 Dia 3 Atkins, P. ja De Paula, J. , L. (2010), Figure 4 (page 71). Formation enthalpy [Diagrammi], Teoksessa Atkins’ Physical Chemistry, 9 th edition, Oxford Univeristy Press, Oxford, New York Dia 9 Atkins, P. ja De Paula, J. , L. (2010), Figure 2. 20. Kirchoff’s law [Diagrammi], Teoksessa Atkins’ Physical Chemistry, 9 th edition, Oxford Univeristy Press, Oxford, New York




















