Kemiallinen termodynamiikka 23 Yhden komponentin faasidiagrammit Lauri Partanen










- Slides: 14

Kemiallinen termodynamiikka 23 Yhden komponentin faasidiagrammit Lauri Partanen

Moduuli 23: Yhden komponentin faasidiagrammit Tämän moduulin jälkeen opiskelija: • Osaa tulkita yhden komponentin faasidiagrammeja. • Pystyy hyödyntämään faasidiagrammeja aineiden ominaisuuksien määrittämiseksi ja kemian ongelmian ratkaisussa. • Tutustua höyrynpaineen käsitteeseen.

Faasidiagrammien peruspiirteitä Viivojen välisillä alueilla yksi faasi hallitsee Kolmoispisteessä kolme faasia ovat samanaikaisesti tasapainossa Tm Tb Viivat ovat faasirajoja, joilla kaksi faasia tasapainossa Lämmitetään systeemiä vakiopaineessa Puristetaan systeemiä vakiolämpötilassa

Höyrynpaine Annetaan suljettuun astiaan vangitun puhtaan nestenäytteen asettua tasapainoon kaasunsa kanssa: Määritelmä: Nesteen höyrynpaine on tällöin kaasufaasin paine tasapainossa

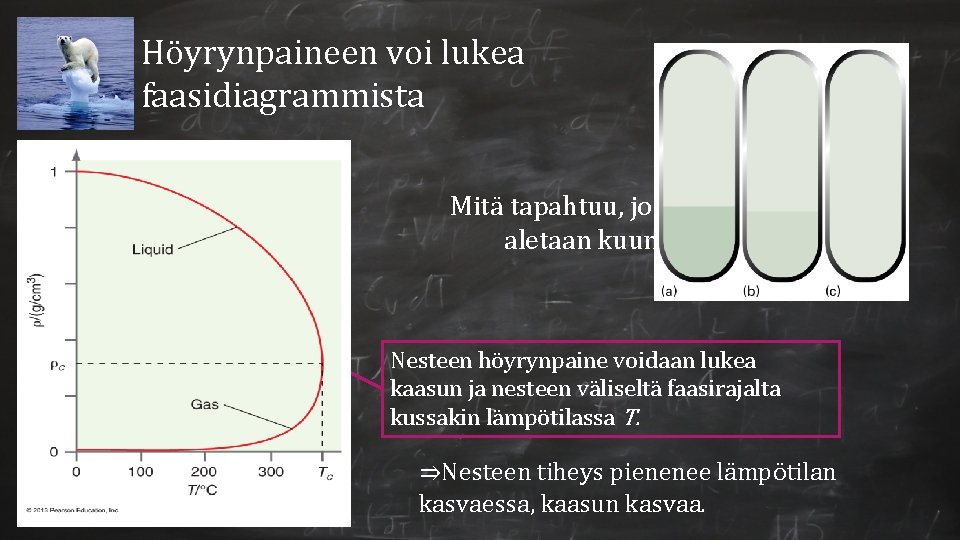
Höyrynpaineen voi lukea faasidiagrammista (c) Mitä tapahtuu, jos suljettua astiaa aletaan kuumentamaan? (b) (a) Nesteen höyrynpaine voidaan lukea kaasun ja nesteen väliseltä faasirajalta kussakin lämpötilassa T. ⇒Nesteen tiheys pienenee lämpötilan kasvaessa, kaasun kasvaa.

Neste kiehuu, kun sen höyrynpaine vastaa ulkoista painetta Höyrynpaine kasvaa lämpötilan kasvaessa. p = 1 atm p* = 1 atm Avoimessa astiassa neste kiehuu, sen höyrynpaineen saavuttaessa ulkoisen paineen! Pohdinta: Mitä voit sanoa veden kiehumispisteestä Mount Everestin huipulla? Vastaus: Vesi kiehuu alle 100 o. C

Learning. Catalytics: Teekkari kuumentaa kahta identtistä astiaa levyllä. Astiassa 1 on puolet astian 2 vesimäärästä. Ensimmäinen astia on sijoitettu laboratorioon (T =298 K) ja astia 2 on yliopistoruokalan kylmäkellarissa (T = 274 K). Molemmissa huoneissa vallitsee yhden ilmakehän paine. Kun astioissa olevaa vettä kiehutetaan, prosessin aikana muodostuva vesihöyry työntää astiassa olevan ilman pois. Tämän jälkeen astiat poistetaan levyltä ja suljetaan ilmatiiviillä kansilla. Astiat jätetään pitkäksi aikaa seisomaan huoneisiin. Mitä voit sanoa paineesta astiassa 1? 1) p 1 > p 2 2) p 1 < p 2 3) p 1 = p 2 4) Ei osaa sanoa

Learning. Catalytics: Teekkari kuumentaa kahta identtistä astiaa levyillä. Astiassa 1 on puolet astian 2 vesimäärästä. Ensimmäinen astia on sijoitettu kampuksella olevaan huoneeseen, jossa ilmanpaine on 750 mm. Hg. Toinen astia on hiihtomajassa, jossa ilmanpaine on 500 mm. Hg. Molemmissa huoneissa lämpötila on 293 K. Kun astioissa olevaa vettä kiehutetaan, astiassa olevaa vettä kiehutetaan useita minuutteja. Prosessin aikana muodostuva vesihöyry työntää astiassa olevan ilman pois. Tämän jälkeen astiat poistetaan levyltä ja suljetaan ilmatiiviillä kansilla. Astiat jätetään pitkäksi aikaa seisomaan huoneisiin. Mitä voit sanoa paineesta astiassa 1? 1) p 1 > p 2 2) p 1 < p 2 3) p 1 = p 2 4) Ei osaa sanoa 293 K

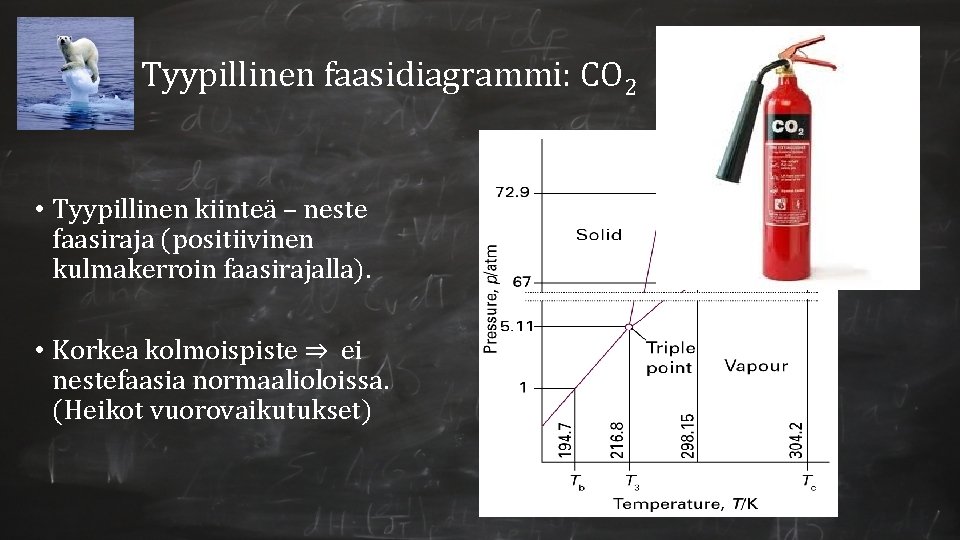
Tyypillinen faasidiagrammi: CO 2 • Tyypillinen kiinteä – neste faasiraja (positiivinen kulmakerroin faasirajalla). • Korkea kolmoispiste ⇒ ei nestefaasia normaalioloissa. (Heikot vuorovaikutukset)

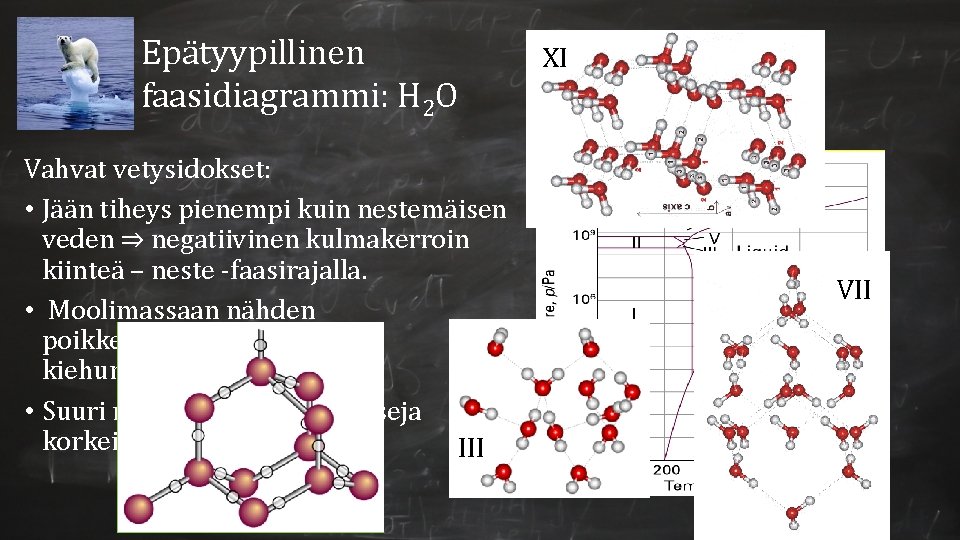
Epätyypillinen faasidiagrammi: H 2 O Vahvat vetysidokset: • Jään tiheys pienempi kuin nestemäisen veden ⇒ negatiivinen kulmakerroin kiinteä – neste -faasirajalla. • Moolimassaan nähden poikkeuksellisen korkea kiehumispiste. • Suuri määrä eri kiinteitä faaseja korkeilla paineilla. III XI VII

Miten kemiallinen potentiaali liittyy faasidiagrammeihin? a s t e s k ö t ä ä p o t h Jo ! e l l a i g r e n e n i s bb i G n i u k mat

Learning. Catalytics: Kemisti on päättänyt lähteä hiihtämään. Mitä tapahtuu jään sulamispisteelle suksen alla? Mitä sulamispisteelle tapahtuisi, jos kemisti hiihtäisikin kiinteän bentseenin päällä? 1. Tm nousee molemmissa tapauksissa 2. Tm laskee molemmissa tapauksissa 3. Tm laskee vedelle ja nousee bentseenille 4. Tm nousee vedelle ja laskee bentseenille 5. Tm pysyy vakiona molemmissa tapauksissa 6. Ei osaa sanoa.

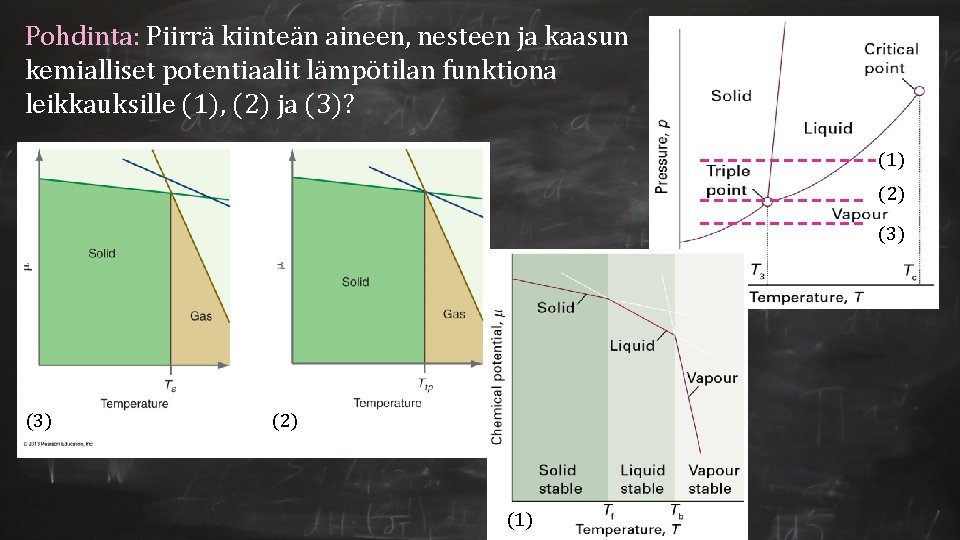
Pohdinta: Piirrä kiinteän aineen, nesteen ja kaasun kemialliset potentiaalit lämpötilan funktiona leikkauksille (1), (2) ja (3)? (1) (2) (3) (2) (1)

Kuvalähteet: Kansidia. Tetäväinen T. , Partanen L. (2019), valokuva Diatausta. Viitaharju P. , Partanen L. (2019), valokuva Dialogo WWF Earthbook, (2012), Polar bear on melting ice platform, Viitattu 27. 8. 2019. Haettu osoitteesta https: //www. mirror. co. uk/incoming/gallery/wwf- earthbook-882936 Dia 3 Atkins, P. ja De Paula, J. , L. (2010), Figure 4 (page 71). Formation enthalpy [Diagrammi], Teoksessa Atkins’ Physical Chemistry, 9 th edition, Oxford Univeristy Press, Oxford, New York Dia 9 Atkins, P. ja De Paula, J. , L. (2010), Figure 2. 20. Kirchoff’s law [Diagrammi], Teoksessa Atkins’ Physical Chemistry, 9 th edition, Oxford Univeristy Press, Oxford, New York




















