Halogenderivty CH2 Organick chemie DUM 1 7 ronk



- Slides: 10


Halogenderiváty CH-2 Organická chemie, DUM č. 1 7. ročník osmiletého gymnázia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

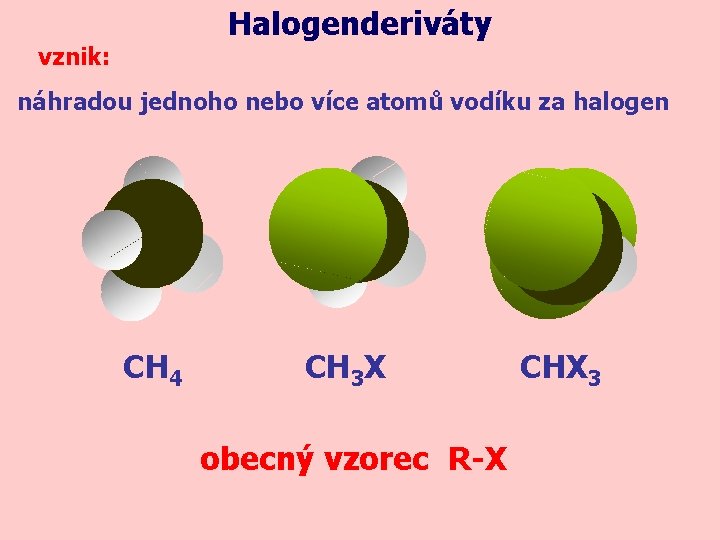
Halogenderiváty vznik: náhradou jednoho nebo více atomů vodíku za halogen CH 4 CH 3 X obecný vzorec R-X CHX 3

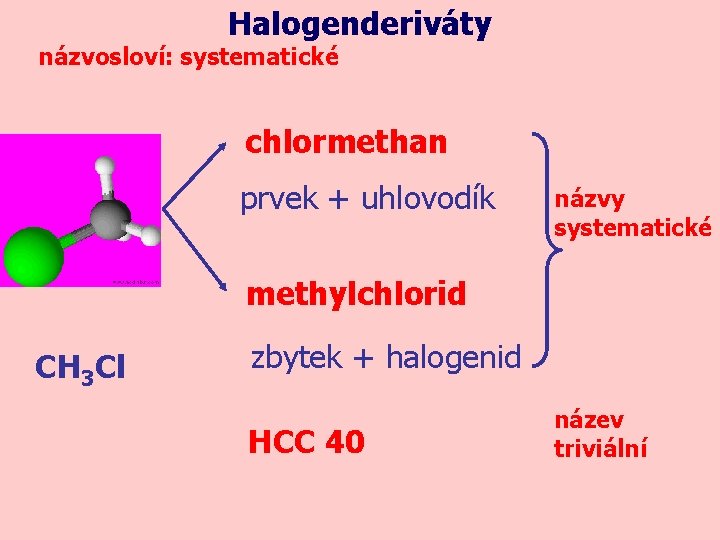
Halogenderiváty názvosloví: systematické chlormethan prvek + uhlovodík názvy systematické methylchlorid CH 3 Cl zbytek + halogenid HCC 40 název triviální

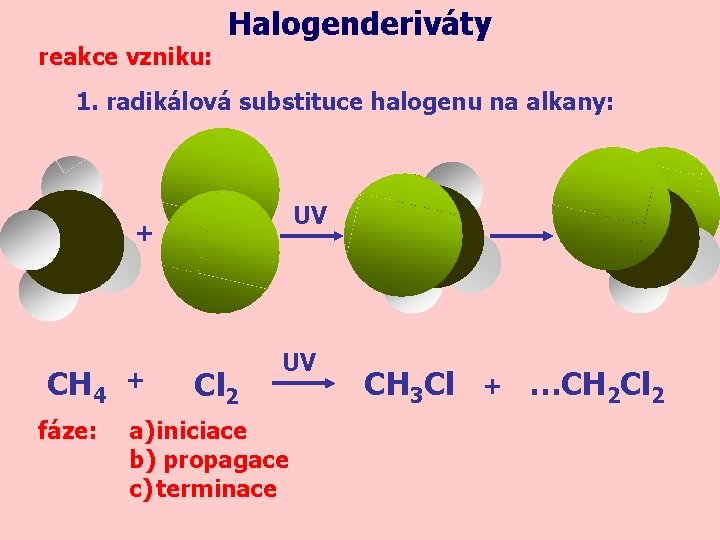
reakce vzniku: Halogenderiváty 1. radikálová substituce halogenu na alkany: UV + CH 4 fáze: + Cl 2 UV a) iniciace b) propagace c) terminace CH 3 Cl + …CH 2 Cl 2

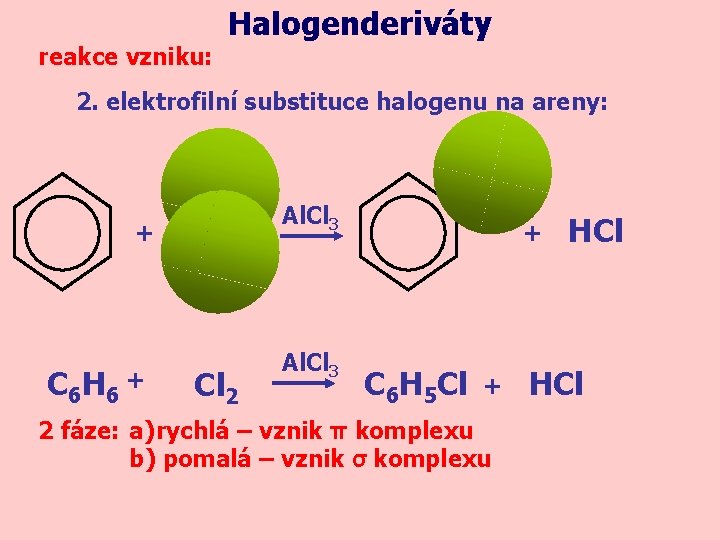
reakce vzniku: Halogenderiváty 2. elektrofilní substituce halogenu na areny: Al. Cl 3 + C 6 H 6 + Cl 2 Al. Cl 3 + C 6 H 5 Cl + 2 fáze: a) rychlá – vznik π komplexu b) pomalá – vznik σ komplexu HCl

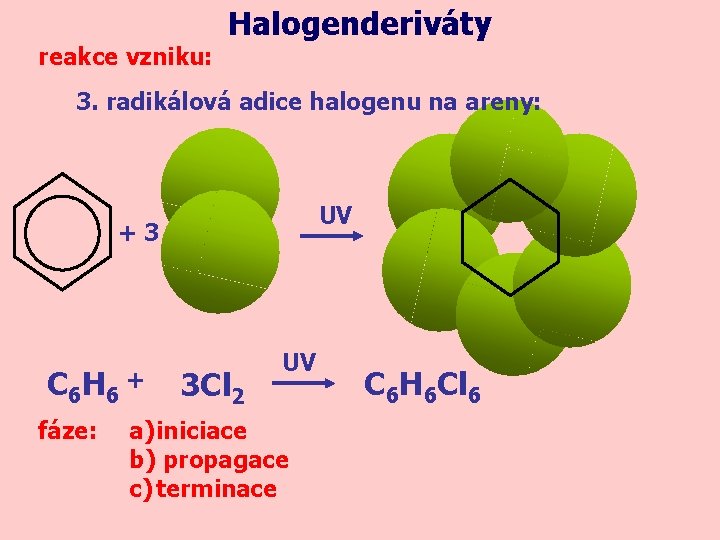
reakce vzniku: Halogenderiváty 3. radikálová adice halogenu na areny: UV +3 C 6 H 6 + fáze: 3 Cl 2 UV a) iniciace b) propagace c) terminace C 6 H 6 Cl 6

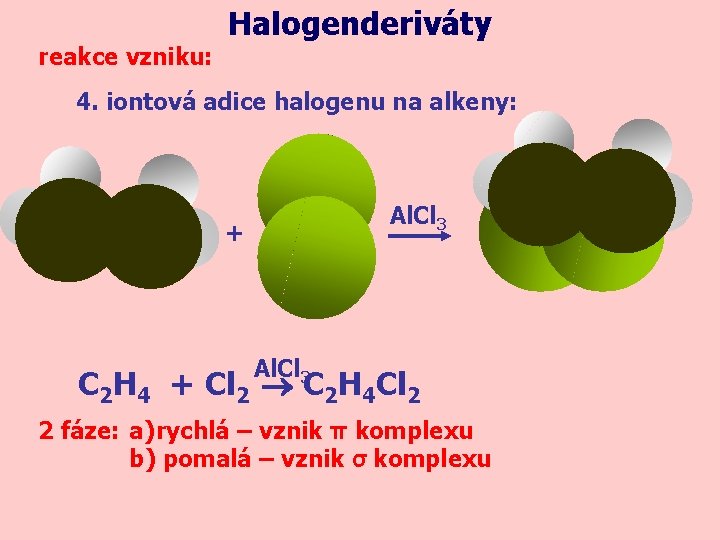
reakce vzniku: Halogenderiváty 4. iontová adice halogenu na alkeny: Al. Cl 3 + Al. Cl 3 C 2 H 4 + Cl 2 C 2 H 4 Cl 2 2 fáze: a) rychlá – vznik π komplexu b) pomalá – vznik σ komplexu

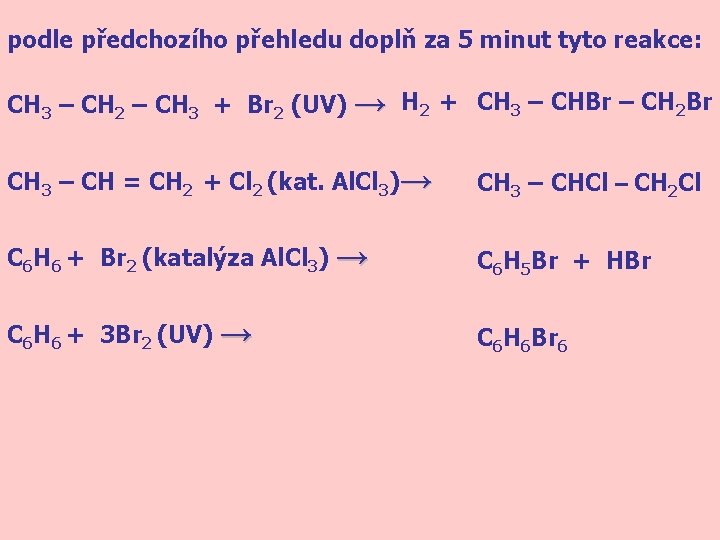
podle předchozího přehledu doplň za 5 minut tyto reakce: CH 3 – CH 2 – CH 3 + Br 2 (UV) → H 2 + CH 3 – CHBr – CH 2 Br CH 3 – CH = CH 2 + Cl 2 (kat. Al. Cl 3)→ CH 3 – CHCl – CH 2 Cl C 6 H 6 + Br 2 (katalýza Al. Cl 3) → C 6 H 5 Br + HBr C 6 H 6 + 3 Br 2 (UV) → C 6 H 6 Br 6

HALOGENDERIVÁTY Vytvořeno v rámci projektu Gymnázium Sušice - Brána vzdělávání II Autor: Mgr. Radovan Sloup, Gymnázium Sušice Předmět: Chemie (Organická chemie) Třída: septima osmiletého gymnázia Označení: VY_32_INOVACE_Ch-2_01 Datum vytvoření: září 2012 Anotace a metodické poznámky Prezentace je určena pro shrnutí chemie halogenderivátů v rozsahu SŠ, pro zopakování základních reakcí jejich vzniku. Materiál je vhodné podle možností doplnit reálným experimentem, například reakcí ethenu s chlorem. Použité materiály: Honza, J. ; Mareček, A. ; Chemie pro čtyřletá gymnázia (3. díl). Brno: Da. Ta. Print, 2000; ISBN 80 -7182 -057 -1 Pacák, J. ; Chemie pro 2. ročník gymnázií. Praha: SPN, 1985 Obrázky, animace a schémata jsou dílem autora prezentace. Vše je vytvořeno pomocí nástrojů Power Point 2003, Chem. Sketch 11. 01, Zoner. Photo. Studio 14 Materiály jsou určeny pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízení. Jakékoliv další využití podléhá autorskému zákonu.



















