FRMULA MNIMA O EMPRICA Y FRMULA MOLECULAR FORMULA














- Slides: 14

FÓRMULA MÍNIMA O EMPÍRICA Y FÓRMULA MOLECULAR

FORMULA MÍNIMA La fórmula mínima indica la relación mínima de números enteros de los átomos presentes en una molécula, aunque no necesariamente el número real. Las fórmulas empíricas se escriben de tal manera que los subíndices de las fórmulas moleculares sean reducidos a números enteros pequeños lo más posible, si alterar la relación que exista entre ellos. Las fórmulas verdaderas de las moléculas de los compuestos son las fórmulas moleculares.

EJEMPLOS: El acetileno es un gas que se utiliza como combustible en sopletes para soldar. Este compuesto tiene la fórmula molecular C 2 H 2. La relación de átomos de carbono a átomos de hidrógeno es de 2: 2 o 1: 1. La fórmula empírica o mínima del acetileno es CH.

DOS O MÁS SUBSTANCIAS PUEDEN TENER LA MISMA FÓRMULA EMPÍRICA PERO DIFERENTE FÓRMULA MOLECULAR: El formaldehído tiene la fórmula mínima y molecular CH 2 O. Se usa como antiséptico, en la preservación de piezas anatómicas, embalsamamiento de cadáveres, como fungicida y desodorante. También se usa en la obtención de resinas sintéticas. El ácido acético tiene la fórmula mínima CH 2 O y molecular C 2 H 4 O 2. La solución de ácido acético al 5 % en agua se conoce como vinagre que se utiliza como conservador en alimentos.

Al analizar un compuesto desconocido, el primer paso que realizan los químicos es la determinación de la fórmula empírica. El análisis químico permite determinar el número de gramos de cada elemento en cierta cantidad de un compuesto. Enseguida, las cantidades en gramos de cada elemento se convierten número de moles. La fórmula empírica de un compuesto se determina utilizando el método, como en los ejemplos siguientes:

PROBLEMAS RESUELTOS 1. 2. El análisis de una muestra de sal reporta que contiene 56. 58 % de potasio, K; 8. 68 % de Carbono, C y 34. 73 % de Oxígeno, O. Determinar la fórmula empírica de este compuesto. Determinaremos la fórmula empírica de acuerdo a los siguientes pasos: Suponemos una cantidad inicial de 100 gramos del compuesto. Expresamos el porcentaje de cada elemento en gramos. Obtenemos el número de moles de cada elemento de acuerdo a la fórmula: n= Peso del elemento en gramos Peso atómico

n. K= 56. 58 gramos = 1. 447 mol 39. 10 g/mol n. C = 8. 68 gramos 12 g/mol = 0. 7233 mol n. O= 34. 73 gramos = 2. 1706 mol 16 g/mol

Dividimos cada valor obtenido en el paso anterior entre el menor de ellos, que corresponde al número de moles del carbono y de esta manera obtenemos los subíndices de los elementos en la fórmula empírica: Para el potasio: 1. 4470 mol = 2 0. 7233 mol Para el carbono: 0. 7233 mol = 1 0. 7233 mol Para el oxígeno: 2. 1706 mol = 3 0. 7233 mol

La fórmula mínima queda: K 2 CO 3 que corresponde al carbonato de potasio.

PROBLEMA RESUELTO Al combinarse 2. 233 gramos de hierro, Fe con 1. 926 gramos de azufre, S se formó un compuesto del cual determinaremos su fórmula empírica: Solución: Como en el caso anterior determinaremos el número de moles de cada elemento: n. Fe= __2. 233 g __ 55. 85 g/mol = 0. 03998 mol n. S= __ 1. 926 g ___ 32 g/mol = 0. 0601875 mol

Cada valor obtenido se divide entre el menor de ellos: Para el Fe: 0. 03998 mol = 1 0. 03998 mol Para el S: 0. 0601875 mol = 1. 5 0. 03998 mol Fe 1 S 1. 5 Observamos que para el caso del azufre no se tiene un número entero para escribirlo como subíndice en la fórmula empírica, el siguiente paso será multiplicar los valores obtenidos en el paso anterior por el número más pequeño que los convierta en enteros. En este caso multiplicamos por dos, lo cual, no cambia la relación entre átomos de Fe y S: Fe 2 S 3 Fórmula mínima

PROBLEMA PROPUESTO El benzoato de metilo se utiliza en la elaboración de perfumes. Una muestra de 5. 325 g de este compuesto contiene 3. 758 g de carbono C, 0. 316 g de hidrógeno, H y 1. 251 g de oxígeno, O. Obtener la fórmula empírica de esta substancia.

FÓRMULA MOLECULAR PROBLEMAS PROPUESTOS Determina las fórmulas mínima y molecular de la cafeína, estimulante que se encuentra en el café. Tiene una composición en peso de: 49. 5 % de carbono, 5. 15 % de hidrógeno, 28. 9 % de nitrógeno y 16. 5 % de oxígeno y un peso molar de 195 g. La hidroquinona es un compuesto orgánico que se usa como revelado en fotografía. Tiene un peso molar de 110. 1 g/mol y una composición de 65. 45 % de carbono, 5. 45 % de hidrógeno y 29. 09 % de oxígeno. Calcular la fórmula molecular de la hidroquinona.

 Sintagma adverbial
Sintagma adverbial Emprica
Emprica Emprica
Emprica Emprica
Emprica Emprica
Emprica Emprica
Emprica Emprica
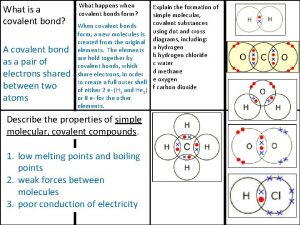
Emprica Covalent bond boiling point
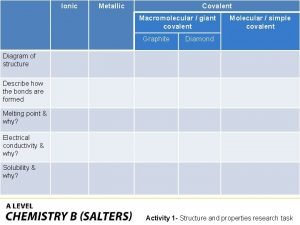
Covalent bond boiling point Ionic covalent metallic
Ionic covalent metallic Giant molecular structure vs simple molecular structure
Giant molecular structure vs simple molecular structure The chemical formula of a compound indicates
The chemical formula of a compound indicates Empirical formula vs molecular formula
Empirical formula vs molecular formula Empirical formula vs molecular formula
Empirical formula vs molecular formula Definition of molecular formula
Definition of molecular formula Empirical formula poem
Empirical formula poem