Etude cytogntique dune srie de 297 mylomes multiples







- Slides: 18

Etude cytogénétique d'une série de 297 myélomes multiples : expérience du laboratoire de Strasbourg Antoine ITTEL, Claire GEISS Laboratoire de Cytogénétique Hématologique Hôpital Hautepierre, Strasbourg

Autrement appelé maladie de Kahler Myélome multiple - 10 à 15% des pathologies hématologiques - comprend un large spectre de formes cliniques : depuis la forme asymptomatique à la forme agressive avec atteintes tissulaires multiples - diagnostic basé sur une combinaison de critères : § cliniques (douleurs osseuses, infections…) § biologiques (immunoglobuline monoclonale 50% Ig. G, 20% Ig. A, hypercalcémie, anémie, insuffisance rénale…) § radiologiques (lésions osseuses, ostéoporose, fractures…) - Survie : médiane à 3 -4 ans (de <6 mois à >10 ans) Présence d’un pic Normal Electrophorèse des protéines sériques D’après OMS 2008

Myélome multiple : définition D’après Rajkumar SV et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov; 15(12): e 538 -48

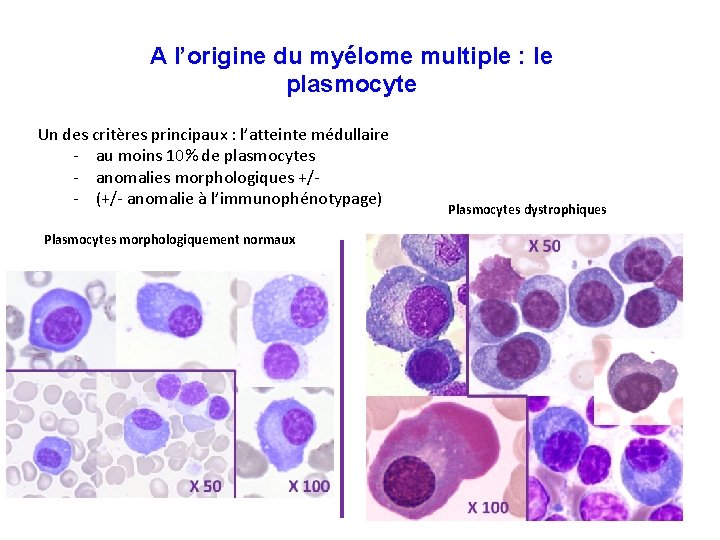
A l’origine du myélome multiple : le plasmocyte Un des critères principaux : l’atteinte médullaire - au moins 10% de plasmocytes - anomalies morphologiques +/- (+/- anomalie à l’immunophénotypage) Plasmocytes morphologiquement normaux Plasmocytes dystrophiques

Marqueur spécifique du plasmocyte : le CD 138 - étude cytogénétique : § difficile : faible capacité proliférative des plasmocytes tumoraux § essentielle : certaines altérations cytogénétiques ont un impact majeur sur le pronostic des patients Þ pour améliorer la spécificité et la sensibilité de l’étude cytogénétique, sélection des cellules CD 138+ (plasmocytes) CD 138 Anticorps anti-CD 138 : § Synonyme : protéoglycanne héparine sulfate, syndécanne-1

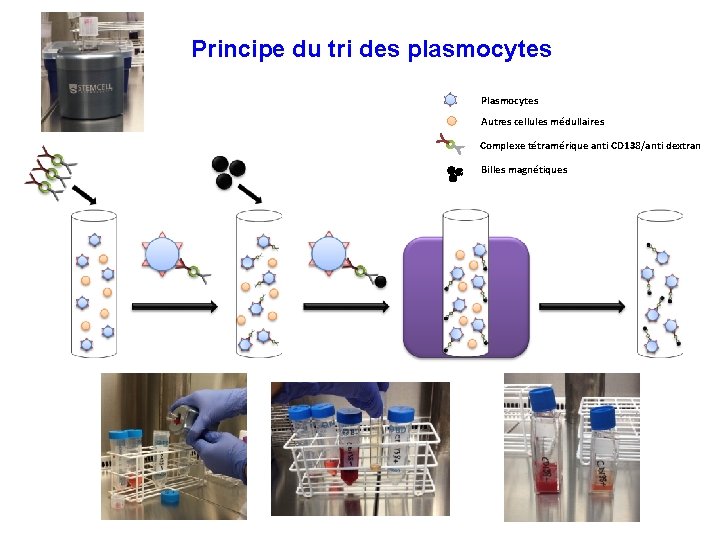
Tri des plasmocytes CD 138+ A Strasbourg, test de 2 kits de sélection sur microbilles magnétiques MACS ® Technology, Miltenyi Biotec D’après http: //www. miltenyibiotec. com/~/media/Files/Navigation/Cell %20 Separation/macs-technology-cell-isolation-brochure. ashx Easy. Sep™ Human CD 138 Positive Selection Kit, Stemcell Technologies

Principe du tri des plasmocytes Plasmocytes Autres cellules médullaires Complexe tétramérique anti CD 138/anti dextran Billes magnétiques

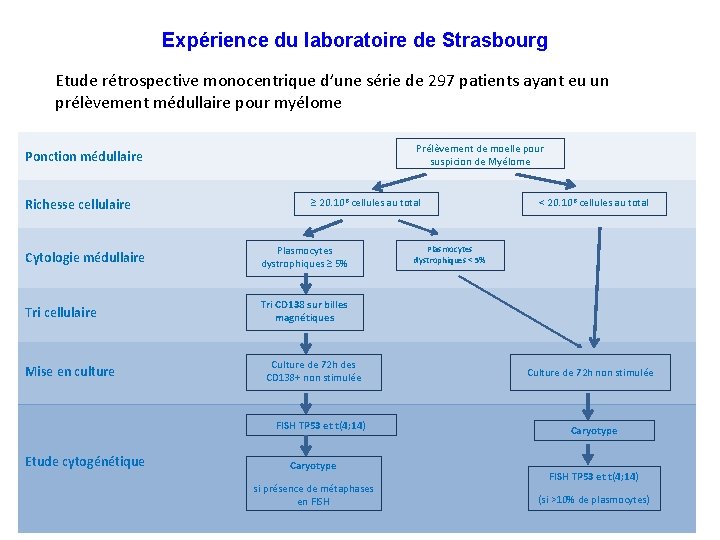
Expérience du laboratoire de Strasbourg Etude rétrospective monocentrique d’une série de 297 patients ayant eu un prélèvement médullaire pour myélome Prélèvement de moelle pour suspicion de Myélome Ponction médullaire Richesse cellulaire ≥ 20. 106 cellules au total Cytologie médullaire Plasmocytes dystrophiques ≥ 5% Tri cellulaire Tri CD 138 sur billes magnétiques Mise en culture Culture de 72 h des CD 138+ non stimulée FISH TP 53 et t(4; 14) Etude cytogénétique Caryotype si présence de métaphases en FISH < 20. 106 cellules au total Plasmocytes dystrophiques < 5% Culture de 72 h non stimulée Caryotype FISH TP 53 et t(4; 14) (si >10% de plasmocytes)

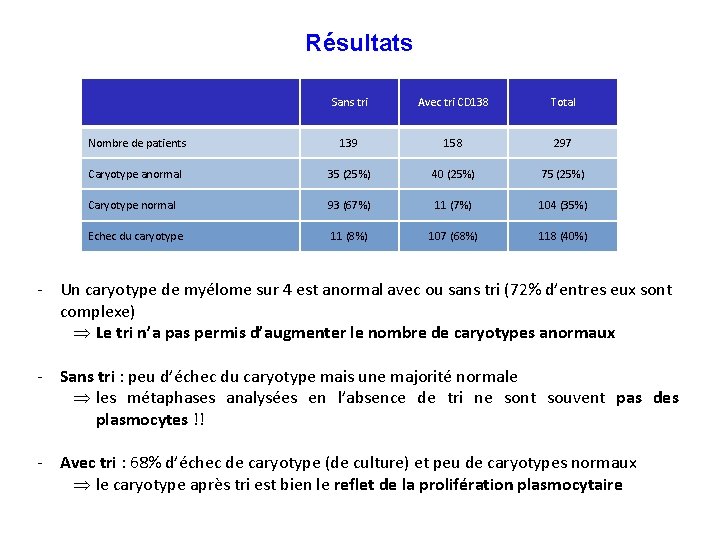
Résultats Sans tri Avec tri CD 138 Total Nombre de patients 139 158 297 Caryotype anormal 35 (25%) 40 (25%) 75 (25%) Caryotype normal 93 (67%) 11 (7%) 104 (35%) Echec du caryotype 11 (8%) 107 (68%) 118 (40%) - Un caryotype de myélome sur 4 est anormal avec ou sans tri (72% d’entres eux sont complexe) Þ Le tri n’a pas permis d’augmenter le nombre de caryotypes anormaux - Sans tri : peu d’échec du caryotype mais une majorité normale Þ les métaphases analysées en l’absence de tri ne sont souvent pas des plasmocytes !! - Avec tri : 68% d’échec de caryotype (de culture) et peu de caryotypes normaux Þ le caryotype après tri est bien le reflet de la prolifération plasmocytaire

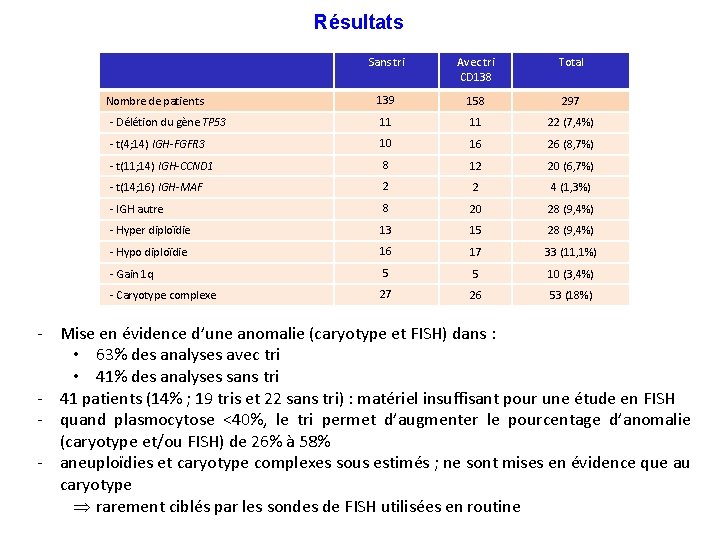
Résultats Sans tri Avec tri CD 138 Total 139 158 297 - Délétion du gène TP 53 11 11 22 (7, 4%) - t(4; 14) IGH-FGFR 3 10 16 26 (8, 7%) - t(11; 14) IGH-CCND 1 8 12 20 (6, 7%) - t(14; 16) IGH-MAF 2 2 4 (1, 3%) - IGH autre 8 20 28 (9, 4%) - Hyper diploïdie 13 15 28 (9, 4%) - Hypo diploïdie 16 17 33 (11, 1%) - Gain 1 q 5 5 10 (3, 4%) - Caryotype complexe 27 26 53 (18%) Nombre de patients - Mise en évidence d’une anomalie (caryotype et FISH) dans : • 63% des analyses avec tri • 41% des analyses sans tri - 41 patients (14% ; 19 tris et 22 sans tri) : matériel insuffisant pour une étude en FISH - quand plasmocytose <40%, le tri permet d’augmenter le pourcentage d’anomalie (caryotype et/ou FISH) de 26% à 58% - aneuploïdies et caryotype complexes sous estimés ; ne sont mises en évidence que au caryotype Þ rarement ciblés par les sondes de FISH utilisées en routine

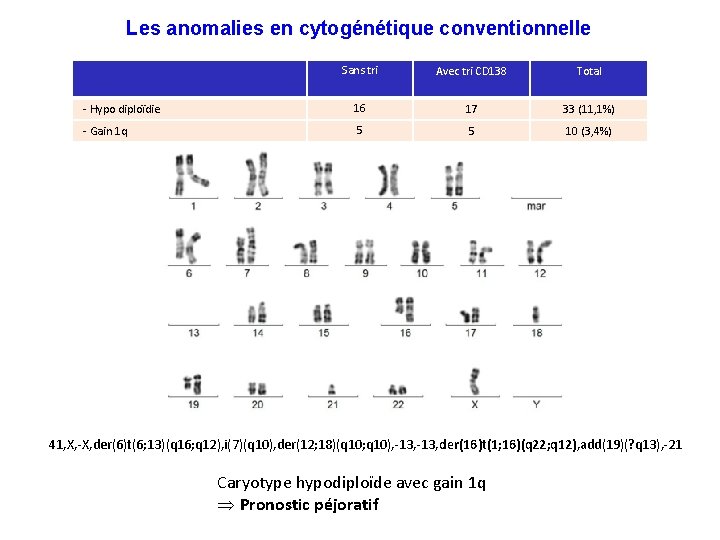
Les anomalies en cytogénétique conventionnelle Sans tri Avec tri CD 138 Total - Hypo diploïdie 16 17 33 (11, 1%) - Gain 1 q 5 5 10 (3, 4%) 41, X, -X, der(6)t(6; 13)(q 16; q 12), i(7)(q 10), der(12; 18)(q 10; q 10), -13, der(16)t(1; 16)(q 22; q 12), add(19)(? q 13), -21 Caryotype hypodiploïde avec gain 1 q Þ Pronostic péjoratif

Les anomalies en cytogénétique conventionnelle - Hyper diploïdie Sans tri Avec tri CD 138 Total 13 15 28 (9, 4%) 55, X, +3, +5, +6, +7, +9, +11, +15, +17, +18, +19 Caryotype hyperdiploïde

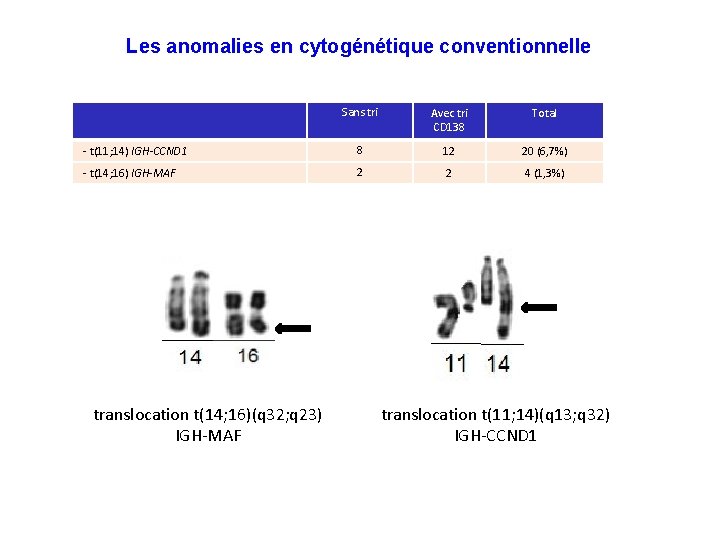
Les anomalies en cytogénétique conventionnelle Sans tri Avec tri CD 138 Total - t(11; 14) IGH-CCND 1 8 12 20 (6, 7%) - t(14; 16) IGH-MAF 2 2 4 (1, 3%) translocation t(14; 16)(q 32; q 23) IGH-MAF translocation t(11; 14)(q 13; q 32) IGH-CCND 1

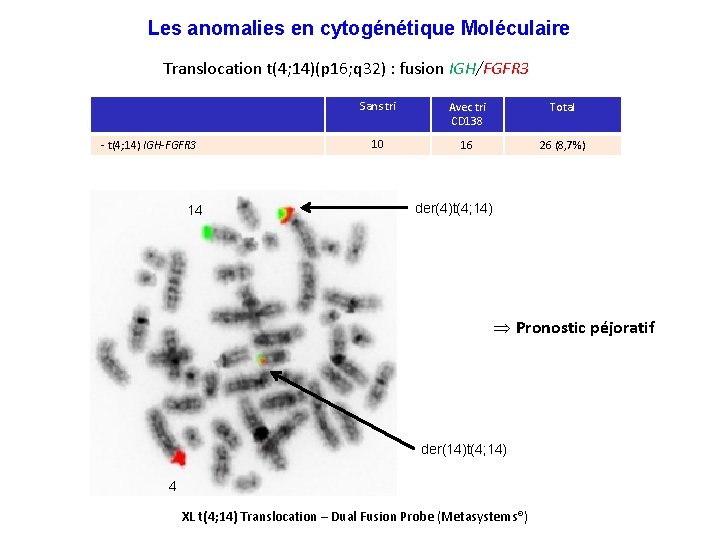
Les anomalies en cytogénétique Moléculaire Translocation t(4; 14)(p 16; q 32) : fusion IGH/FGFR 3 - t(4; 14) IGH-FGFR 3 14 Sans tri Avec tri CD 138 Total 10 16 26 (8, 7%) der(4)t(4; 14) Þ Pronostic péjoratif der(14)t(4; 14) 4 XL t(4; 14) Translocation – Dual Fusion Probe (Metasystems®)

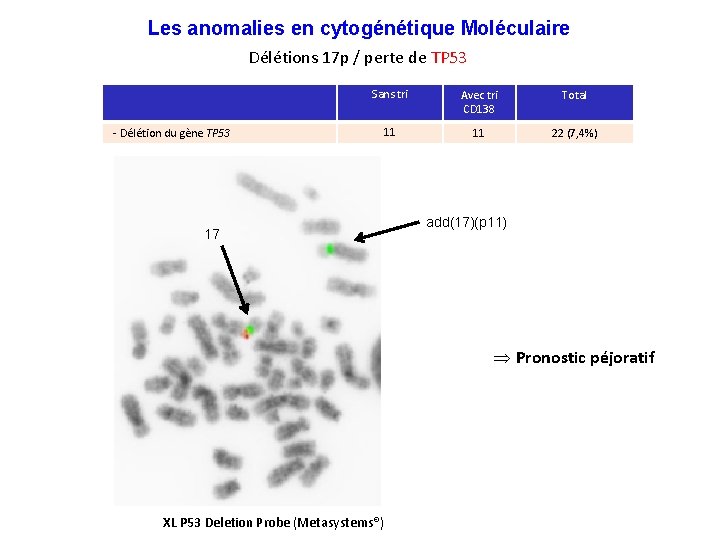
Les anomalies en cytogénétique Moléculaire Délétions 17 p / perte de TP 53 - Délétion du gène TP 53 Sans tri Avec tri CD 138 Total 11 11 22 (7, 4%) 17 add(17)(p 11) Þ Pronostic péjoratif XL P 53 Deletion Probe (Metasystems®)

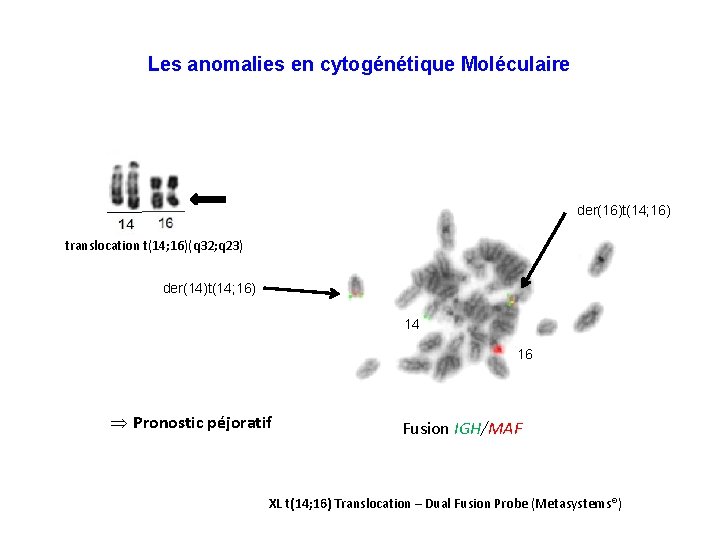
Les anomalies en cytogénétique Moléculaire der(16)t(14; 16) translocation t(14; 16)(q 32; q 23) der(14)t(14; 16) 14 16 Þ Pronostic péjoratif Fusion IGH/MAF XL t(14; 16) Translocation – Dual Fusion Probe (Metasystems®)

Conclusion - Etude cytogénétique des plasmocytes essentielle car impact pronostique ++ - Avantages du tri : - caryotype : beaucoup d’échec mais reflet de la pousse plasmocytaire - FISH : enrichissement en plasmocytes donc meilleure spécificité et sensibilité - Globalement, plus d’anomalies mises en évidence - Pour des raisons techniques, tri impossible si prélèvement pauvre et/ou peu de plasmocytes (intérêt de la culture ? ) - Recommandations du GFCH : t(4; 14), TP 53, voire (2016 ? ) +/- sonde 1 p (perte) et 1 q (gain) Þ Utilisation de nouvelles sondes de FISH pour cibler les anomalies de mauvais pronostic

Remerciements A l’ensemble de l’équipe du laboratoire de cytogénétique hématologique Dr Carine GERVAIS Eric, Catherine, Odile, Catherine, Xavier, Catherine, Fadoua, Cathy, Claudine, Magali A l’ensemble de l’équipe du laboratoire d’hématologie En particulier Dr Laurie MONIER, Dr Caroline MAYEUR-ROUSSE, Dr Anne-Cécile GALOISY Au Dr Isabelle JAHN du laboratoire d’immunologie