ESTEQUIOMETRIA QUIMICA GENERAL CONTENIDO Afinidad Qumica Nocin de













- Slides: 16

ESTEQUIOMETRIA QUIMICA GENERAL

CONTENIDO » Afinidad Química. » Noción de Valencia. » Formulación. » Nomenclatura.

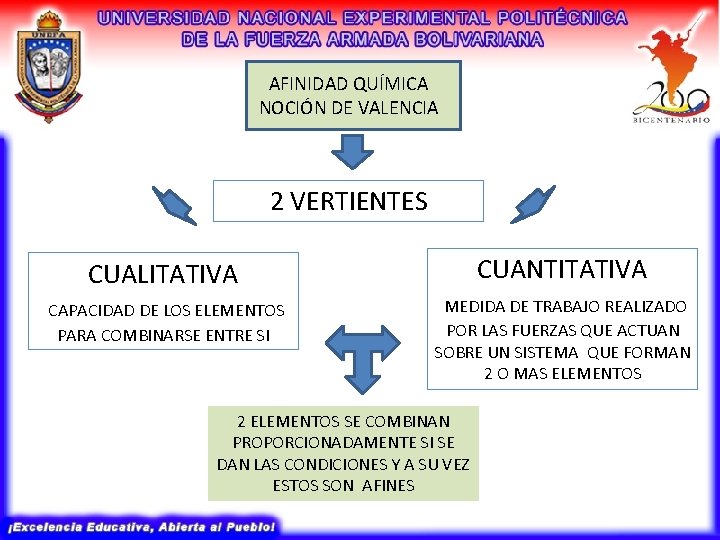
AFINIDAD QUÍMICA NOCIÓN DE VALENCIA 2 VERTIENTES CUALITATIVA CUANTITATIVA CAPACIDAD DE LOS ELEMENTOS PARA COMBINARSE ENTRE SI MEDIDA DE TRABAJO REALIZADO POR LAS FUERZAS QUE ACTUAN SOBRE UN SISTEMA QUE FORMAN 2 O MAS ELEMENTOS 2 ELEMENTOS SE COMBINAN PROPORCIONADAMENTE SI SE DAN LAS CONDICIONES Y A SU VEZ ESTOS SON AFINES

EJEMPLO: HIDROGENO + OXIGENO AGUA LA MOLECULA DEL COMPUESTO FORMADO, AGUA, POSEE 2 ATOMOS DE HIDROGENO Y UNO DE OXIGENO EL OXIGENO “VALE” (O POSEE VALENCIA) DOBLE QUE EL HIDROGENO. DE ESTE MODO PODEMOS DEFINIR: VALENCIA DE UN ELEMENTO ES EL NUMERO DE ATOMOS DE HIDROGENO NECESARIOS PARA FORMAR UN ELEMENTO QUIMICO. DICHO DE OTRO MODO: AL HIDROGENO SE LE ASIGNA LA VALENCIA 1, Y SI UN ELEMENTO REQUIERE UN SOLO ATOMO DE HIDROGENO POSEERA ASI MISMO VALENCIA 1; SI OTRO ELEMENTO REQUIERE 2 ATOMOS DE HIDROGENO, POSEERA VALENCIA 2 (COMO EL OXIGENO) Y ASI SUCESIVAMENTE, HASTA UN MAXIMO DE 7.

DE LOS 105 A 109 ELEMENTOS QUE SE ESTUDIAN EN LA TABLA PERIODICA LOS PODEMOS CLASIFICAR SEGÚN SU VALENCIA 1 ELEMENTOS MONOVALENTES VALENCIA 2 ELEMENTOS DIVALENTES VALENCIA 3 ELEMENTOS TRIVALENTES VALENCIA 4 ELEMENTOS TETRAVALENTES VALENCIA 5 ELEMENTOS PENTAVALENTES VALENCIA 6 ELEMENTOS HEXAVALENTES VALENCIA 7 ELEMENTOS HEPTAVALENTES LOS MAS FRECUENTES EN LA TABLA PERIODICA

FORMULACION Y NOMENCLATURA FORMULACION NOMENCLATURA LA APLICACIÓN DE UN CONJUNTO DE REGLAS QUE SIRVE PARA ESCRIBIR LA FORMULA DE UNA MOLECULA LAS FORMULAS QUE SE RIGEN POR UNA SERIE DE LEYES ELABORADAS DE ACUERDO A LA ESTRUCTURA DE LA MOLECULA

FORMULACION DE MOLECULAS FORMADAS POR UN SOLO ELEMENTO QUIMICO EXISTEN MOLECULAS MONOATOMICAS (UN SOLO ATOMO): ESTA SON CARACTRISTICAS DE LOS METALES, TALES COMO EL C, Na Y Mg LA MAYORIA DE LOS NO METALES FORMAN MOLECULAS POLIATOMICAS CON UN NUMERO PAR DE ATOMOS: MOLECULAS DIATOMICAS: F 2, Cl 2, Br 2, I 2, N 2 Y O 2 MOLECULAS TETRAATOMICAS: P 4, As 4 MOLECULAS OCTOATOMICAS: S 8, Se 8

FORMULACION Y NOMENCLATURA COMPUESTOS BINARIOS OXIDOS BASICOS PEROXIDOS BASICOS COMBINACIONES DE UN METAL CON UN NO METAL DIFERENTE AL OXIGENO COMBINACIONES DE UN METAL O UN NO METAL CON EL HIDROGENO

FORMULACION Y NOMENCLATURA COMPUESTOS BINARIOS PASOS PARA LA FORMULACION 1 -. PARA ESCRIBIR LA FORMULA EMPIRICA DE UN COMPUESTO BINARIO, COLOCANDO PRIMERO LOS SIMBOLOS DE LOS ELEMENTOS, LUEGO COMO SUBINDICE LA VALENCIA DEL OTRO, (INTERCAMBIO DE VALENCIA). SI ESTOS SON MULTIPLOS DE UN MISMO NUMERO SE DIVIDEN POR ESTE. EJEMPLO: O DE VALENCIA 2 Y EL Ca DE VALENCIA 2, TAMBIEN ESCRIBIMOS LOS SIMBOLOS: Ca. O, Ca 2 O 2, POR SER IGUALES LAS DEJAMOS IGUAL Y EL 2 ES MULTIPLO DE 2, AL DIVIDIR Ca. O = OXIDO DE CALCIO Ca 2/2 O 2/2, SERA:

EJEMPLO: PARA EL HIDROGENO: H S DE VALENCIA 2, ESCRIBIMOS LOS SIMBOLOS: DE VALENCIA 1 Y EL AZUFRE SH, S 1 H 2, EL 1 ES EL MULTIPLO, Y AL DIVIDIR S 1/1 O 2/1, SERA: SH 2 O SH 2 = SULFURO DE HIDROGENO

FORMULACION Y NOMENCLATURA OXIDOS BASICOS, PEROXIDO Y OXIDOS ACIDOS OXIDOS BASICOS OXIDO, A CONTINUACION, EL NOMBRE DEL METAL, SIGUIENDO LOS MISMOS PASOS, ESTOS SE NOMBRAN CON LA PALABRA SEGUIDA DE LA PREPOSICION DE Y, EJEMPLO: Ca. O = OXIDO DE CALCIO Fe 2 O 3 = OXIDO DE HIERRO SI EL METAL O NO METAL USA LA VALENCIA MAYOR SE USA EL SUFIJO OSO SI EL METAL O NO METAL USA LA VALENCIA MENOR SE USA EL SUFIJO ICO Fe 2 O 3 = OXIDO DE HIERRO, PUDIERA LLAMARSE: Fe 2 O 3 = OXIDO FERROSO

FORMULACION Y NOMENCLATURA OXIDOS BASICOS, PEROXIDO Y OXIDOS ACIDOS PEROXIDOS EL OXIGENO FIGURA COMO ELEMENTO RADICAL PARTICIPANDO NO COMO MOLECULA, PERO DE FORMA DOBLE Y CADA UNO CON VALENCIA 1, PERO EN TOTAL ACTUANDO COMO VALENCIA 2, O 2 LA FORMULA NO SE SIMPLIFICA SI EL OXIGENO QUEDA COMO O 2 Y SI EN OTRO CASO. PARA LA NOMENCLATURA: SE EMPLEAN LAS PALABRAS PEROXIDO DE SEGUIDAS DEL NOMBRE DEL METAL

EJEMPLO: FORMULAR EL PEROXIDO DE BARIO. Ba O ESTE TRABAJA CON VALENCIA 2 O 2, Y COMO ATOMO TIENE VALENCIA 2 Ba 2(O 2)2 Ba 2/2(O 2)2/2 TRABAJA COMO RADICAL Ba. O 2 = PEROXIDO DE BARIO EN CASO DE NO METALES: SO 2 N 2 O 3 Cl 2 O = DIOXIDO DE AZUFRE = TRIOXIDO DE DINITROGENO = MONOXIDO DE DICLORO

FORMULACION Y NOMENCLATURA COMBINACIONES BINARIAS DE UN METAL CON UN NO METAL DISTINTOS AL OXIGENO COMBINACIONES BINARIAS METAL – NO METAL GRUPO IV GRUPO VII B C N S F Si P Se Cl BORURO CARBURO SILICIURO NITRURO FOSFURO As ARSENIURO Sb ANTIMONIURO SULFURO SELENIURO Te TELELURO FLUORURO CLORURO Br BROMURO I IODURO

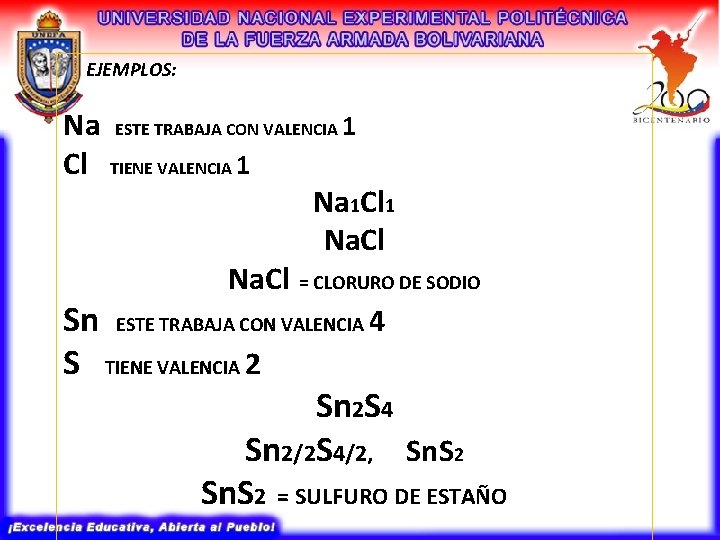
EJEMPLOS: Na Cl ESTE TRABAJA CON VALENCIA 1 TIENE VALENCIA 1 Na 1 Cl 1 Na. Cl = CLORURO DE SODIO Sn ESTE TRABAJA CON VALENCIA 4 S TIENE VALENCIA 2 Sn 2 S 4 Sn 2/2 S 4/2, Sn. S 2 = SULFURO DE ESTAÑO

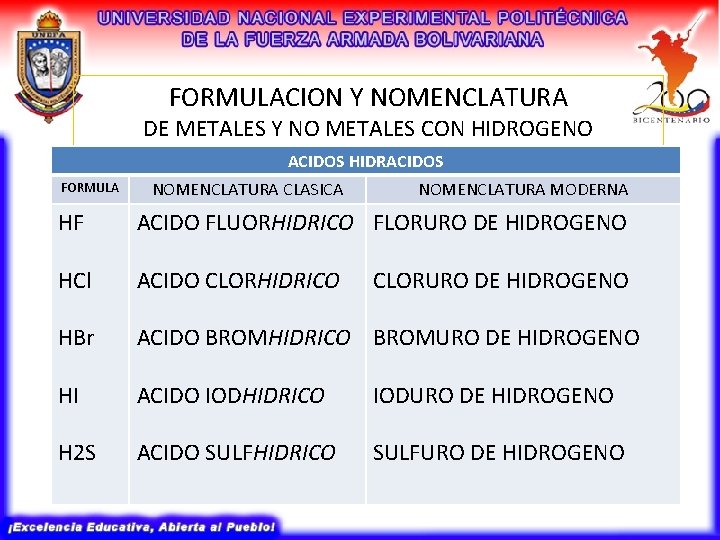
FORMULACION Y NOMENCLATURA DE METALES Y NO METALES CON HIDROGENO ACIDOS HIDRACIDOS FORMULA NOMENCLATURA CLASICA NOMENCLATURA MODERNA HF ACIDO FLUORHIDRICO FLORURO DE HIDROGENO HCl ACIDO CLORHIDRICO HBr ACIDO BROMHIDRICO BROMURO DE HIDROGENO HI ACIDO IODHIDRICO IODURO DE HIDROGENO H 2 S ACIDO SULFHIDRICO SULFURO DE HIDROGENO CLORURO DE HIDROGENO
 Stoicheon
Stoicheon Nocin
Nocin A palavra estequiometria do grego
A palavra estequiometria do grego N=mxv
N=mxv Estequiometria
Estequiometria Formula del numero de avogadro
Formula del numero de avogadro Medioab
Medioab 20000x160
20000x160 Conclusion de estequiometria
Conclusion de estequiometria Radio atómico
Radio atómico Clasificacion de los elementos
Clasificacion de los elementos Homologia y afinidad
Homologia y afinidad Diagrama de afinidad
Diagrama de afinidad Cuáles son las propiedades de un átomo
Cuáles son las propiedades de un átomo Que es analogias
Que es analogias Formado
Formado Catalisis enzimatica
Catalisis enzimatica






























