Estado Gasoso LEIS VOLUMTRICAS DAS REAES QUMICAS Se






- Slides: 13

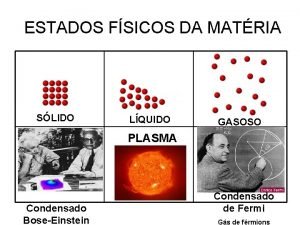
Estado Gasoso

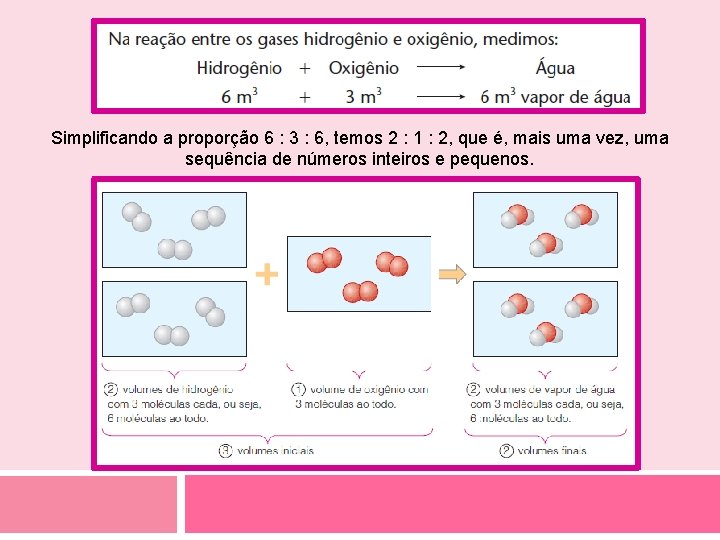
LEIS VOLUMÉTRICAS DAS REAÇÕES QUÍMICAS Se referem aos volumes dos gases que participam de uma reação química Lei volumétrica de Gay-Lussac Quando medidos nas mesmas condições de pressão e temperatura, os volumes dos reagentes e dos produtos gasosos formam uma proporção constante, de números inteiros e pequenos. Simplificando esses números, temos 1 : 2, que é uma proporção de números inteiros e pequenos

Simplificando a proporção 6 : 3 : 6, temos 2 : 1 : 2, que é, mais uma vez, uma sequência de números inteiros e pequenos.

Hipótese ou lei de Avogadro Volumes iguais de diferentes gases, a uma mesma temperatura e pressão, contêm igual número de moléculas.

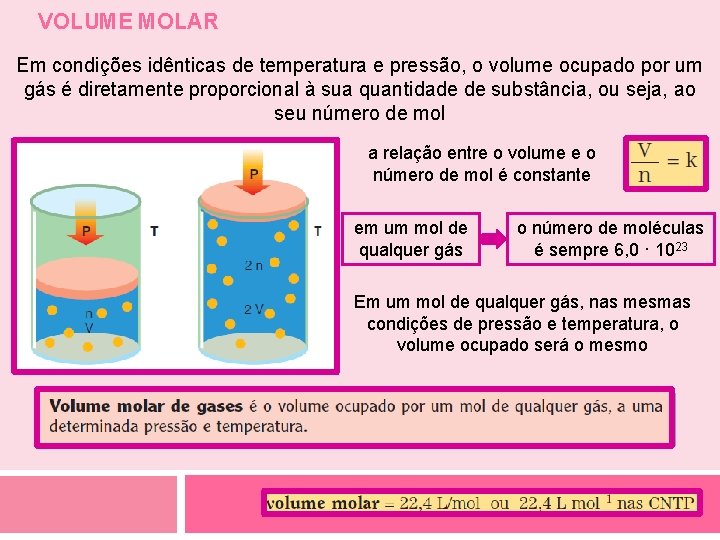
VOLUME MOLAR Em condições idênticas de temperatura e pressão, o volume ocupado por um gás é diretamente proporcional à sua quantidade de substância, ou seja, ao seu número de mol a relação entre o volume e o número de mol é constante em um mol de qualquer gás o número de moléculas é sempre 6, 0 · 1023 Em um mol de qualquer gás, nas mesmas condições de pressão e temperatura, o volume ocupado será o mesmo

EQUAÇÃO DE ESTADO DOS GASES PERFEITOS Para uma massa constante de um mesmo gás, a relação é sempre válida: Isso significa que, por mais que variem o volume (V ), a pressão (P ) e a temperatura absoluta (T ), a fração PV/T permanece constante Supondo que tivéssemos 1 mol de gás nas condições normais de pressão (P = 1 atm) e temperatura (T = 273 K). Sabemos que 1 mol de qualquer gás, nessas condições, ocupa o volume molar (V= 22, 4 litros/mol). constante universal dos gases perfeitos

Equação de Estado dos Gases Perfeitos ou Equação de Clapeyron. Qualquer gás que obedeça a essa lei será considerado um gás perfeito ou ideal

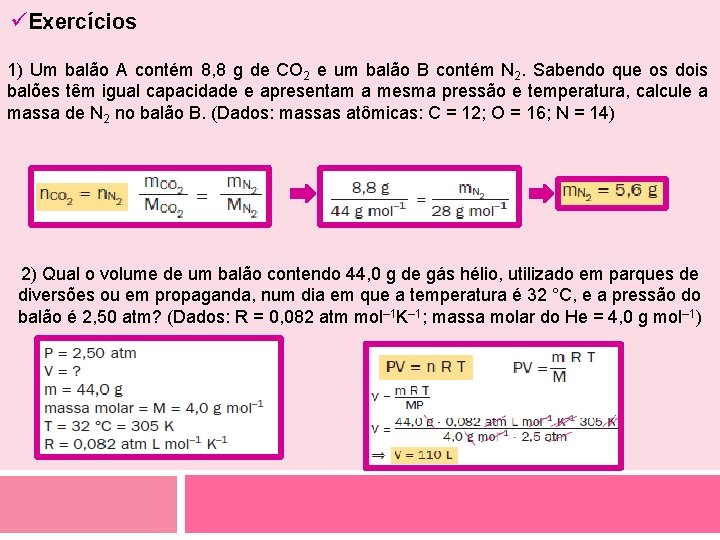
üExercícios 1) Um balão A contém 8, 8 g de CO 2 e um balão B contém N 2. Sabendo que os dois balões têm igual capacidade e apresentam a mesma pressão e temperatura, calcule a massa de N 2 no balão B. (Dados: massas atômicas: C = 12; O = 16; N = 14) 2) Qual o volume de um balão contendo 44, 0 g de gás hélio, utilizado em parques de diversões ou em propaganda, num dia em que a temperatura é 32 °C, e a pressão do balão é 2, 50 atm? (Dados: R = 0, 082 atm mol– 1 K– 1; massa molar do He = 4, 0 g mol– 1)

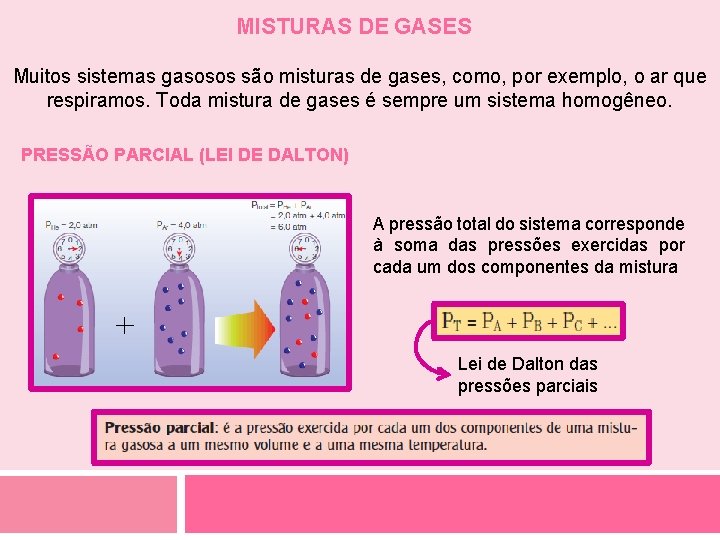
MISTURAS DE GASES Muitos sistemas gasosos são misturas de gases, como, por exemplo, o ar que respiramos. Toda mistura de gases é sempre um sistema homogêneo. PRESSÃO PARCIAL (LEI DE DALTON) A pressão total do sistema corresponde à soma das pressões exercidas por cada um dos componentes da mistura Lei de Dalton das pressões parciais

A pressão parcial exercida por cada gás é diretamente proporcional ao número de mol do gás. A pressão total é diretamente proporcional ao número total de mol VOLUME PARCIAL (LEI DE AMAGAT) Fração Molar : relação entre o número de mol de um gás e o número total de mol da mistura.

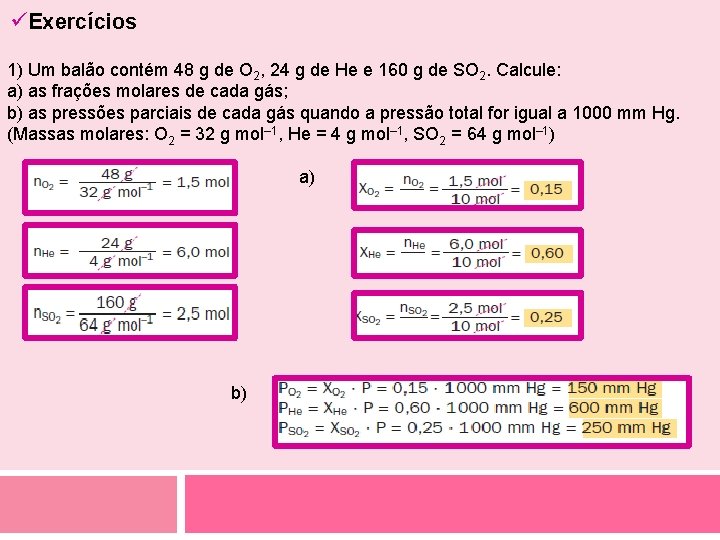
üExercícios 1) Um balão contém 48 g de O 2, 24 g de He e 160 g de SO 2. Calcule: a) as frações molares de cada gás; b) as pressões parciais de cada gás quando a pressão total for igual a 1000 mm Hg. (Massas molares: O 2 = 32 g mol– 1, He = 4 g mol– 1, SO 2 = 64 g mol– 1) a) b)

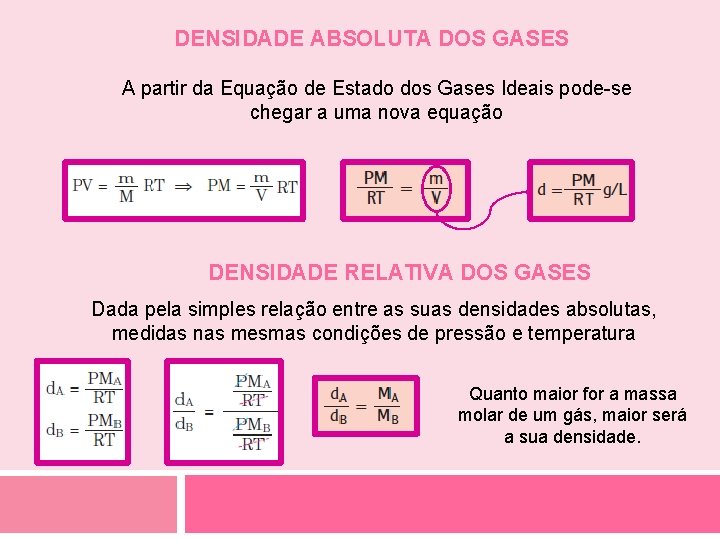
DENSIDADE ABSOLUTA DOS GASES A partir da Equação de Estado dos Gases Ideais pode-se chegar a uma nova equação DENSIDADE RELATIVA DOS GASES Dada pela simples relação entre as suas densidades absolutas, medidas nas mesmas condições de pressão e temperatura Quanto maior for a massa molar de um gás, maior será a sua densidade.

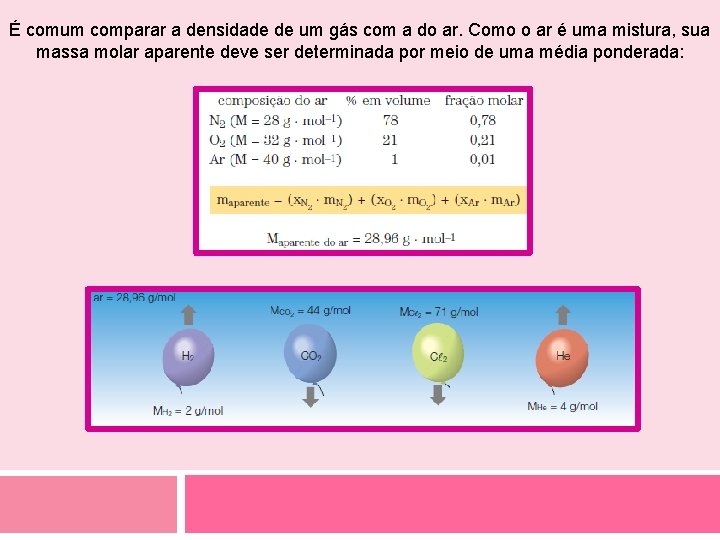
É comum comparar a densidade de um gás com a do ar. Como o ar é uma mistura, sua massa molar aparente deve ser determinada por meio de uma média ponderada:
 Estado liquido para gasoso
Estado liquido para gasoso Qumicas
Qumicas Tudo no estado nada contra o estado e nada fora do estado
Tudo no estado nada contra o estado e nada fora do estado Condensado de bose-einstein exemplo
Condensado de bose-einstein exemplo Lei das doze tábuas
Lei das doze tábuas Espírito das leis
Espírito das leis Roma linha do tempo
Roma linha do tempo Estudo das leis fundamentais do pensamento
Estudo das leis fundamentais do pensamento Estado actual estado deseado
Estado actual estado deseado Formação das cidades-estado gregas
Formação das cidades-estado gregas 4 leis da espiritualidade
4 leis da espiritualidade As sete leis do aprendizado
As sete leis do aprendizado Leis ponderais e balanceamento
Leis ponderais e balanceamento Sandra leis
Sandra leis