Elektromagnetick spektrum Frekvence Vlnov dlka Rychlost svtla c













- Slides: 26

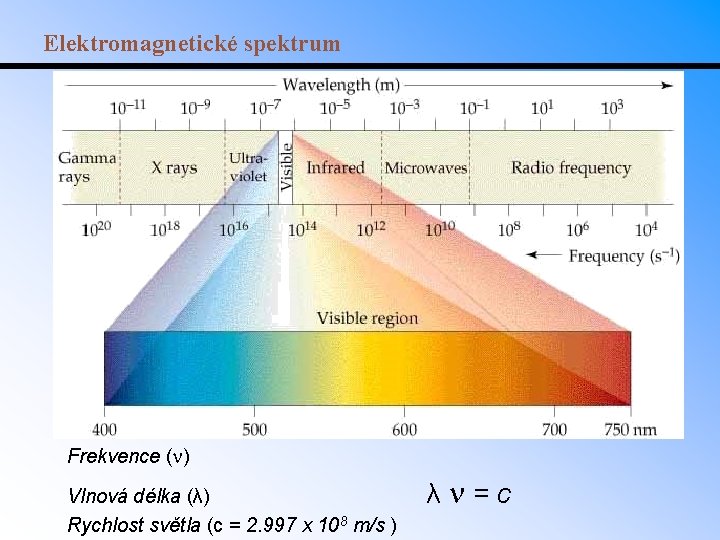
Elektromagnetické spektrum Frekvence ( ) Vlnová délka (λ) Rychlost světla (c = 2. 997 x 108 m/s ) λ =c

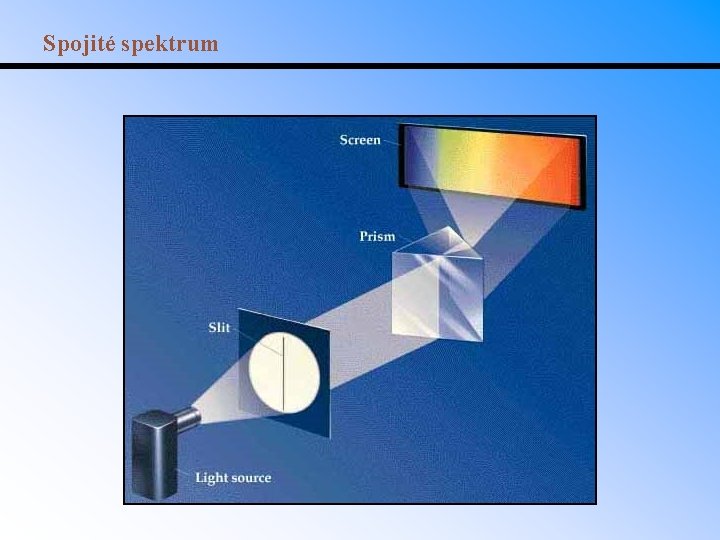
Spojité spektrum

Příklad čárového spektra (emisní spektrum vodíku)

Elektromagnetické záření a atomová spektra • Spektrum: charakteristický vzor vlnových délek absorbovaných nebo emitovaných látkou • Emisní spektrum: vzniká při spontánní emisi záření z excitovaného atomu nebo molekuly • Čárové spektrum: spektrum obsahuje pouze jisté vlnové délky (čárové spektrum je typické pro plyny) • Balmer (1885) pozoroval čárové spektrum vodíku ve viditelné oblasti při vlnových délkách 656. 3 nm, 486. 1 nm, 434. 0 nm, 410. 1 nm • Balmerova rovnice: kde n = 3, 4. . . • Rovnice byla navržena empiricky, R = Rydbergova konstanta = 1. 097 x 107 m 1

Emisní spektrum vodíkového atomu • Postupně byla pozorována emisní spektra vodíku i v dalších spektrálních oblastech: • Lymanova série ultrafialové • Paschenova, Brackettova, Pfundova infračervené • Balmerova-Rydbergova rovnice je rozšířením původního Balmerova vztahu: • • kde m = 1, 2, 3, … a n = 2, 3, …(nejméně m + 1) Emisní čára při nejdelší vlnové délce odpovídá n = m + 1 Čáry při nejmenších vlnových délkách (emisní hrana) jsou pozorovány když n = Př. : Určete vlnovou délku první čáry v Paschenově sérii (m = 3, n = 4). Př. : Najděte nejkratší vlnovou délku v Paschenově sérii (m = 3, n = ).

Kvantování energie a fotoelektrický jev • Planck (1900): energie může být vyměňována pouze po určitých nespojitých násobcích (energie je kvantována). Fotony mají energii kde h (Planckova konstanta) = 6. 63 x 10 34 J. s • Vyšší frekvence tedy znamená vyšší energii fotonu (u vlnové délky jde o nepřímou úměru) • Př. : Vypočtěte energii fotonu s vlnovou délkou 700 nm. • Fotoelektrický jev: E = h h 0 kde 0 = mezní frekvence • Einstein (1905): energie emitovaného elektronu je přímo úměrná energii dopadajícího fotonu, pro emisi musí být překročena mezní hodnota frekvence (ta závisí na konkrétní látce) • Celková energie proudu emitovaných fotonů o stejné frekvenci je tedy: kde n = 1, 2, . . .

Bohrův model (vodíkového) atomu • Bohr (1913) vycházel z Planckovy představy a postuloval, že elektrony se mohou pohybovat pouze po určitých kruhových drahách (orbity, orbitaly) kolem atomového jádra a při tomto pohybu nemění svoji energii. Energii mohou přijímat nebo uvolňovat pouze při přechodu mezi dvěma orbitaly – jejich energie je kvantována. • Předpoklady vedly k následujícím závěrům: – Poloměr orbitalu: rn = n 2 r 1. – Energie orbitalu: En = E 1/n 2 = 21. 93 x 10 19 J/n 2 kde E 1 = energie nejstabilnějšího vodíkového orbitalu, E 1<E 2<E 3. – Nejstabilnější stav E 1, r 1 = základní stav. – Vyšší energetické stavy = excitované stavy. • Při přechodu elektronu mezi energetickými hladinami je emitován nebo absorbován foton, jehož energie odpovídá rozdílu energií příslušných dvou hladin.

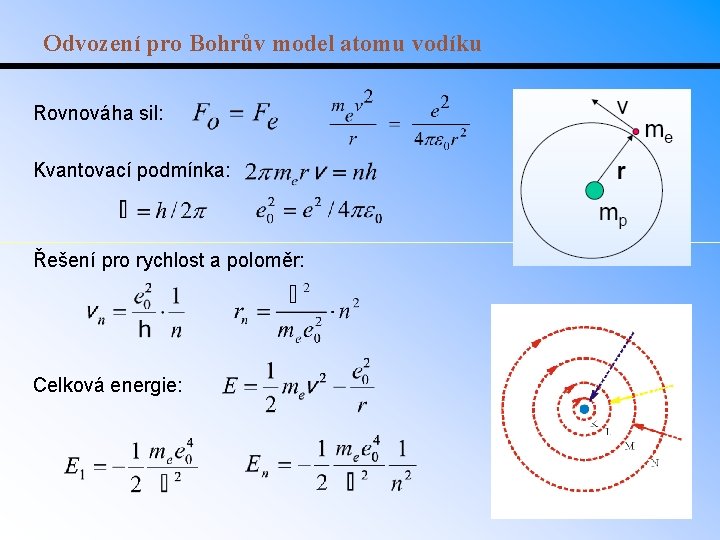
Odvození pro Bohrův model atomu vodíku Rovnováha sil: Kvantovací podmínka: Řešení pro rychlost a poloměr: Celková energie:

Emisní čáry v Bohrově modelu vodíkového atomu • Je-li Ei = výchozí energetický stav a Ef = konečný energetický stav, energie přechodu je: E = Ei Ef • Teorie a experiment souhlasí v případě spekter vodíku, ale ne u víceelektronových prvků • Hlavní potíž Bohrova modelu spočívá v tom, že kombinuje kvantové představy s klasickou mechanikou pohybu elektronu

Vlnově-korpuskulární povaha světla a hmoty • Světlo se chová analogicky jako hmota, protože může nabývat pouze jistých energií • Světlo tedy vykazuje vlastnosti vlnění i hmoty totéž platí i pro hmotu • Einsteinova rovnice zachycuje dualitu světla: • E = mc 2 chování jako částice • E = h chování jako vlnění • duální chování jako částice a vlna zároveň • Dualita hmoty je patrná po záměně rychlosti světla (c) rychlostí částice (v): kde se nazývá de Broglieho vlnová délka pohybující se částice • Př. : Určete de Broglieho vlnovou délku člověka o hmotnosti 90 kg, který se pohybuje rychlostí 10 m/s.

Kvantová mechanika • Kvantová mechanika poskytuje univerzální popis elektronové distribuce v atomech • Heisenbergův princip neurčitosti (1925) postuluje nemožnost stanovit zároveň s absolutní přesností polohu a hybnost: • Schroedinger (1926) použil tento koncept k odvození rovnice, která popisuje částice vlnovou funkcí. Elektronům je dovoleno se pohybovat kdekoliv • Řešením Schroedingerovy rovnice je vlnová funkce , fyzikální význam má její druhá mocnina (hustota pravděpodobnosti) • Pro vodíkový elektron je nejvýhodnější energetický stav sféricky symetrický

Schroedingerova rovnice

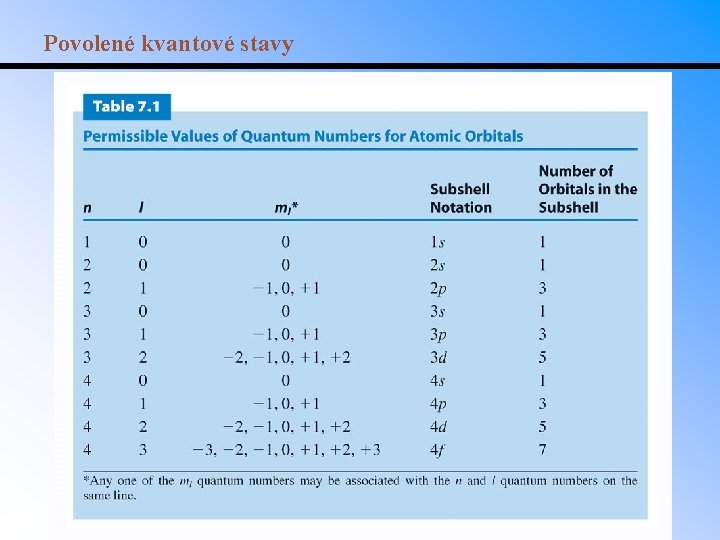
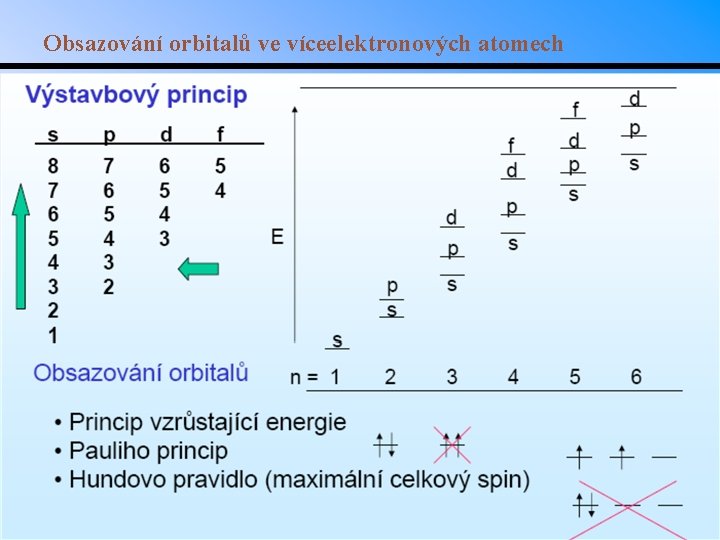
Kvantová mechanika a atomové orbitaly • Orbitaly mají charakteristický tvar a pozici, popsané 4 kvantovými čísly: n, l, ms. Všechna kromě ms jsou celá čísla. • Hlavní kvantové číslo (n): hodnoty 1. . . Udává energii orbitalu (energetické slupky). • Vedlejší kvantové číslo (l): hodnoty l = 0 do n 1. Udává tvar podslupky. – l = 0, 1, 2, 3, 4, … se běžně nahrazují symboly s, p, d, f, g, . . . – Podslupky se tedy zapisují 1 s, 2 p, atd. • Magnetické kvantové číslo (ml): hodnoty od l do +l. Udává prostorovou orientaci podslupky. – Celkový možný počet orbitalů je tedy 2 l+1. – Např. podslupka s má 1 orbital, podslupka p 3 orbitaly. • Spinové kvantové číslo (ms): hodnoty 1/2. Je důsledkem magnetického pole indukovaného rotujícími elektrony. • Pauliho vylučovací princip: žádné dva elektrony v atomu nemohou mít stejná všechna kvantová čísla.

Povolené kvantové stavy

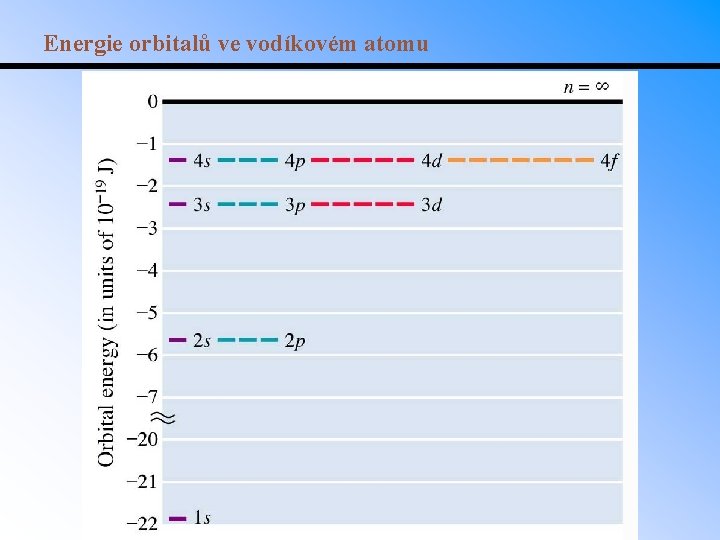
Energie orbitalů ve vodíkovém atomu

Energie orbitalů ve víceelektronových atomech • U vodíkového atomu mají orbitaly se stejným hlavním kvantovým číslem stejnou energii • V jiných prvcích se energie orbitalů se stejným hlavním kvantovým číslem mírně liší v důsledku vzájemných interakcí elektronů • Tyto odlišnosti postihuje výstavbový princip

Obsazování orbitalů ve víceelektronových atomech

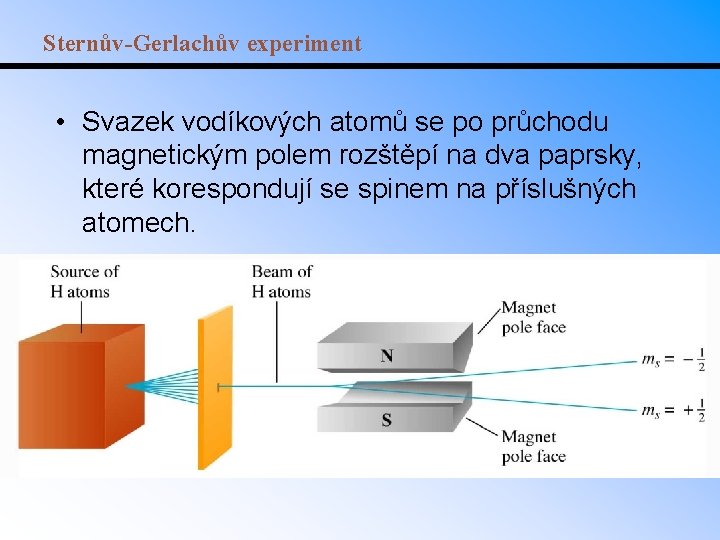
Sternův-Gerlachův experiment • Svazek vodíkových atomů se po průchodu magnetickým polem rozštěpí na dva paprsky, které korespondují se spinem na příslušných atomech.

Magnetické vlastnosti atomů • Ačkoli pohybující se elektron indukuje magnetické pole, dva elektrony s opačným spinem se v magnetickém účinku ruší. Kladnou magnetickou susceptibilitu tedy vykazují pouze atomy s nespárovanými elektrony. – Paramagnetická látka je slabě přitahována magnetickým polem, obvykle v důsledku nepárových elektronů. – Diamagnetická látka není přitahována magnetickým polem.

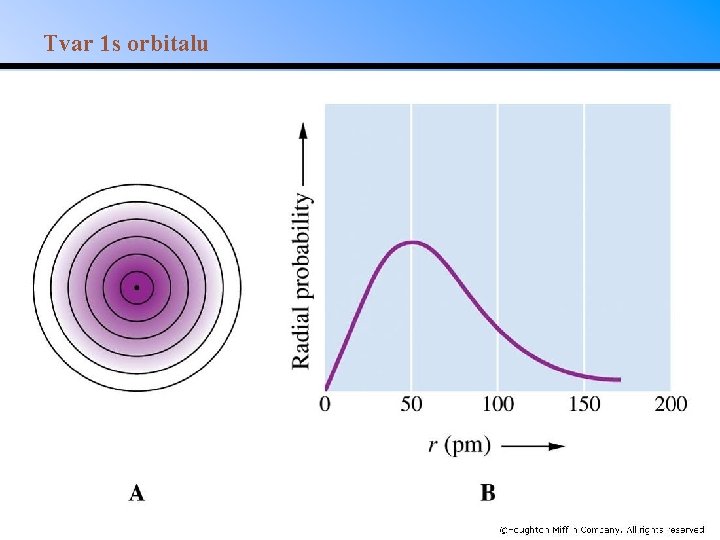
Tvar 1 s orbitalu

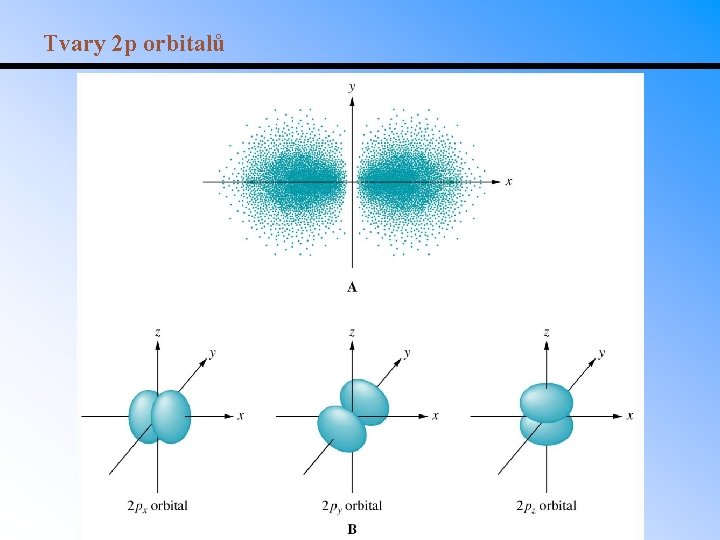
Tvary 2 p orbitalů

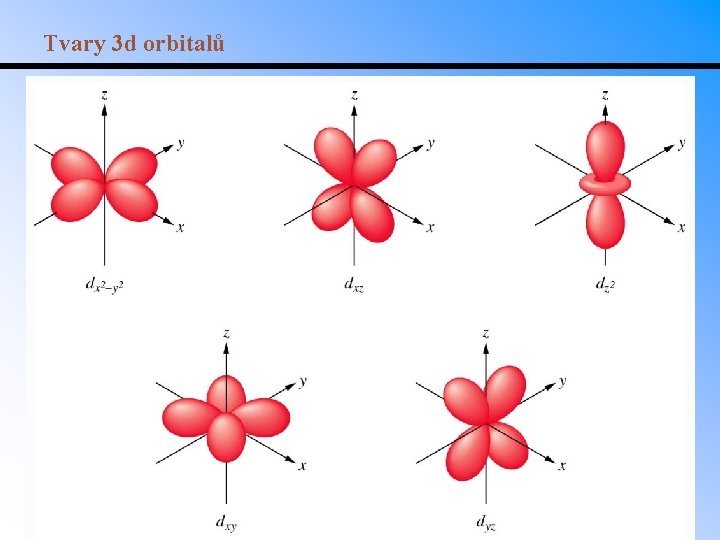
Tvary 3 d orbitalů

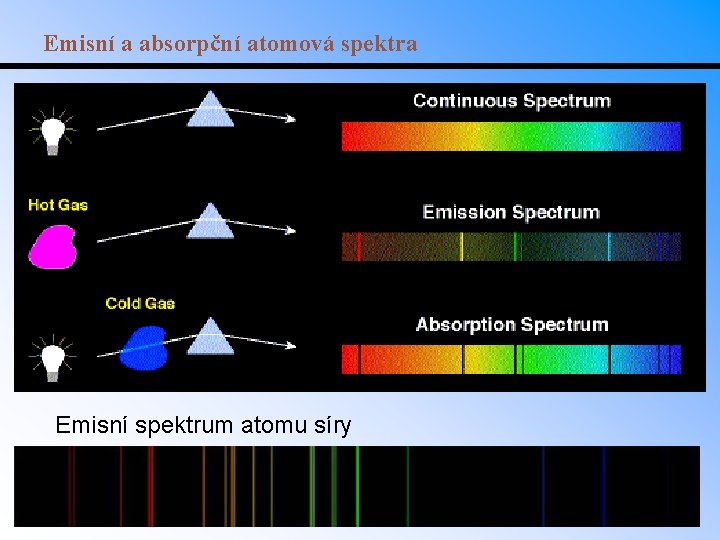
Emisní a absorpční atomová spektra Emisní spektrum atomu síry

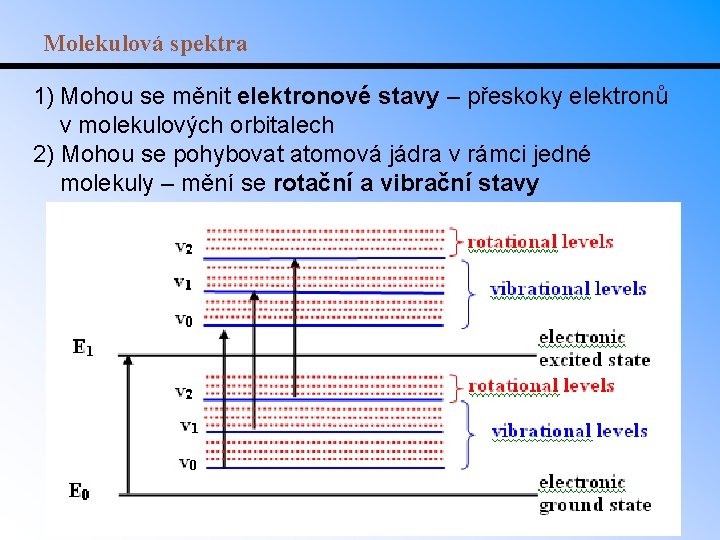
Molekulová spektra 1) Mohou se měnit elektronové stavy – přeskoky elektronů v molekulových orbitalech 2) Mohou se pohybovat atomová jádra v rámci jedné molekuly – mění se rotační a vibrační stavy

Příklady vibračních stupňů volnosti

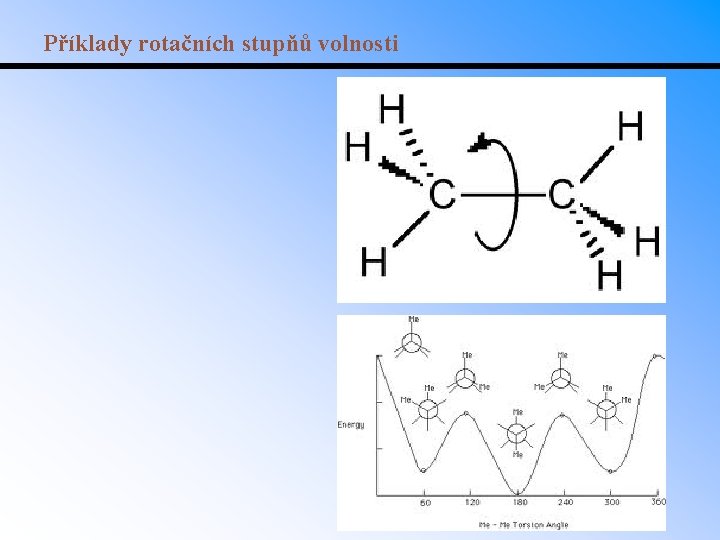
Příklady rotačních stupňů volnosti
 Dlka
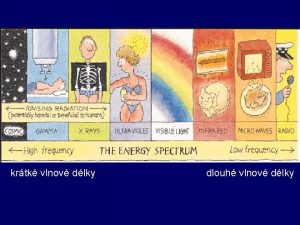
Dlka Dlka
Dlka Svtla
Svtla Svtla
Svtla Rozklad světla hranolem
Rozklad světla hranolem Nyquistova frekvence
Nyquistova frekvence Frekvence střídavého proudu výpočet
Frekvence střídavého proudu výpočet Oddajnik plešivec
Oddajnik plešivec Frekvence tónů hz
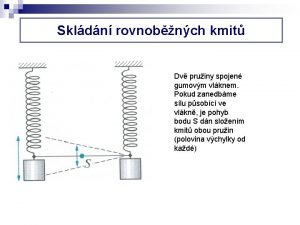
Frekvence tónů hz Pruiny
Pruiny Frekvence tónů hz
Frekvence tónů hz Larmorova frekvence
Larmorova frekvence Vplyv teploty na rýchlosť chemickej reakcie
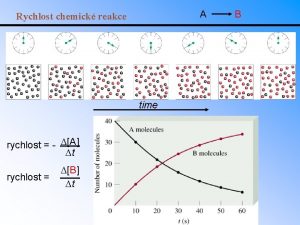
Vplyv teploty na rýchlosť chemickej reakcie Akcelerace vzorec
Akcelerace vzorec Vzorec pro rychlost
Vzorec pro rychlost Rychlost země
Rychlost země Fyzikální veličina udávající rychlost konání práce
Fyzikální veličina udávající rychlost konání práce 1. kozmická rýchlosť
1. kozmická rýchlosť úhlová rychlost
úhlová rychlost Zavd
Zavd Rychlost zvuku
Rychlost zvuku Priemerna rychlost vypocet
Priemerna rychlost vypocet Vzorec pro rychlost
Vzorec pro rychlost Pri vare sa kvapalina vyparuje
Pri vare sa kvapalina vyparuje Rychlost zvuku ve vzduchu
Rychlost zvuku ve vzduchu Průměrná rychlost
Průměrná rychlost Tretia kozmická rýchlosť
Tretia kozmická rýchlosť