A Rychlost chemick reakce time rychlost DA Dt
![A Rychlost chemické reakce time rychlost = - D[A] Dt rychlost = D[B] Dt A Rychlost chemické reakce time rychlost = - D[A] Dt rychlost = D[B] Dt](https://slidetodoc.com/presentation_image_h/8e1324876401fffc3df3a84b2ed2c31a/image-1.jpg)




![Reakce 1. řádu • Kinetická rovnice pro reakci 1. řádu: rychlost = [A]/ t Reakce 1. řádu • Kinetická rovnice pro reakci 1. řádu: rychlost = [A]/ t](https://slidetodoc.com/presentation_image_h/8e1324876401fffc3df3a84b2ed2c31a/image-6.jpg)





- Slides: 21
![A Rychlost chemické reakce time rychlost DA Dt rychlost DB Dt A Rychlost chemické reakce time rychlost = - D[A] Dt rychlost = D[B] Dt](https://slidetodoc.com/presentation_image_h/8e1324876401fffc3df3a84b2ed2c31a/image-1.jpg)
A Rychlost chemické reakce time rychlost = - D[A] Dt rychlost = D[B] Dt B

Reakční rychlost a stechiometrie • A + B C; RC = RA = RB • A + 2 B 3 C; Př. : Určete rychlost rozkladu HI v následující reakci, pokud se koncentrace HI za 1000 s od začátku reakce snížila o 0. 5 M: 2 HI(g) H 2(g) + I 2(g). • Pro obecnou reakci a. A + b. B c. C + d. D platí: Př. : Pro reakci 2 A + 3 B 4 C + 2 D vyjádřete rychlosti vůči složkám B, C a D pokud A ubývá rychlostí 0. 100 M/s.

Závislost reakční rychlosti na vnějších podmínkách • Rychlost chemické reakce závisí na těchto parametrech: – Koncentrace reaktantů. – Koncentrace katalyzátoru (katalyzátor je látka která mění rychlost reakce ale nespotřebovává se v jejím průběhu). – Plocha katalyzátoru, pokud je v pevné fázi (množství aktivních skupin které jsou k dispozici pro katalýzu, má stejný význam jako koncentrace u katalyzátoru v tekuté fázi). – Teplota.

Kinetická rovnice a řád reakce • Kinetická rovnice – zachycuje závislost reakční rychlosti na koncentraci reaktantů. • Řád reakce – součet exponentů u koncentrací v kinetické rovnici. • Pro obecnou reakci: a. A + b. B c. C + d. D je reakční rychlost úměrná koncentraci reaktantů. • Vztah který popisuje tuto závislost je: R = k[A]m[B]n kde k = rychlostní konstanta a m, n jsou dílčí řády reakce vzhledem k A a B. Celkový řád reakce = m + n. • Př. : Určete řád reakce vůči jednotlivým reaktantům v reakcích, které se řídí uvedenými kinetickými rovnicemi: HCOOH(aq) + Br 2(aq) 2 H+(aq) + 2 Br (aq) + CO 2(g) Kinetická rovnice pro vznik plynného HI je R = k[H 2][I 2] R = k[Br 2]

Experimentální určení dílčích reakčních řádů • Obvykle ze sady experimentů při kterých se mění počáteční koncentrace pouze jednoho z reaktantů. Př. : Určete dílčí reakční řády jednotlivých reaktantů z dat v tabulce: (aq)+5 Br (aq)+6 H+(aq) 3 Br 2(aq)+3 H 2 O(l)
![Reakce 1 řádu Kinetická rovnice pro reakci 1 řádu rychlost A t Reakce 1. řádu • Kinetická rovnice pro reakci 1. řádu: rychlost = [A]/ t](https://slidetodoc.com/presentation_image_h/8e1324876401fffc3df3a84b2ed2c31a/image-6.jpg)
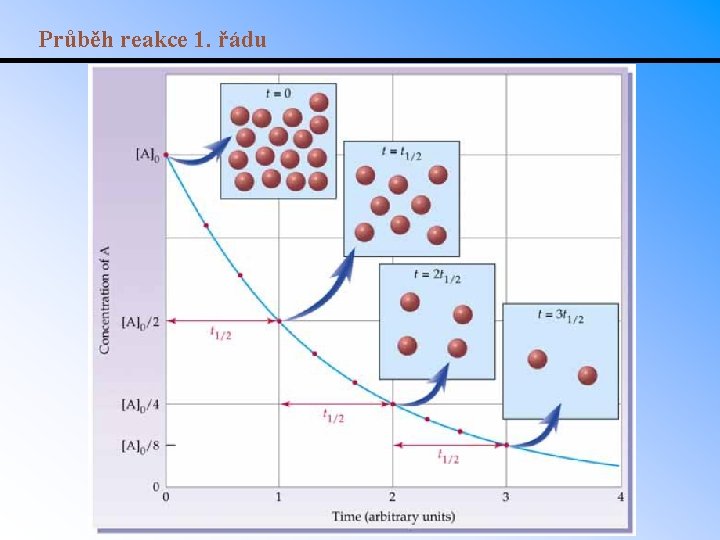
Reakce 1. řádu • Kinetická rovnice pro reakci 1. řádu: rychlost = [A]/ t = k[A] resp. = d[A]/dt = k[A]. • Po integraci: • Integrovaný tvar kinetické rovnice umožňuje vypočítat koncentraci [A] v libovolném čase od začátku reakce. Př. : Vypočítejte zbytkovou koncentraci N 2 O který se rozkládá reakcí 2 N 2 O(g) 1 2 N 2(g) + O 2(g) je-li tato reakce 1. řádu, [N 2 O]o = 0. 20 M, k = 3. 4 s a T = 780°C. Koncentraci určete po 100 ms od zahájení reakce. Linearizovaná forma: • • RA V grafu ln[A] vs t směrnice odpovídá rychlostní konstantě k. Př. : Je-li cyklohexan (C) zahřát na 500 o. C, rozkládá se na propen. S pomocí dat v tabulce určete rychlostní konstantu reakce za předpokladu že je 1. řádu:

Poločas reakce 1. řádu • Poločas reakce je doba potřebná ke změně koncentrace výchozí látky na polovinu (při t 1/2 tedy platí [A] = ½ [A]o). • Pro reakci 1. řádu je dán vztahem t 1/2 = 0. 693/k. • Př. : Poločas rozkladu N 2 O 5 při 65 °C je 130 s. Určete pro tuto reakci rychlostní konstantu.

Průběh reakce 1. řádu

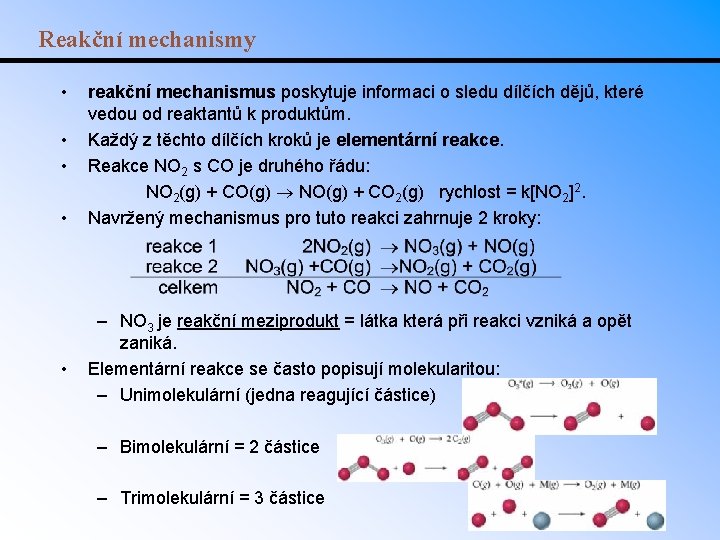
Reakční mechanismy • • • reakční mechanismus poskytuje informaci o sledu dílčích dějů, které vedou od reaktantů k produktům. Každý z těchto dílčích kroků je elementární reakce. Reakce NO 2 s CO je druhého řádu: NO 2(g) + CO(g) NO(g) + CO 2(g) rychlost = k[NO 2]2. Navržený mechanismus pro tuto reakci zahrnuje 2 kroky: – NO 3 je reakční meziprodukt = látka která při reakci vzniká a opět zaniká. Elementární reakce se často popisují molekularitou: – Unimolekulární (jedna reagující částice) – Bimolekulární = 2 částice – Trimolekulární = 3 částice

Řídící děj • Celkový řád reakce (kinetická rovnice) často vychází z aproximace řídícího děje (obvykle výrazně nejpomalejší elementární reakce v reakčním mechanismu): 2 NO 2(g) NO 3(g) + NO(g), NO 3(g) +CO(g) NO 2(g) + CO 2(g) NO 2 + CO NO + CO 2 R 1 = k 1[NO 2]2 pomalý R 2 = k 2[NO 3][CO] rychlý Robs = k[NO 2]2 Př. : Najděte kinetickou rovnici pro následující reakční mechanismus:

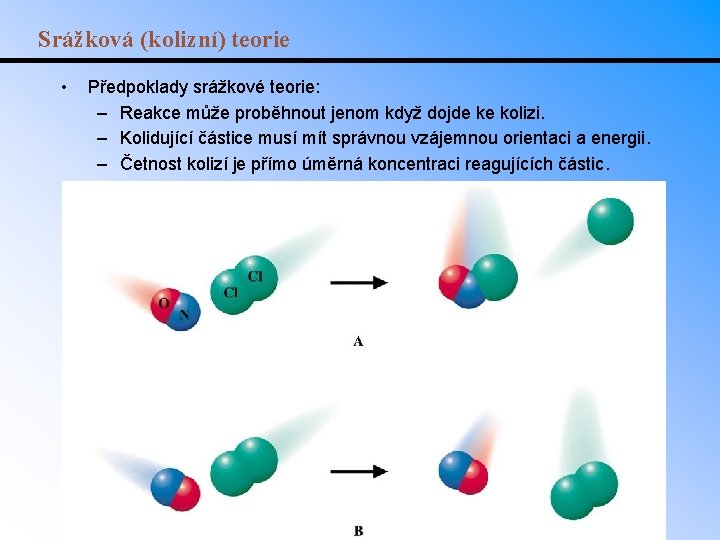
Srážková (kolizní) teorie • Předpoklady srážkové teorie: – Reakce může proběhnout jenom když dojde ke kolizi. – Kolidující částice musí mít správnou vzájemnou orientaci a energii. – Četnost kolizí je přímo úměrná koncentraci reagujících částic.

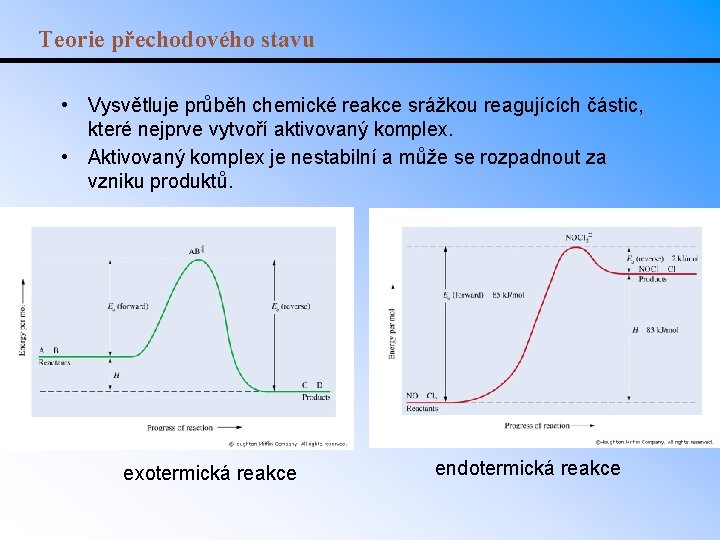
Teorie přechodového stavu • Vysvětluje průběh chemické reakce srážkou reagujících částic, které nejprve vytvoří aktivovaný komplex. • Aktivovaný komplex je nestabilní a může se rozpadnout za vzniku produktů. exotermická reakce endotermická reakce

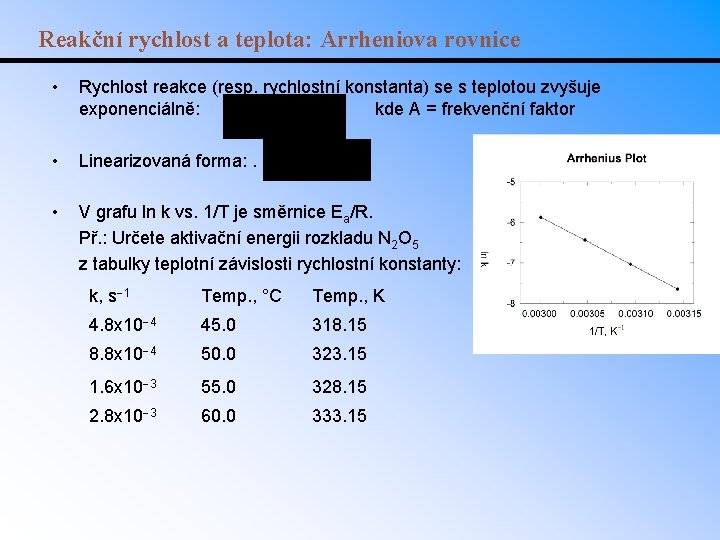
Reakční rychlost a teplota: Arrheniova rovnice • Rychlost reakce (resp. rychlostní konstanta) se s teplotou zvyšuje exponenciálně: kde A = frekvenční faktor • Linearizovaná forma: . • V grafu ln k vs. 1/T je směrnice Ea/R. Př. : Určete aktivační energii rozkladu N 2 O 5 z tabulky teplotní závislosti rychlostní konstanty: k, s 1 Temp. , °C Temp. , K 4. 8 x 10 4 45. 0 318. 15 8. 8 x 10 4 50. 0 323. 15 1. 6 x 10 3 55. 0 328. 15 2. 8 x 10 3 60. 0 333. 15

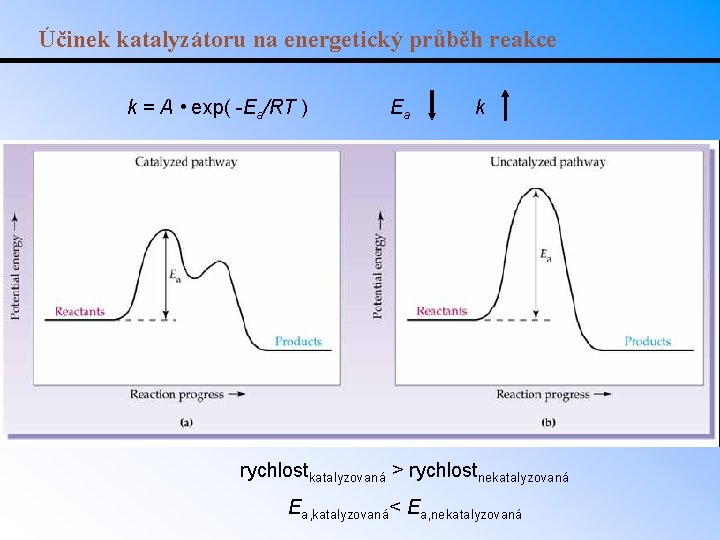
Katalýza • Katalyzátory mění reakční cestu (reakční mechanismus) vedoucí od reaktantů k produktům. • Změnou mechanismu se změní i aktivační energie řídícího děje. • Př. : rozklad peroxidu vodíku katalyzovaný brómem: 2 H 2 O 2(aq) 2 H 2 O(l)+ O 2(g). • Pravděpodobný mechanismus: 1. Br 2 red 2. Br ox celkem Br 2(aq) + H 2 O 2(aq) 2 Br (aq) +2 H+(aq)+O 2(g) 2 H+(aq)+2 Br (aq)+H 2 O 2(aq) Br 2(aq) + 2 H 2 O(l) 2 H 2 O 2(aq) 2 H 2 O(l)+O 2(g) • Bróm se při reakci nespotřebuje, ačkoli se jí účastní.

Účinek katalyzátoru na energetický průběh reakce k = A • exp( -Ea/RT ) Ea k rychlostkatalyzovaná > rychlostnekatalyzovaná Ea, katalyzovaná< Ea, nekatalyzovaná

Příklad katalyzované reakce – rozklad ozónu

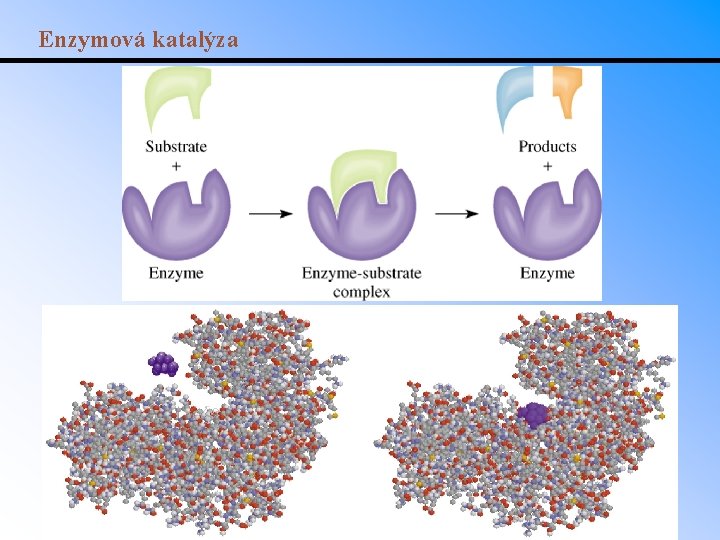
Homogenní a heterogenní katalýza • Homogenní katalýza: katalyzátor ve stejné fázi jako reaktanty. • Heterogenní katalýza: katalyzátor v jiné fázi než reaktanty (obvykle tuhý katalyzátor a tekuté reaktanty). – Rozklad peroxidu vodíku katalyzovaný Br 2 je příkladem homogenní katalýzy, protože všechny složky jsou ve vodném roztoku. • Katalytická hydrogenace etylenu je příkladem heterogenní katalýzy: • Enzymy (biologické katalyzátory) – Chemicky se jedná o proteiny. – Reakční (aktivní) místa na jejich povrchu mají specifickou geometrii. Pouze molekula která „zapadne“ do aktivního místa může reagovat. Toxiny mohou aktivní místa blokovat nebo omezit jejich účinek.

Enzymová katalýza

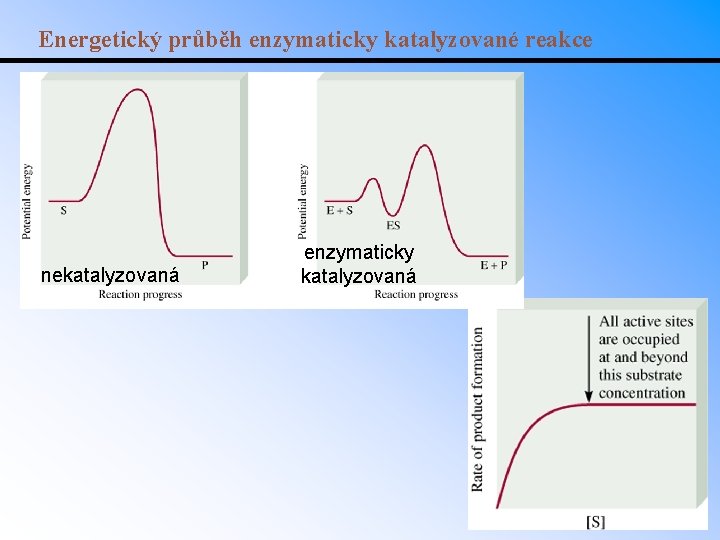
Energetický průběh enzymaticky katalyzované reakce nekatalyzovaná enzymaticky katalyzovaná

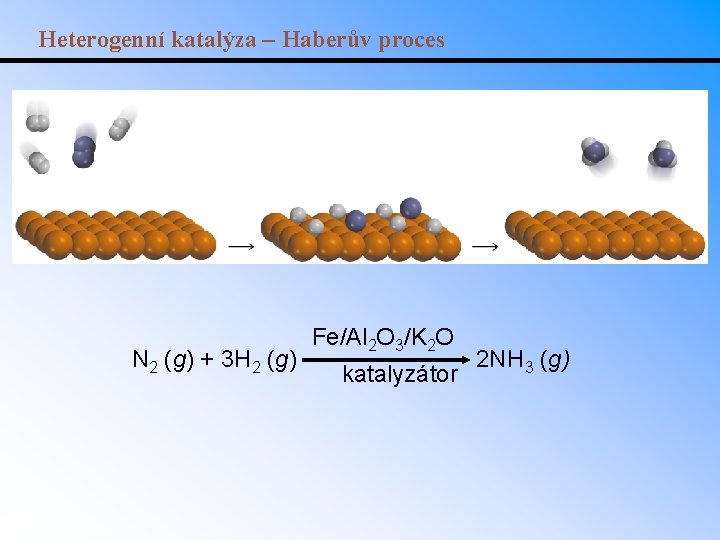
Heterogenní katalýza – Haberův proces N 2 (g) + 3 H 2 (g) Fe/Al 2 O 3/K 2 O katalyzátor 2 NH 3 (g)

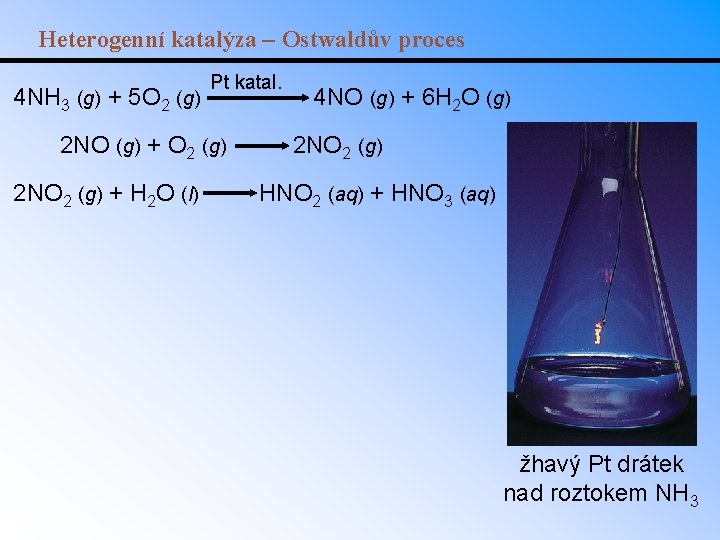
Heterogenní katalýza – Ostwaldův proces 4 NH 3 (g) + 5 O 2 (g) Pt katal. 2 NO (g) + O 2 (g) 2 NO 2 (g) + H 2 O (l) 4 NO (g) + 6 H 2 O (g) 2 NO 2 (g) HNO 2 (aq) + HNO 3 (aq) žhavý Pt drátek nad roztokem NH 3