ELEKTRICK PROUD V KAPALINCH Mgr Kamil Kuera Gymnzium












- Slides: 14

ELEKTRICKÝ PROUD V KAPALINÁCH Mgr. Kamil Kučera

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy ANOTACE 1. Kód EVM: 2. Číslo projektu: CZ. 1. 07/1. 1. 28/01. 0050 3. Vytvořeno: listopad 2014 4. Ročník: 3. ročník – čtyřleté gymnázium, 7. ročník – osmileté gymnázium (RVP-G), 5. K_INOVACE_1. FY. 44 Vzdělávací oblast Člověk a příroda Vzdělávací obor Fyzika Tematický okruh Elektrický proud v kapalinách Anotace: Materiál slouží k zopakování vedení elektrického proudu v kapalinách. Materiál popisuje elektrolyt, elektrolýzu s jejím využitím v praxi, připomíná Faradayovy zákony pro elektrolýzu a voltampérovou charakteristiku elektrolytického vodiče. Učivo je ověřeno závěrečným testem. Materiál se využije v průběhu hodiny. Pomůcky: interaktivní tabule. Materiál je určen pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízeních. Jakékoliv další využití podléhá autorskému zákonu.

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Elektrická vodivost elektrický proud - uspořádaný pohyb volných částic s nábojem elektrický vodič - látka, která vede elektrický proud elektrický izolant - látka, která nevede elektrický proud [1] v kapalinách jsou volnými částicemi s nábojem ionty iont - částice s nábojem, která vzniká z atomu nebo z molekuly tím, že získá (ztratí) jeden nebo více elektronů kationt - iont s kladným nábojem (při elektrolýze se pohybuje ke katodě) aniont - iont s záporným nábojem (při elektrolýze se pohybuje k anodě) [2]

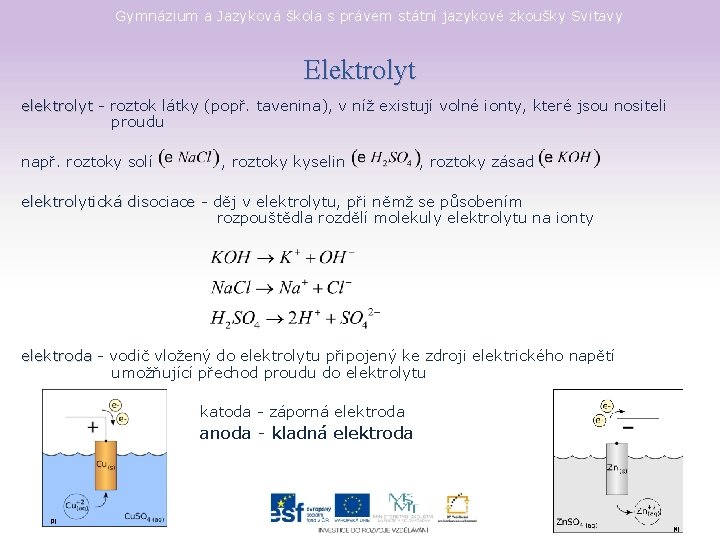
Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Elektrolyt elektrolyt - roztok látky (popř. tavenina), v níž existují volné ionty, které jsou nositeli proudu např. roztoky solí , roztoky kyselin , roztoky zásad elektrolytická disociace - děj v elektrolytu, při němž se působením rozpouštědla rozdělí molekuly elektrolytu na ionty elektroda - vodič vložený do elektrolytu připojený ke zdroji elektrického napětí umožňující přechod proudu do elektrolytu katoda - záporná elektroda anoda - kladná elektroda [3] [4]

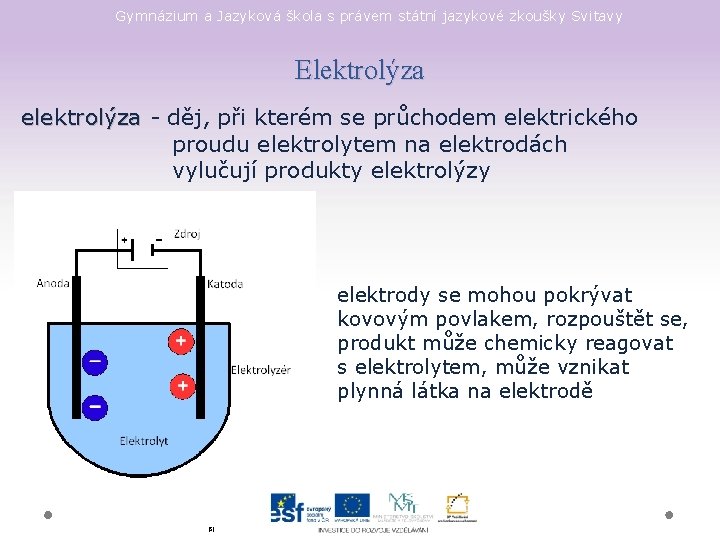
Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Elektrolýza elektrolýza - děj, při kterém se průchodem elektrického proudu elektrolytem na elektrodách vylučují produkty elektrolýzy elektrody se mohou pokrývat kovovým povlakem, rozpouštět se, produkt může chemicky reagovat s elektrolytem, může vznikat plynná látka na elektrodě [5]

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Využití elektrolýzy • Galvanické pokovování - pokrývání předmětů vrstvou kovu (chromování, niklování, zlacení) • Galvanoplastika - kovové obtisky předmětů, např. pro výrobu odlévacích forem • Galvanické leptání - kovová elektroda se v některých místech pokryje nevodivou vrstvou, nepokrytá část se průchodem proudu elektrolytem vyleptá • Elektrometalurgie - výroba čistých kovů (např. hliník) • Elektrolytické čištění kovů - rafinace (měď, zinek, nikl) • Rozklad různých chemických látek (elektrolýza vody) • Výroba chlóru [6] • Akumulátory - nabíjení chemického zdroje elektrického napětí průchodem elektrického proudu • Polarografie - určování chemického složení látky pomocí změn elektrického proudu procházejícího roztokem zkoumané látky

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Polarografie • elektrochemické analytická metoda • slouží k určování přítomnosti a koncentrace redukovatelných nebo oxidovatelných neznámých látek v roztoku [7] • princip spočívá ve vyhodnocování závislosti elektrického proudu na napětí na dvojici elektrod, které jsou ponořené do roztoku, v němž probíhá elektrolýza • závislosti mají tvar vln, jejichž poloha charakterizuje jednotlivé druhy látek • z velikosti nárůstu proudu lze určit koncentraci příslušné látky • za její objev dostal akademik Jaroslav Heyrovský roku 1959 Nobelovu cenu za chemii [8]

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy I. Faradayův zákon Elektrolýzu matematicky popsal anglický fyzik M. Faraday ve svých zákonech. I. Faradayův zákon: Hmotnost m látky vyloučené při elektrolýze je přímo úměrná náboji Q, který prošel elektrolytem. [7] [9] A - elektrochemický ekvivalent - vyjadřuje hmotnost látky vyloučené při elektrolýze určitého elektrolytu nábojem 1 C - nezávisí ne velikosti elektrod, ani na koncentraci a teplotě roztoku elektrolytu a ani z jakého roztoku elektrolytu se látka vyloučila

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy II. Faradayův zákon: Hmotnosti různých prvků vyloučených při elektrolýze týmž celkovým nábojem jsou chemicky ekvivalentní. výpočet elektrochemického ekvivalentu: z - počet elementárních nábojů, které nese daný iont (počet elektrických nábojů potřebných pro vyloučení jedné molekuly látky) - oxidační číslo

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Příklad na Faradayovy zákony Při elektrolýze dusičnanu stříbrného (Ag. NO 3) procházel roztokem po dobu 2 hodin stálý proud 1, 6 A. Určete hmotnost vyloučeného stříbra.

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Voltampérová charakteristika elektrolytického vodiče - závislost procházejícího proudu elektrolytem na napětí mezi elektrodami ponoříme-li kov do elektrolytu začne do něj uvolňovat nebo z něj přijímat ionty Þ v jeho okolí vznikne elektrická dvojvrstva s určitým elektromotorickým napětím u některých elektrod se napětí obou dvojvrstev navenek ruší, u jiných elektrod vzniknou dvě různé dvojvrstvy (jejich rozdíl se navenek projevuje jako rozkladné napětí Ur, elektrody se polarizují a na každe vznika tzv. polarizační napětí, které je opačně orientované než napětí zdroje) měděné elektrody, elektrolyt I uhlíkové elektrody, elektrolyt I U Ur U

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Galvanické články elektrochemický článek - zdroj elektrického napětí tvořený dvěma chemicky různými elektrodami vloženými do vhodného elektrolytu rozlišujeme: primární galvanický článek - elektrody z různých kovů, mezi kovovou elektrodou a elektrolytem vzniká rozdíl potenciálů, který je u různých kovů různý - proces přeměny energie je nevratný např. suchý článek (C+, Zn-, elektrolyt salmiak NH 4 Cl) alkalický článek (C+, Zn-, elektrolyt KOH) - delší životnost, více energie [10] sekundární galvanický článek (akumulátor) - článek, u něhož děj elektrolytické polarizace probíhá vratně, energie se dá obnovovat např. olověný akumulátor (Pb+, Pb-, elektrolyt H 2 SO 4) alkalický akumulátor (Mn. O 2 +C, Zn-, elektrolyt KOH) [11] kapacita akumulátoru - celkový náboj, který může akumulátor vydat při výbíjení - měříme v Ah

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Trocha opakování 1. Vysvětlete, co je to elektrolýza? 2. Co vyjadřuje elektrochemický ekvivalent? 3. Proč škodí lidskému organismu elektrický proud, který jím při úrazu prochází? 4. Co je to kapacita akumulátoru? 5. K čemu slouží polarografie? 6. Stav nabití plochých baterií je možno zkoušet jazykem. Vysvětlete. 7. Uveďte praktické využití elektrolýzy?

Gymnázium a Jazyková škola s právem státní jazykové zkoušky Svitavy Zdroje a použitá literatura [1] FIR 0002. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Power_pole. jpg [2] MATTERN, Roland. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Ionenverteilung_in. Loesung. svg? uselang=cs [3] JLEEDEV. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //cs. wikipedia. org/wiki/Katoda#mediaviewer/File: Copper_cathode. png [4] JLEEDEV. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Zinc_anode. png? uselang=cs [5] TOMAS 1889. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Elektrol%C 3%BDza. jpeg [6] HENNING, Torsten. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Copper_electroplating. svg [7] ARCHIV ÚFCH J. HEYROVSKÉHO AV ČR, V. V. I. . wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Heyrovsky_Jaroslav. jpg [8] FRÜH, Andel. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Polarography_workplace. jpg [9] JARO. P. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Michael_Faraday__Project_Gutenberg_e. Text_13103. jpg [10] BRIANIAC. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Batteries. jpg [11] FINKE, Marco. wikipedia. cz [online]. [cit. 20. 10. 2014]. Dostupný na WWW: http: //commons. wikimedia. org/wiki/File: Akku_AA_LR 6_Mignon. jpg SVOBODA, Emanuel a kol. Přehled středoškolské fyziky. Praha: SPN, 1990, ISBN 80 -04 -22435 -0 NAHODIL, Josef. Fyzika v běžném životě. Praha: Prometheus, s. r. o. , 1996, ISBN 80 -7196 -005 -5.