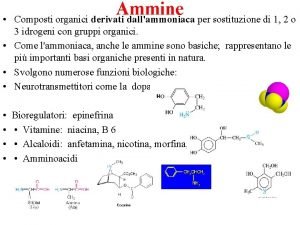
EFECTE ELECTRONICE IN MOLECULELE COMPUSILOR ORGANICI Legturile covalente




- Slides: 10

EFECTE ELECTRONICE IN MOLECULELE COMPUSILOR ORGANICI Legăturile covalente pot fi : - nepolare (omogene) - polare (eterogene) - apare un moment de dipol datorită diferenţei de electronegativitate a elementelor ce formează legătura. În moleculele compuşilor organici au loc deplasări şi delocalizări ale electronilor ce formează legătura. Interacţiile electronice între atomii moleculei apar sub forma a două efecte: inductiv şi electromer.

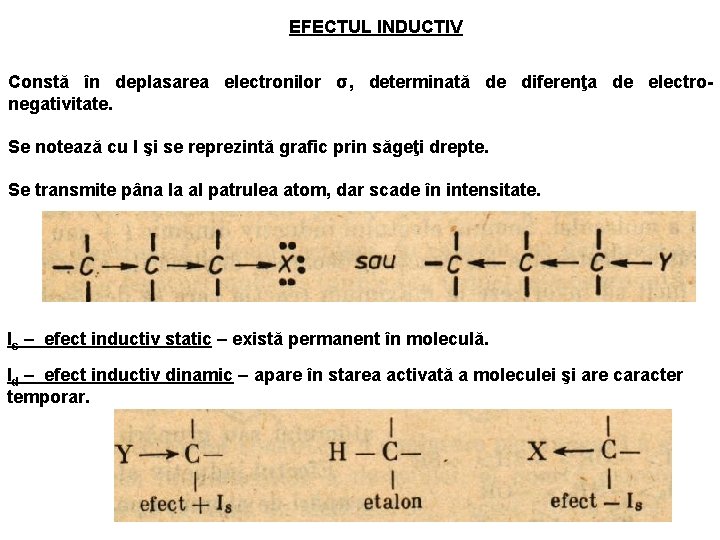
EFECTUL INDUCTIV Constă în deplasarea electronilor σ, determinată de diferenţa de electronegativitate. Se notează cu I şi se reprezintă grafic prin săgeţi drepte. Se transmite pâna la al patrulea atom, dar scade în intensitate. Is – efect inductiv static – există permanent în moleculă. Id – efect inductiv dinamic – apare în starea activată a moleculei şi are caracter temporar.

-Is – efect atrăgător de electroni, gruparea ce provoacă efectul este mai electronegativă, atrage electroni comuni şi devine parţial negativă +Is – efect respingător de electroni, gruparea ce provoacă efectul respinge electronii comuni şi devine parţial pozitivă. Atomi şi grupări cu efect inductiv static:

Is dinamic apare sub influenţa mediului de reacţie. H+ din mediul de reacţie se ataşează atomului de oxigen din gruparea OH, se formează un ion pozitiv care măreşte polaritatea legăturii C – O, ceea ce determină ca gruparea OH să se elimine sub formă de apa mult mai uşor. Is şi Id au rol în desfăşurarea reacţiilor chimice ale compuşilor organici, prefigurând modul în care se scindează legătura σ.

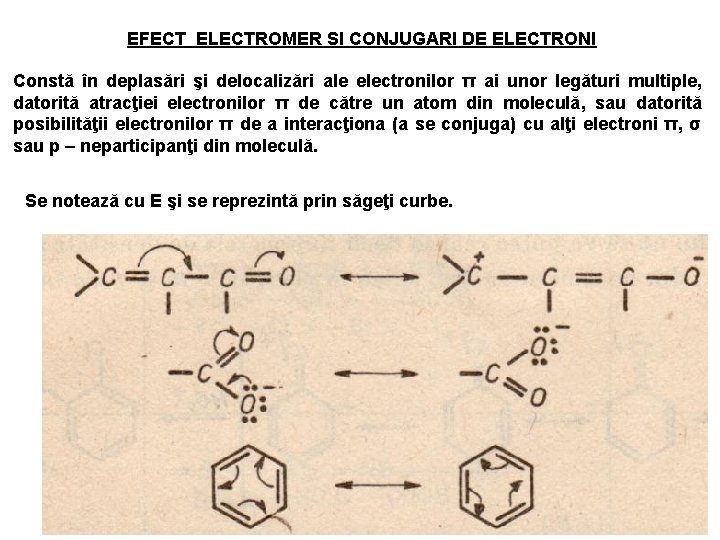
EFECT ELECTROMER SI CONJUGARI DE ELECTRONI Constă în deplasări şi delocalizări ale electronilor π ai unor legături multiple, datorită atracţiei electronilor π de către un atom din moleculă, sau datorită posibilităţii electronilor π de a interacţiona (a se conjuga) cu alţi electroni π, σ sau p – neparticipanţi din moleculă. Se notează cu E şi se reprezintă prin săgeţi curbe.

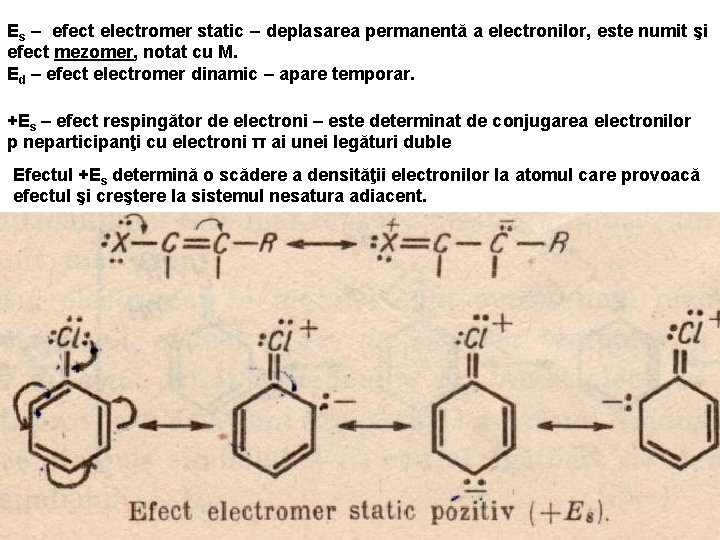
Es – efect electromer static – deplasarea permanentă a electronilor, este numit şi efect mezomer, notat cu M. Ed – efect electromer dinamic – apare temporar. +Es – efect respingător de electroni – este determinat de conjugarea electronilor p neparticipanţi cu electroni π ai unei legături duble Efectul +Es determină o scădere a densităţii electronilor la atomul care provoacă efectul şi creştere la sistemul nesatura adiacent.

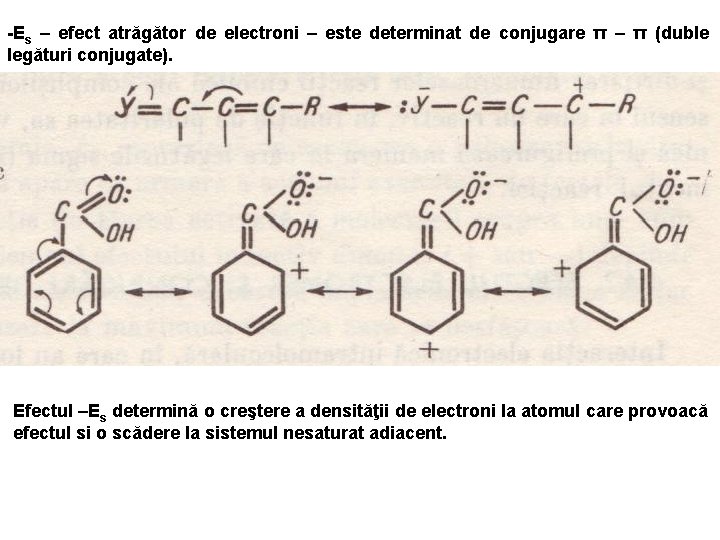
-Es – efect atrăgător de electroni – este determinat de conjugare π – π (duble legături conjugate). Efectul –Es determină o creştere a densităţii de electroni la atomul care provoacă efectul si o scădere la sistemul nesaturat adiacent.

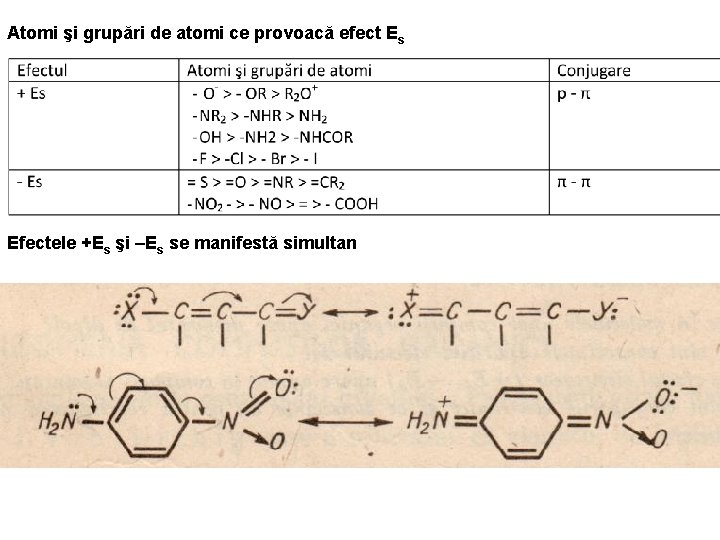
Atomi şi grupări de atomi ce provoacă efect Es Efectele +Es şi –Es se manifestă simultan

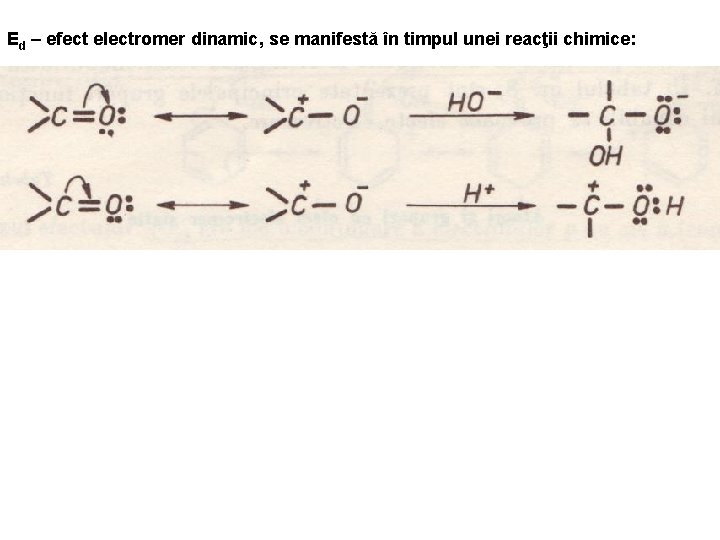
Ed – efect electromer dinamic, se manifestă în timpul unei reacţii chimice:

Efectul Is determinat de polaritatea moleculei se manifestă permanent în moleculele compuşilor organici, pe când efectul Es, determinat de conjugări p – π sau π – π, apare doar în moleculele ce conţin legături π conjugate cu alte legături π, sau cu electroni p neparticipanţi. Efectul Is insoţeşte întotdeauna efectul Es Dacă efectele acţionează în acelaşi sens măresc reactivitatea chimică, dacă acţionează în sens contrar atunci efectul Es este dominant.