Darwinian evolution of species Timescale hundreds of millions


































- Slides: 61

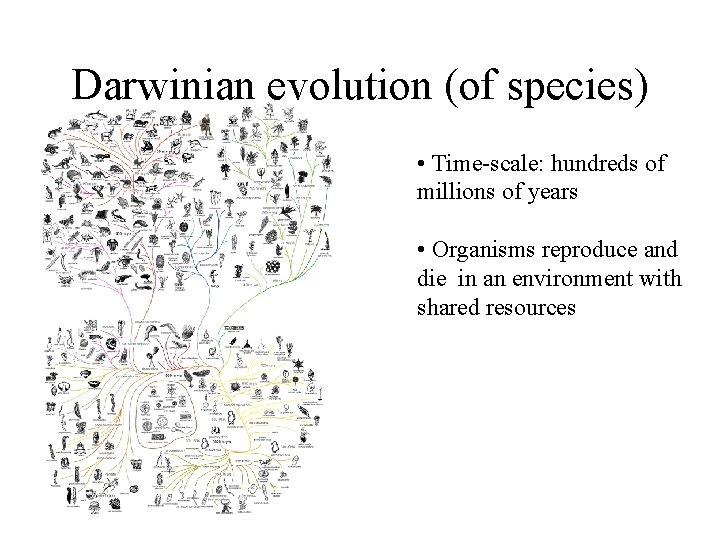
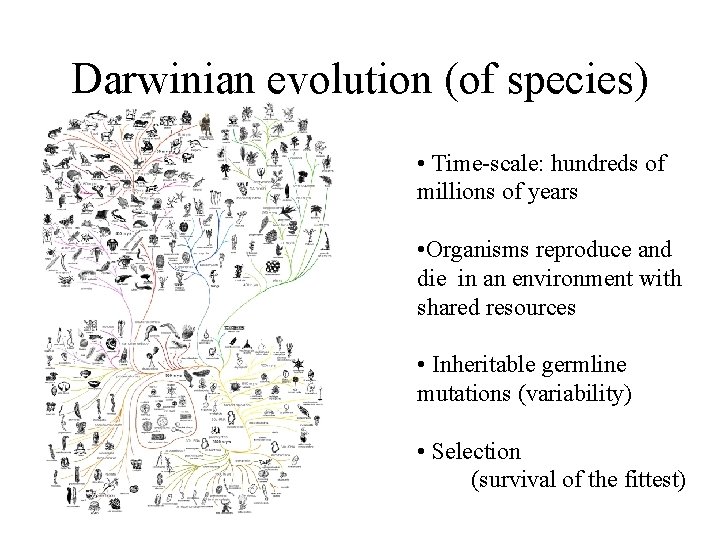
Darwinian evolution (of species) • Time-scale: hundreds of millions of years • Organisms reproduce and die in an environment with shared resources

Darwinian evolution (of species) • Time-scale: hundreds of millions of years • Organisms reproduce and die in an environment with shared resources • Inheritable germline mutations (variability) • Selection (survival of the fittest)

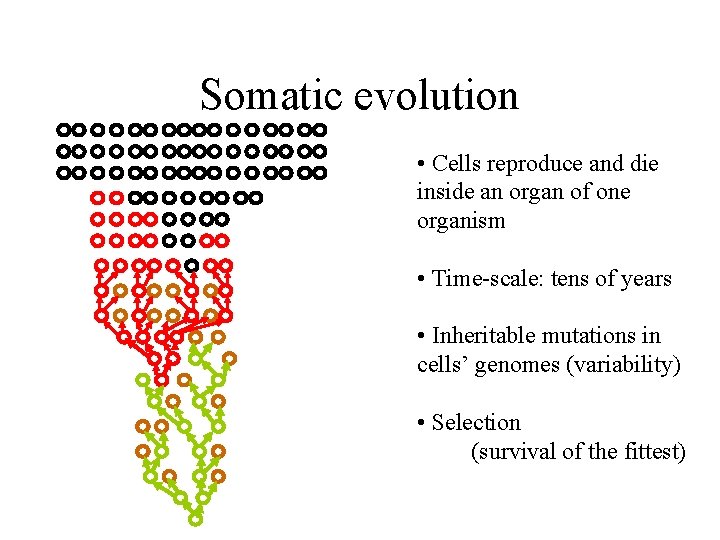
Somatic evolution • Cells reproduce and die inside an organ of one organism • Time-scale: tens of years

Somatic evolution • Cells reproduce and die inside an organ of one organism • Time-scale: tens of years • Inheritable mutations in cells’ genomes (variability) • Selection (survival of the fittest)

Cancer as somatic evolution • Cells in a multicellular organism have evolved to cooperate and perform their respective functions for the good of the whole organism

Cancer as somatic evolution • Cells in a multicellular organism have evolved to cooperate and perform their respective functions for the good of the whole organism • A mutant cell that “refuses” to co-operate may have a selective advantage

Cancer as somatic evolution • Cells in a multicellular organism have evolved to cooperate and perform their respective functions for the good of the whole organism • A mutant cell that “refuses” to co-operate may have a selective advantage • The offspring of such a cell may spread

Cancer as somatic evolution • Cells in a multicellular organism have evolved to cooperate and perform their respective functions for the good of the whole organism • A mutant cell that “refuses” to co-operate may have a selective advantage • The offspring of such a cell may spread • This is a beginning of cancer

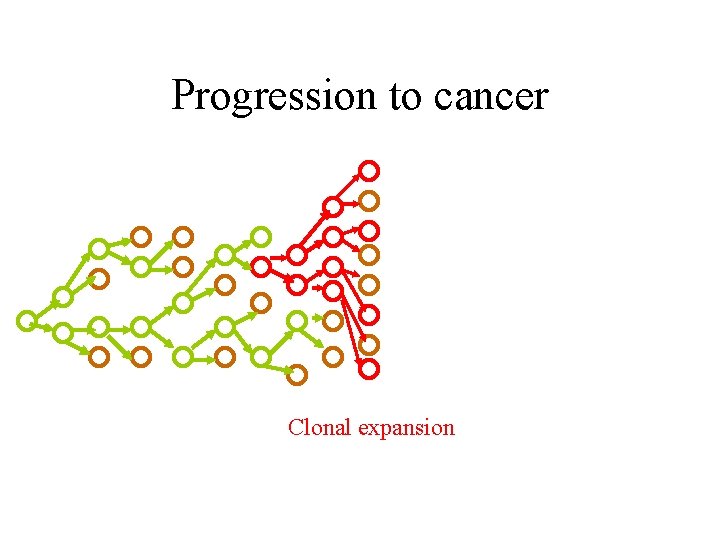
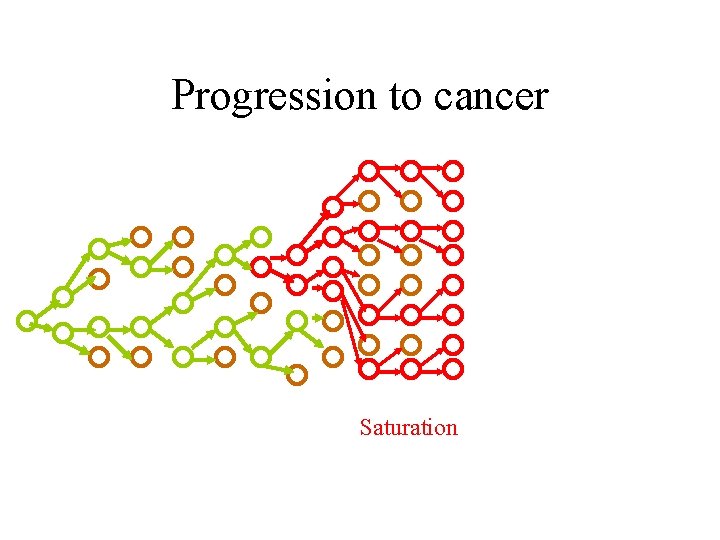
Progression to cancer

Progression to cancer Constant population

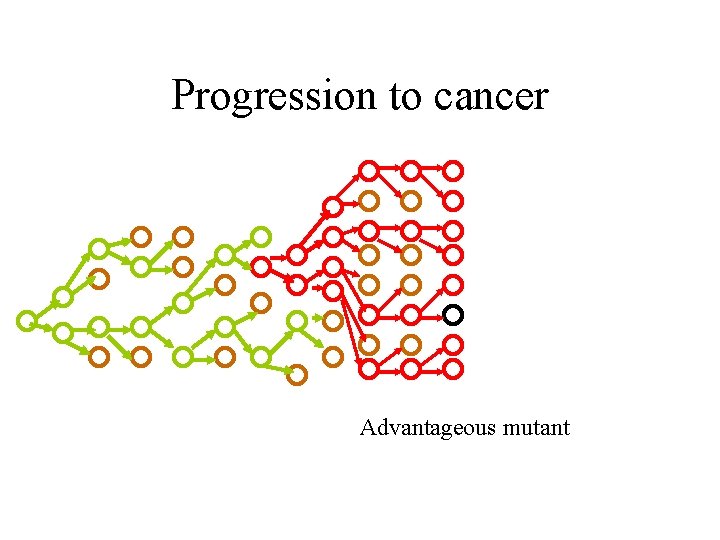
Progression to cancer Advantageous mutant

Progression to cancer Clonal expansion

Progression to cancer Saturation

Progression to cancer Advantageous mutant

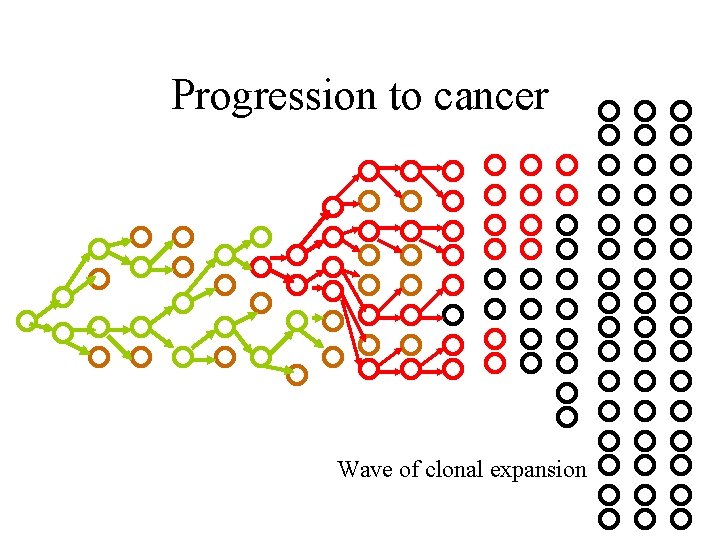
Progression to cancer Wave of clonal expansion

La progressione tumorale • Il tumore rappresenta un’entitá dinamica nelle sue stesse fondamenta genetiche • La semplice descrizione delle anomalie genetiche perció é insufficiente per farci capire come “funziona” • Occorre una visione “integrata” della storia naturale del tumore, nei vari stadi della sua progressione

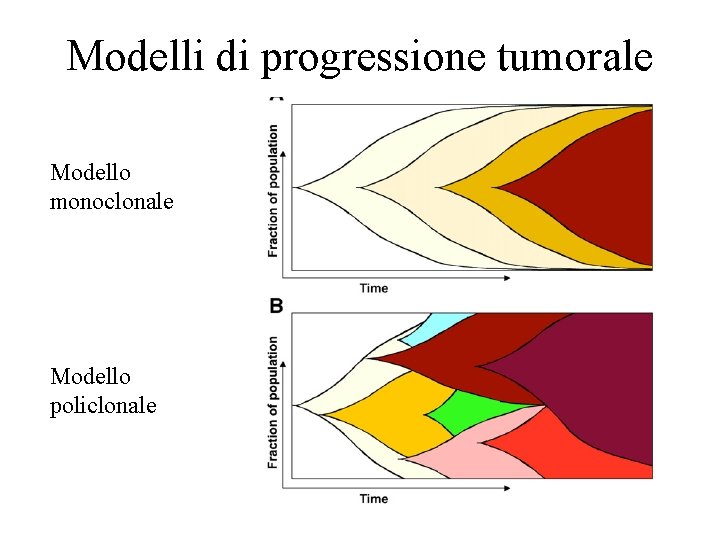
Teoria della selezione clonale • In base a questo modello, la tumorigenesi si puó considerare come l’espansione seriale di cloni successivi di cellule, caratterizzati dall’acquisizione di mutazioni che conferiscono un vantaggio selettivo di crescita nei confronti delle popolazioni cellulari circostanti • Le alterazioni sono prevalentemente genetiche, ma alterazioni “epigenetiche” e quindi stabilmente ereditabili di pattern di espressione genica sono anch’esse importanti

Progressione lineare o “caotica”? • Nella visione classica, mutazioni emergono che portano via all’emergenza di cloni con maggiore malignità • Nella visione che tiene conto di alcuni risultati più recenti, più cloni (derivati da unica cellula di origine del tumore, ma caratterizzati da eterogeneità genetica) possono coesistere contemporaneamente nella massa tumorale

Modelli di progressione tumorale Modello monoclonale Modello policlonale

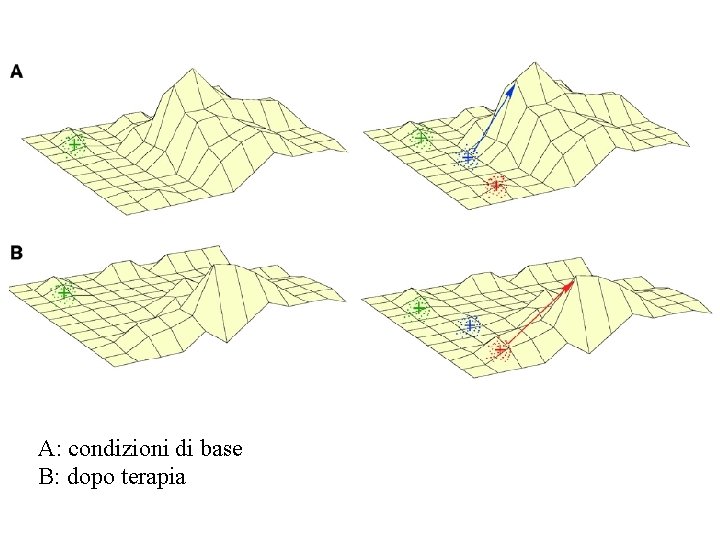
I vantaggi dell’eterogeneità clonale • La presenza di più cloni fornisce la capacità di esplorare il “paesaggio di fitness” (fitness landscape) con maggiore efficienza – Uno dei subcloni può trovarsi in vicinanza di uno dei picchi di fitness, e quindi avvicinarsi ad esso mediante un numero di eventi mutazionali basso – Dopo terapia, uno dei subcloni –ancora- può trovarsi vicino ad uno dei nuovi picchi di fitness imposti dai farmaci

A: condizioni di base B: dopo terapia

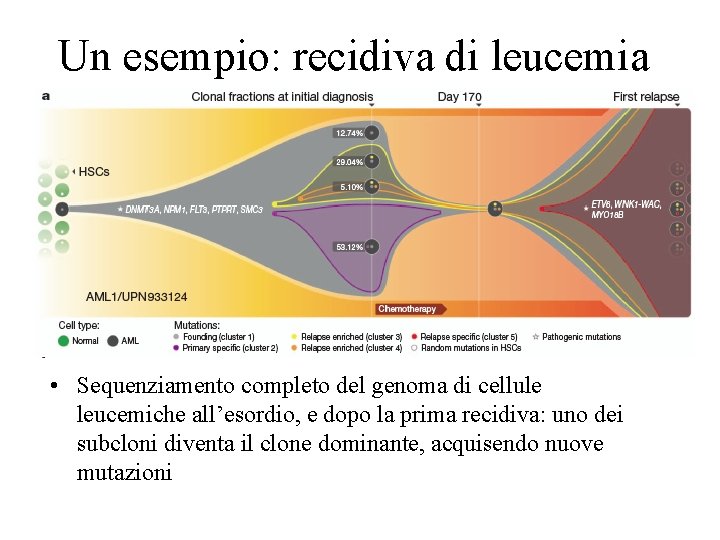
Un esempio: recidiva di leucemia • Sequenziamento completo del genoma di cellule leucemiche all’esordio, e dopo la prima recidiva: uno dei subcloni diventa il clone dominante, acquisendo nuove mutazioni

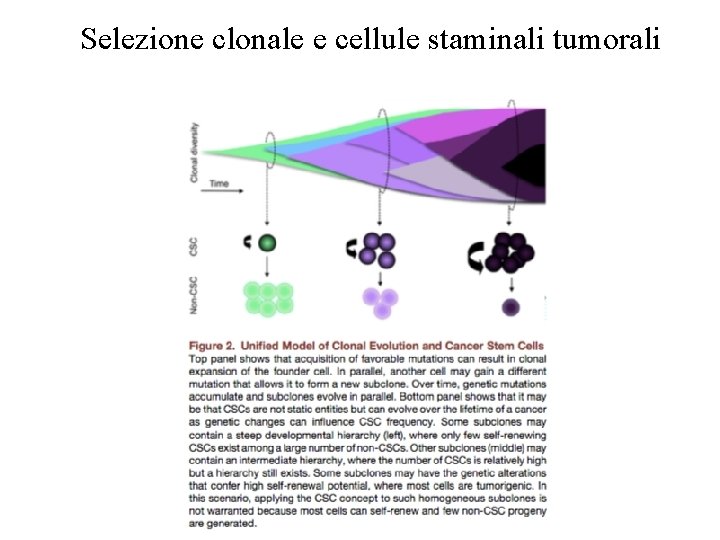
Selezione clonale e cellule staminali tumorali

Quanti sono i geni mutati in un tumore ?

Next Generation Sequencing • Progresso delle tecnologie di sequenziamento del DNA e riduzione dei costi – sequenziamento del genoma umano (3, 000, 000 di basi) negli anni ’ 90 inizio 2000: >5 anni, $300, 000 – L’ALTRO IERI (2010): sequenziamento del genoma umano di J. Watson in 13 mesi, $350, 000!!! – IERI (2011): sequenziamento di 1 genoma in 1 settimana, 50, 000$ – OGGI: 1 whole exome in 1 giorno, al costo di poche centinaia di dollari – European '1+ Million Genomes' Initiative aims to have 1 million sequenced genomes from EU by 2022, and as of June 14, 2019, has 21 countries on board. All Of Us in America aims for 1 million WGS, and Genome. Asia 100 K aims to sequence 0. 1 million Asians

How was this achieved? • Integration (Think about sequencing pipeline) • Parallelization • Miniaturization Same concepts that revolutionarized integrated circuits

Massively parallel sequencing • Sequenziamento tradizionale: regioni di DNA vengono isolate, clonate in plasmidi (o simili), amplificate mediante crescita in batteri e quindi cloni individuali vengono sequenziati • Sequenziamento parallelo: il DNA da analizzare viene frammentato e (senza essere clonato) viene immobilizzato su una superficie solida (un vetrino, p. es. ), quindi viene amplificato via PCR e poi ogni singolo frammento viene sequenziato contemporaneamente

Sequenziamento sistematico del DNA dei tumori • Prima analisi completata nel 2007: circa 20 tumori (colon e mammari) – Sequenziamento degli esoni trascritti (non dell’intero genoma) per circa 20, 000 geni dal tessuto normale e dal tumore • Geni mutati nel tumore rianalizzati in altri 25 pazienti per avere una idea della frequenza di mutazioni riscontrate per quel gene nei tumori – I più interessanti sono sequenziati in altri 100 pazienti

Alcuni conti • Identificate in media ≈ 80 mutazioni/tumore • Le mutazioni interessano geni diversi in tumori di tipo diverso (colon vs mammari)

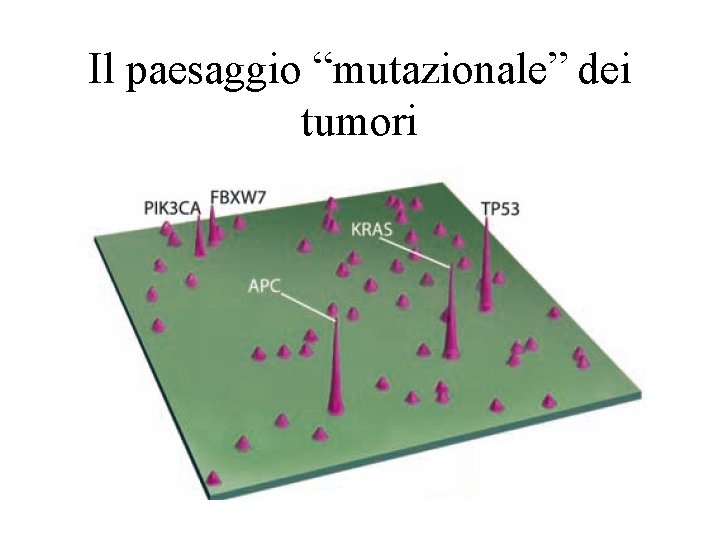
Il paesaggio “mutazionale” dei tumori

Considerazioni • Pochissimi sono i geni mutati frequentemente in molti tumori (5): – “MONTAGNE” • La maggior parte dei geni identificati sono mutati raramente in alcuni tumori: – “COLLINE”

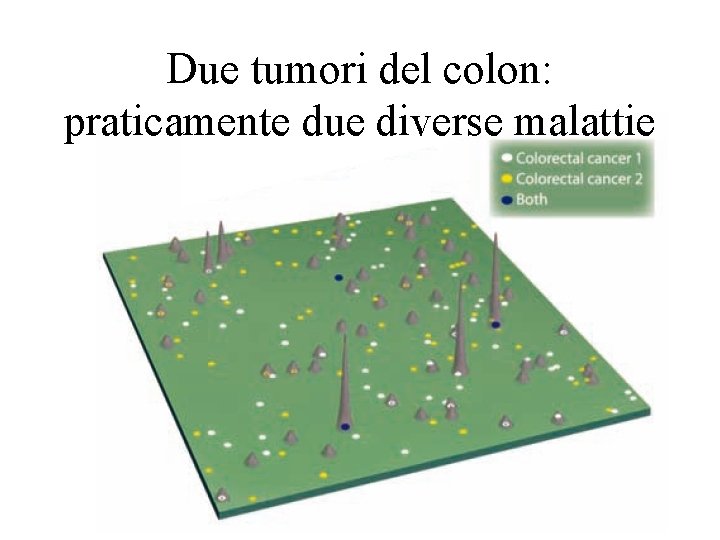
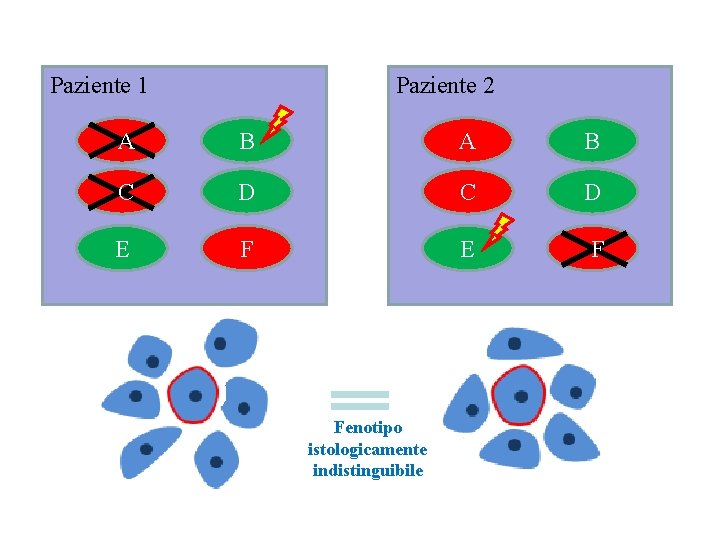
Due tumori del colon: praticamente due diverse malattie

Paziente 1 Paziente 2 A B C D E F Fenotipo istologicamente indistinguibile

Chi conta di più? • Le ricerche si sono concentrate in passato sulle “montagne”, che sono state scoperte prima con le tecnologie disponibili • In realtà le “colline” rappresentano la situazione più frequente – Le “colline” sono molto numerose, ma il numero di “pathways” colpito è minore (più colline appartengono allo stesso pathway)

Il primo tumore umano interamente sequenziato AML con cariotipo normale (100, 000, 000 bp sequenziate!!!)

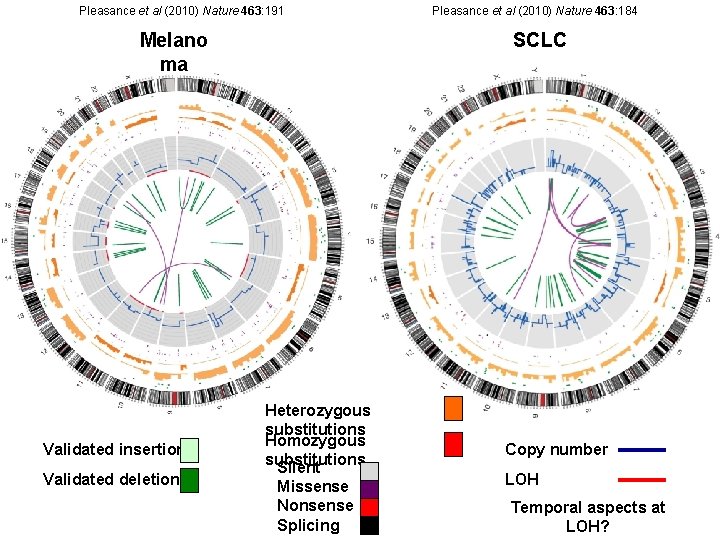
Whole genome and transcriptome sequencing of MM metastasis and lymphoblastoid cell lines from same patient Of 292 somatic base substitutions in coding regions, 187 cause amino acid changes Pleasance et al (2010) Nature 463: 191

Whole genome and transcriptome sequencing of SCLC and lymphoblastoid cell lines from same patient Of 134 somatic base substitutions in coding regions, 98 cause amino acid changes Pleasance et al (2010) Nature 463: 184

Pleasance et al (2010) Nature 463: 191 Melano ma Validated insertions Validated deletions Pleasance et al (2010) Nature 463: 184 SCLC Heterozygous substitutions Homozygous substitutions Silent Missense Nonsense Splicing Copy number LOH Temporal aspects at LOH?

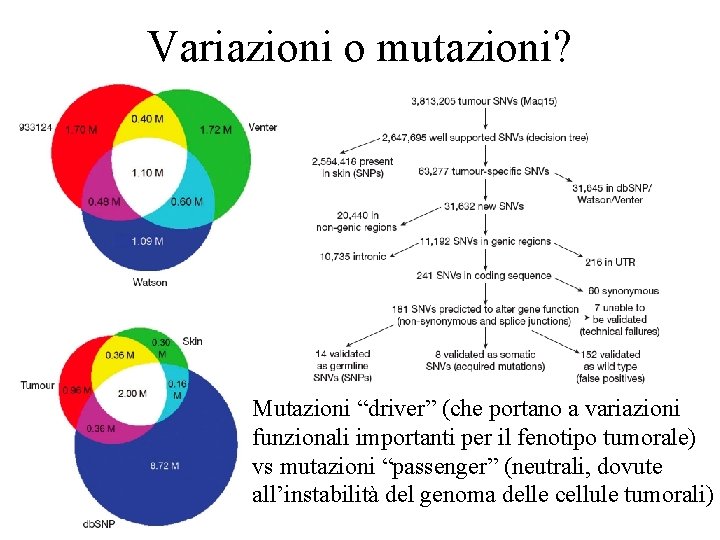
Variazioni o mutazioni? Mutazioni “driver” (che portano a variazioni funzionali importanti per il fenotipo tumorale) vs mutazioni “passenger” (neutrali, dovute all’instabilità del genoma delle cellule tumorali)

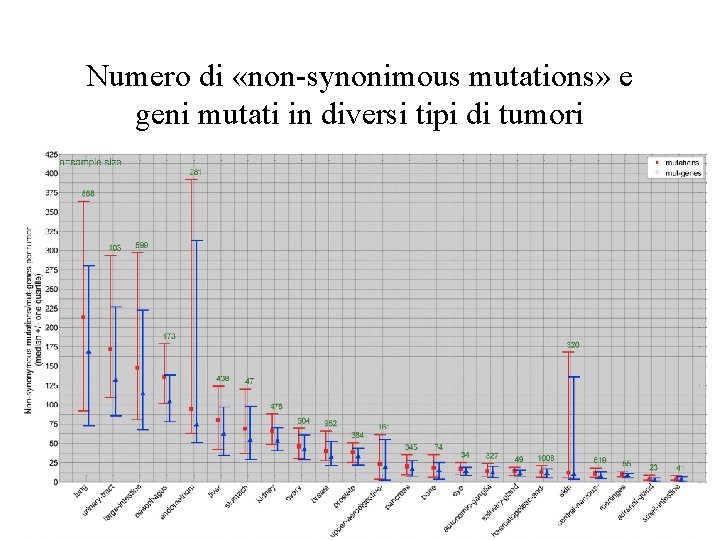
Numero di «non-synonimous mutations» e geni mutati in diversi tipi di tumori

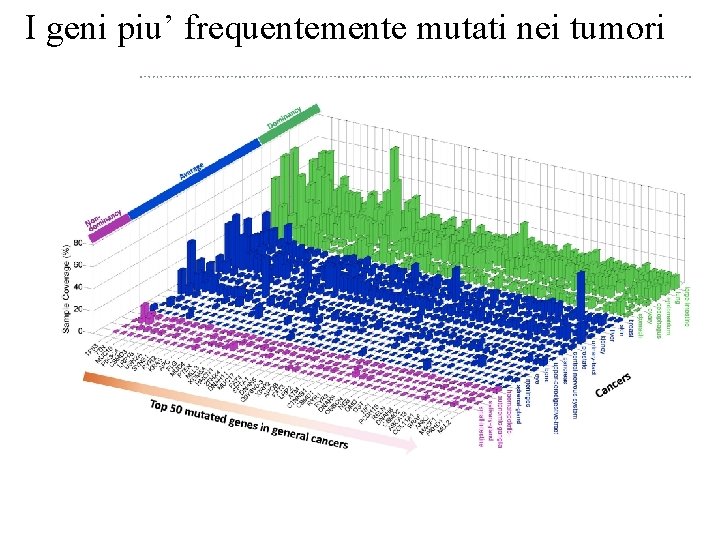
I geni piu’ frequentemente mutati nei tumori

La progressione tumorale “da vicino” Sequenziamento di tumori primari/mestastasi dallo stesso paziente

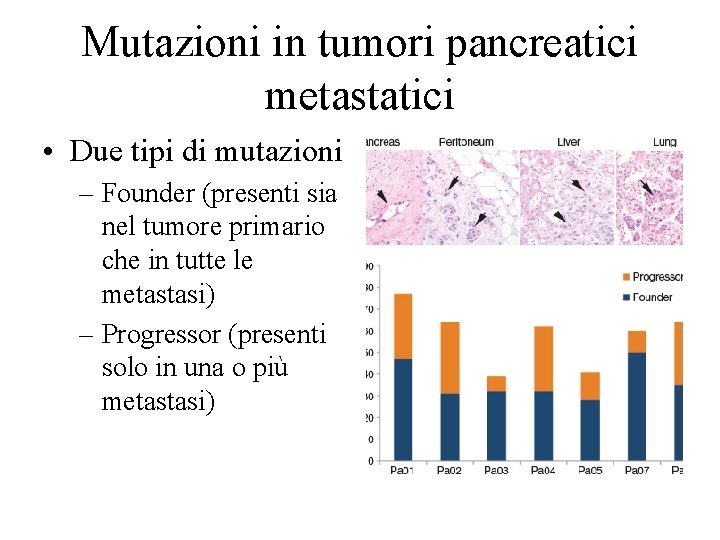
Mutazioni in tumori pancreatici metastatici • Due tipi di mutazioni – Founder (presenti sia nel tumore primario che in tutte le metastasi) – Progressor (presenti solo in una o più metastasi)

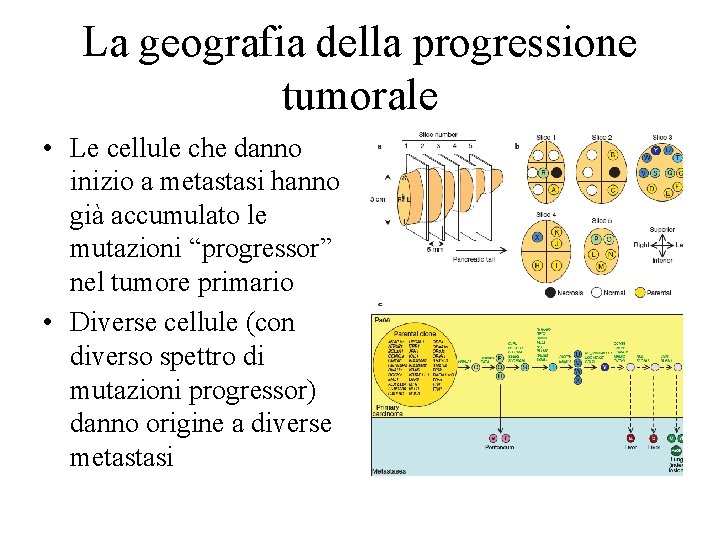
La geografia della progressione tumorale • Le cellule che danno inizio a metastasi hanno già accumulato le mutazioni “progressor” nel tumore primario • Diverse cellule (con diverso spettro di mutazioni progressor) danno origine a diverse metastasi

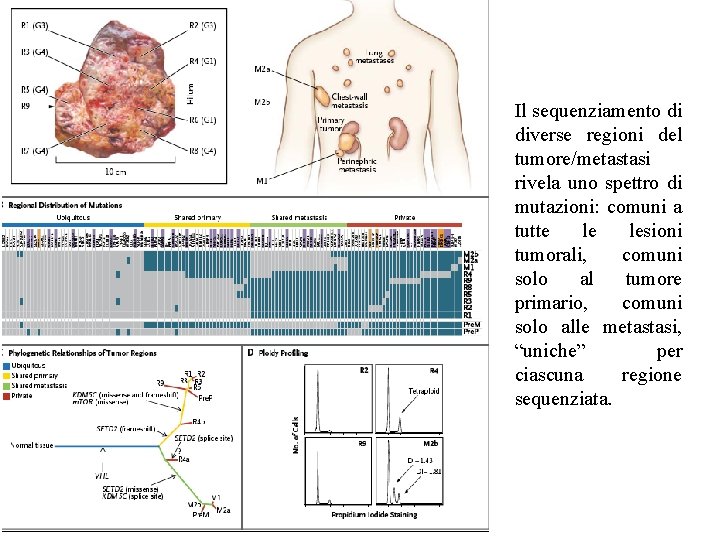
Il sequenziamento di diverse regioni del tumore/metastasi rivela uno spettro di mutazioni: comuni a tutte le lesioni tumorali, comuni solo al tumore primario, comuni solo alle metastasi, “uniche” per ciascuna regione sequenziata.

Patogenesi molecolare dei tumori

Mutazioni ed instabilitá genomica • Alcuni numeri “agghiaccianti”: – 1014 cellule/uomo; – 1016 divisioni cellulari/durata della vita media; – 10 -6/10 -7 frequenza di mutazioni/gene/divisione cellulare Ogni gene umano é mutato 10 miliardi di volte durante la nostra vita!!! • La maggior parte di queste mutazioni non sono trasmissibili perché non avvengono nelle cellule germinali

Geni associati alla trasformazione neoplastica • Oncogeni: l’”acceleratore” bloccato • Oncosoppressori: I “freni” malfunzionanti • Instabilitá genomica: guida in stato di ubriachezza

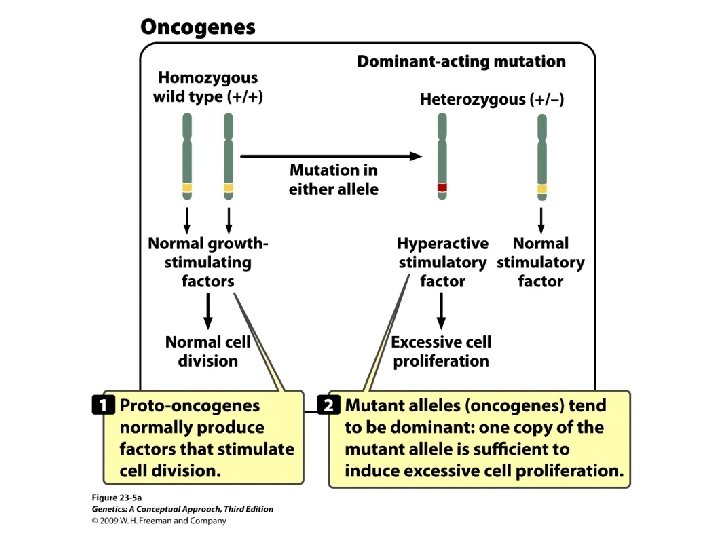
Oncogenes and Tumor-Suppressor Genes • Oncogene: dominant-acting stimulatory genes that cause cancer • Proto-oncogenes: responsible for basic cellular functions in normal cells; when mutated, they become oncogenes.

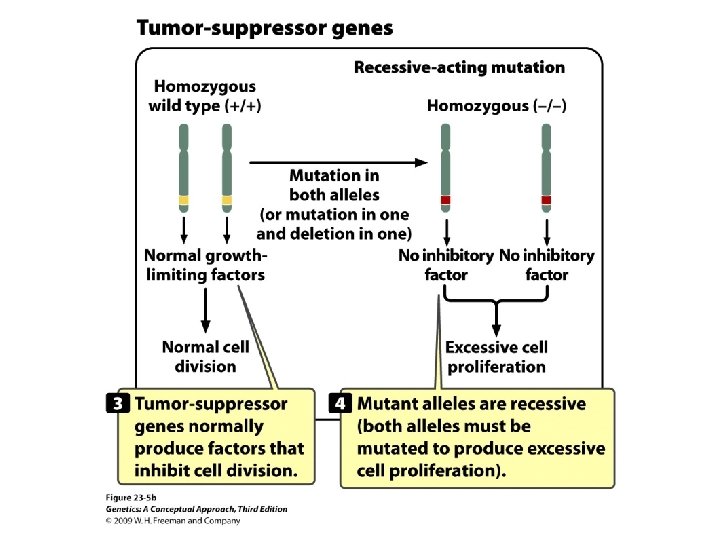
Tumor-Suppressor Genes Inhibit cancer and recessive acting; when mutated, normal cells become cancerous.



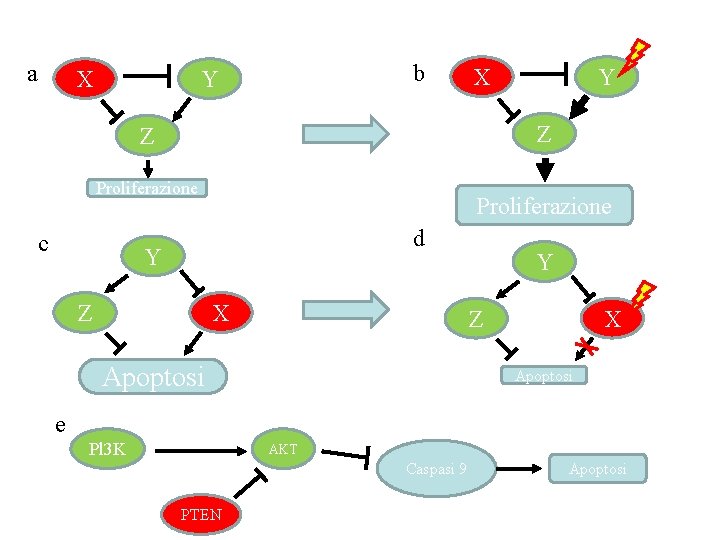
a X b Y X Z Z Proliferazione c Y Proliferazione d Y Z X Y Z Apoptosi X Apoptosi e Pl 3 K AKT Caspasi 9 PTEN Apoptosi

Modelli teorici di soppressione tumorale • L’inattivazione di un gene il cui prodotto funge da mediatore in un pathway lineare dá come risultato l’inattivazione dell’intero pathway. • In questo caso, l’inattivazione successiva di un altro componente dello stesso pathway non conferirebbe ulteriori vantaggi selettivi alla cellula che presenta la prima mutazione, e quindi la mutazione successiva non sarebbe osservabile nel tumore emergente.

Visione integrata di oncogeni ed oncosoppressori • Aldilá del singolo gene, quello che occorre considerare é la necessitá per la cellula tumorale di raggiungere l’inattivazione di un determinato pathway • Tale inattivazione si puó raggiungere per attivazione di un oncogene, o per inattivazione di un oncosoppressore • Questa visione ci consente di classificare I geni in base al pathway cui appartengono: geni appartenenti a pathway diversi (p. es. Rb e p 53) sono spesso mutati nella stessa cellula tumorale

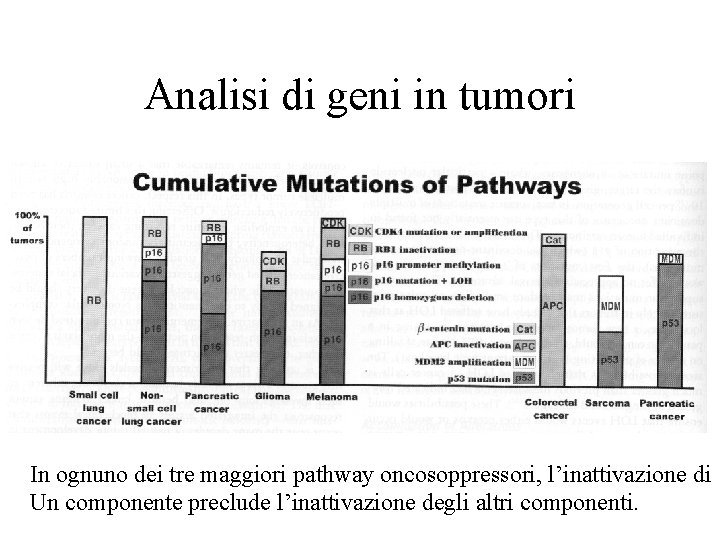
Analisi di geni in tumori In ognuno dei tre maggiori pathway oncosoppressori, l’inattivazione di Un componente preclude l’inattivazione degli altri componenti.

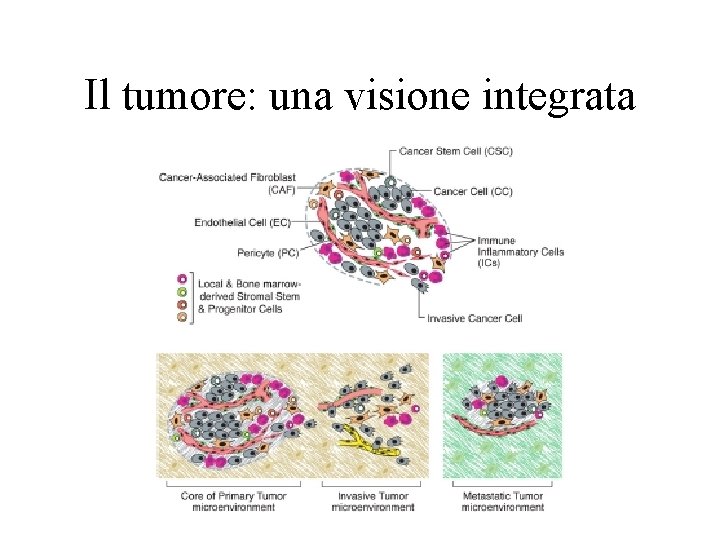
Il tumore: una visione integrata

La cellula tumorale acquisisce queste caratteristiche mediante mutazioni alterazioni epigenetiche

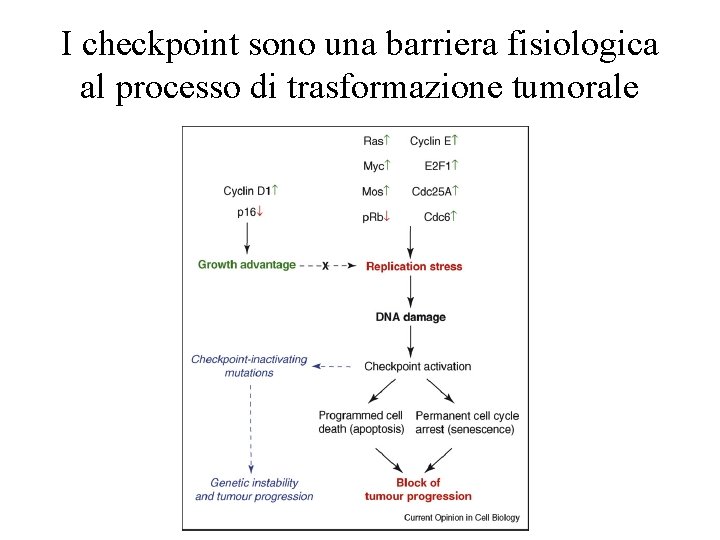
La resistenza delle cellule umane alla trasformazione tumorale • Le nostre cellule hanno una serie di meccanismi/checkpoints formidabile per arrestare il processo di trasformazione tumorale • Nelle nostre cellule si accumulano moltissime mutazioni, ma la trasformazione tumorale rimane un evento raro • Singole mutazioni sono quindi insufficienti per la trasformazione tumorale: – modello “multi-step” della trasformazione tumorale

I checkpoint sono una barriera fisiologica al processo di trasformazione tumorale

La senescenza cellulare è un evento comune di risposta anti-tumorale • Nei: – Mutazione della chinasi BRAF: • Attivazione di segnali di crescita incontrollati – Replication stress – Attivazione di Dna. Damage. Response (DDR) – Senescenza cellulare (documentata in vivo nella cute umana)
 Testbench in verilog
Testbench in verilog Descent with modification: a darwinian view of life
Descent with modification: a darwinian view of life The darwin
The darwin Keystone plant
Keystone plant Geographic distribution of species evolution
Geographic distribution of species evolution Evolution of species 2
Evolution of species 2 Schnauzer dogs there are three sizes
Schnauzer dogs there are three sizes What is the jackpot on mega millions
What is the jackpot on mega millions Europe population in millions
Europe population in millions Qui veut gagner des millions musique
Qui veut gagner des millions musique Paid drawing. it be work millions.
Paid drawing. it be work millions. Mechanical isolation
Mechanical isolation Millions billions trillions chart
Millions billions trillions chart Drawing. could be work millions.
Drawing. could be work millions. Qui veut gagner des millions
Qui veut gagner des millions Dinosaurs lived millions of years ago what did they eat
Dinosaurs lived millions of years ago what did they eat Lsrl
Lsrl Financial statement in millions
Financial statement in millions The 15 hundreds
The 15 hundreds Glaciation left hundreds of thousands of
Glaciation left hundreds of thousands of Leading digit
Leading digit A windstorm blows in hundreds of seeds from a nearby meadow
A windstorm blows in hundreds of seeds from a nearby meadow Hundreds and thousands sweet test
Hundreds and thousands sweet test Ones tens hundreds thousands with decimals
Ones tens hundreds thousands with decimals Idoe hundreds chart
Idoe hundreds chart Ones tens hundreds
Ones tens hundreds 427 266 to the nearest ten thousand
427 266 to the nearest ten thousand 000 counting hundreds more each week
000 counting hundreds more each week Tenths and units
Tenths and units Ones tens hundreds thousands
Ones tens hundreds thousands 427 266 to the nearest ten thousand
427 266 to the nearest ten thousand Rounding key words
Rounding key words Edwardsiella tarda tsi results
Edwardsiella tarda tsi results Closed ecological system
Closed ecological system Exotic species definition biology
Exotic species definition biology Monoelectronic species examples
Monoelectronic species examples Many species one planet one future
Many species one planet one future R-selected species
R-selected species Example of biological species
Example of biological species Natural selection definition
Natural selection definition Mouse species
Mouse species Exotic species definition
Exotic species definition Are genus and species italicized
Are genus and species italicized Ecological succession
Ecological succession Kingdom phylum class order
Kingdom phylum class order Morphological species concept
Morphological species concept Phyllopodia
Phyllopodia Interference competition
Interference competition Species genus family order
Species genus family order Taxonomic key for plants
Taxonomic key for plants Isoetes
Isoetes Resource partitioning tends to lead to a high degree of
Resource partitioning tends to lead to a high degree of Section 20-1 review species interactions
Section 20-1 review species interactions Kingdom animalia contains 350 000 species of what
Kingdom animalia contains 350 000 species of what Species packing
Species packing Wikimedia
Wikimedia Domain of a frog
Domain of a frog Horse taxonomy domain
Horse taxonomy domain Parasitism
Parasitism Horse kingdom classification
Horse kingdom classification Species vary locally examples
Species vary locally examples Why does new guinea have more species of birds than bali?
Why does new guinea have more species of birds than bali?