COLOIDES OU DISPERSES COLOIDAIS Thomas Graham 1805 1869

























- Slides: 57

COLOIDES OU DISPERSÕES COLOIDAIS Thomas Graham (1805 -1869) Thomas Graham (1861) químico escocês de Glasgow Coloides que em grego Kolla significa cola que se referia às soluções de goma arábica que se apresentavam em estado amorfo gelatinoso que difundia mais lentamente que soluções de sais Coloide representa o estado intermediário entre uma solução (verdadeira) e uma suspensão

SOLUÇÕES - Sistemas homogêneos - “soluções verdadeiras” - Solvente/Soluto - Soluto: dimensões muito pequenas: < ~1 nm (íon, moléculas) ex: açúcar, Na. Cl - Soluto não sedimenta sob ação da gravidade ou sob (ultra)centrifugação - Soluto não é separado por filtração - Atravessa membranas semipermeáveis - Soluto não é visível microscópio eletrônico (ultra-)

SUSPENSÕES - Sistemas Heterogêneo - Meio Dispersante/Disperso - Disperso: Dimensões: > ~1000 nm - Disperso sedimenta gravidade - Disperso sedimenta sob centrifugação - Disperso visível microscópio comum - Disperso separado por filtração - Não atravessa membranas semipermeáveis

COLOIDES - Sistemas Heterogêneo - Partículas dispersas: íons e moléculas (macromoléculas) - Meio Dispersante/Disperso - Disperso: Dimensões: 1 a ~1000 nm - Não sedimenta por ação gravidade - Sedimentam por (ultra) centrifugação - Partículas (disperso) não é visível em microscópio comum porém visíveis em microscópio eletrônico (ultra-) - Disperso não é separado por filtração (passa pelo filtro) - Não atravessa membranas semipermeáveis

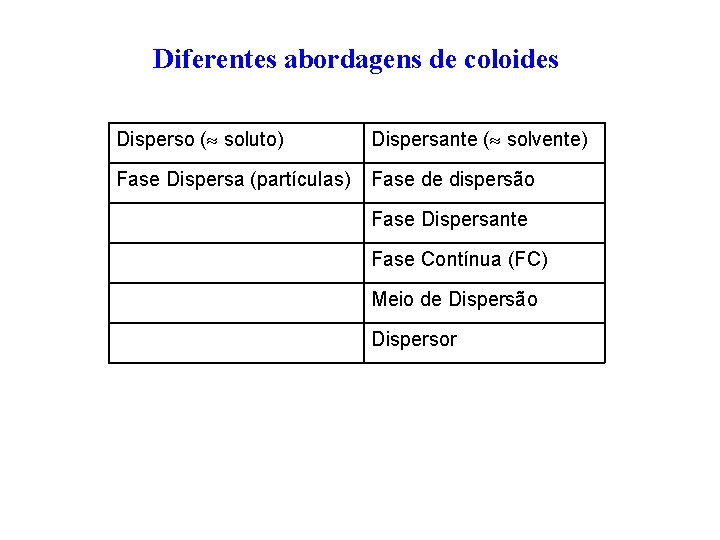
Diferentes abordagens de coloides Disperso ( soluto) Dispersante ( solvente) Fase Dispersa (partículas) Fase de dispersão Fase Dispersante Fase Contínua (FC) Meio de Dispersão Dispersor


Classificação dos Coloides • Aerossol - consiste em um sólido ou líquido disperso em um gás. • Emulsão - são formados por líquido disperso em outro líquido. Agentes emulsificantes: impedem que o disperso e o dispersante se separem. • Espuma - consiste em um gás disperso em sólido ou líquido. • Sol - é formado por um sólido disperso em líquido. • Gel - é formado por um líquido disperso em sólido.

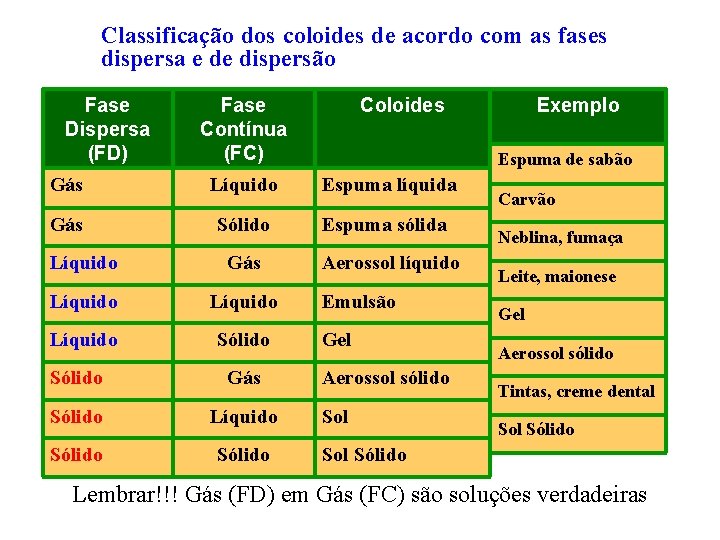
Classificação dos coloides de acordo com as fases dispersa e de dispersão Fase Dispersa (FD) Fase Contínua (FC) Coloides Espuma de sabão Gás Líquido Espuma líquida Gás Sólido Espuma sólida Líquido Gás Líquido Sólido Gás Sólido Líquido Sólido Exemplo Aerossol líquido Emulsão Gel Aerossol sólido Sol Carvão Neblina, fumaça Leite, maionese Gel Aerossol sólido Tintas, creme dental Sol Sólido Lembrar!!! Gás (FD) em Gás (FC) são soluções verdadeiras

SOL - aspecto de solução Sol é um coloide constituído de partículas sólidas finamente divididas dispersas em um meio de dispersão líquido. Quanto à interação entre as moléculas da fase contínua e da fase dispersa, os sóis são classificados em liofílicos (apresentam partículas dispersas com maior afinidade com o solvente). São mais estáveis e semelhantes à solução verdadeira, e liofóbicos, cujas partículas não atraem fortemente as moléculas de solvente e coagulam ou precipitam facilmente. Ex: Cola, Gelatina, Amido, Proteínas e certos polímeros em solventes orgânicos (borracha)

GEL – aspectos gelatinoso Gel é um coloide no qual a interação do líquido com partículas muito finas induz o aumento da viscosidade, tornando-se uma massa com partículas organizadas no meio de dispersão formando uma rede de partículas enfileiradas como um colar. Géis formam uma rede com natureza elástica e gelatinosa, tal como gelatina ou geleia de frutas, ou como um sólido rígido como sílica gel, muito usada em embalagens como agente secante. Precipitados gelatinosos Al(OH)3 Fe(OH)3 Cu(OH)2

Espuma é um sistema coloidal constituído de bolhas de gás muito pequenas dispersas em um meio líquido, Ex: Clara de ovo batida em neve (CO 2(g) dissolvido em meio líquido) ou em um meio sólido, como a espuma de poli(estireno) conhecida como isopor®. As bolhas podem coalescer, isto é, colidirem umas com as outras, e do encontro de duas formar uma bolha maior. Esse processo de coalescência causa a quebra da espuma, o que determina a instabilidade do sistema coloidal.

Espuma Chantilly pipoca

Emulsão Gel Água dispersa Gelatina

Coloide • Os coloides também são chamados de dispersões coloidais, onde o disperso só se deposita sob sedimentação forçada em ultracentrífugas. Uma ultracentrifugadora é uma centrifugadora optimizada para atingir velocidades de rotação muito elevadas, capazes de gerar uma aceleração da ordem de 9800 km/s 2

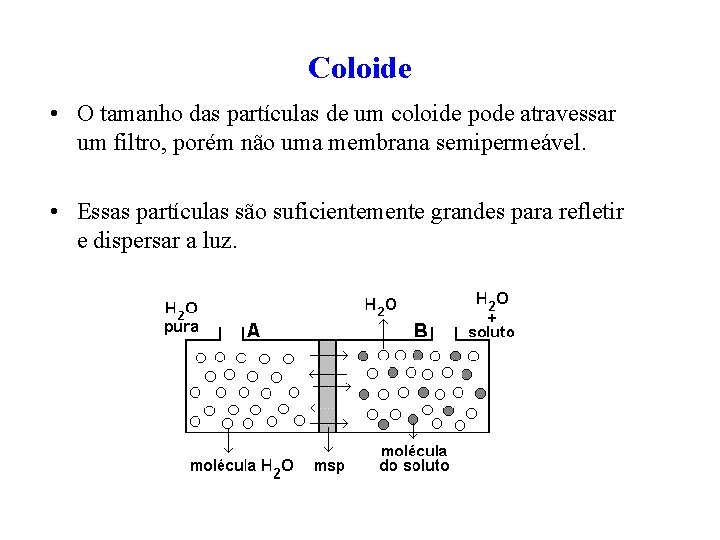
Coloide • O tamanho das partículas de um coloide pode atravessar um filtro, porém não uma membrana semipermeável. • Essas partículas são suficientemente grandes para refletir e dispersar a luz.

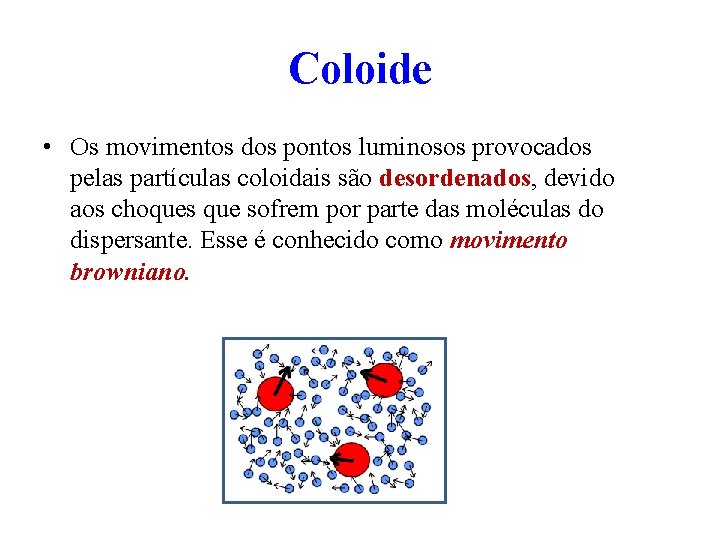
Coloide • Os movimentos dos pontos luminosos provocados pelas partículas coloidais são desordenados, devido aos choques que sofrem por parte das moléculas do dispersante. Esse é conhecido como movimento browniano.

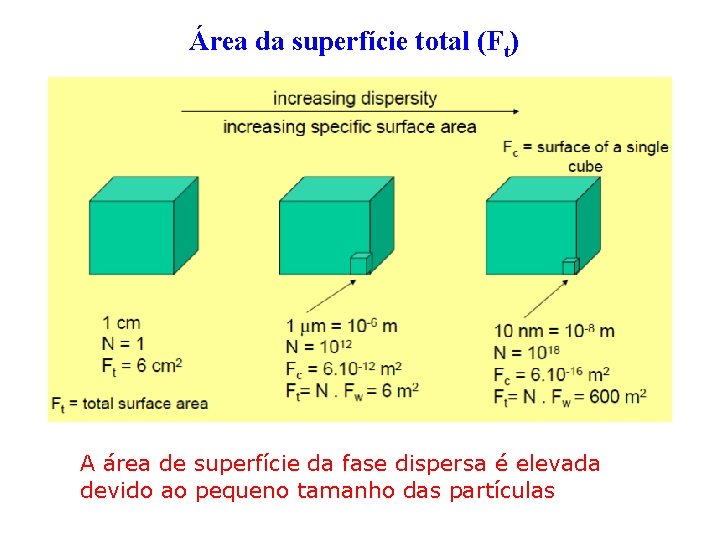
Tamanho e formato dos coloides - Partículas de dimensões coloidais têm maior área superficial que a de um mesmo volume de partículas de maior dimensão (não coloidal). - Superfície Específica: a área superficial por unidade de peso ou volume do material. Exemplo: 1) Pt metálica só é um catalisador no estado coloidal devido à grande área superficial, facilitando a adsorção de reagentes na superfície. 2) A cor de dispersões coloidais está relacionada com o tamanho das partículas. Ex: Geralmente, sóis de ouro coloidal têm a cor vermelha, mas quando aumenta as sua dimensão coloidal a cor partícula torna azul.

Área da superfície total (Ft) A área de superfície da fase dispersa é elevada devido ao pequeno tamanho das partículas

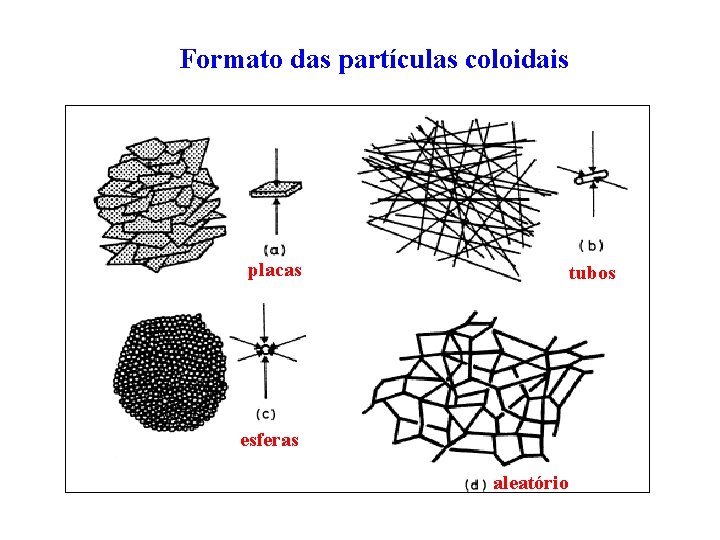
Formato das partículas coloidais placas tubos esferas aleatório

Tipos de Colóides Estabilidade

Liofílico - Estabilização pela interação com o meio (afinidade por solvente) H 2 O: hidrofílico - Estáveis por longos períodos Liofóbico - Baixa estabilização pelo meio (repulsão a solvente) H 2 O: hidrofóbico - Pouco estáveis: Aglutinam/coagulam Ex: em coloides hidrofóbicos existem somente forças atrativas fracas entre a água e a su Lyein = Lio = Solvente Do grego: Philen = gostar de (afinidade por) Phobos = repelir

Liofílico - A fase dispersa não precipita facilmente - Os sóis são bem estáveis Partículas de soluto envolvidas: a) Cargas negativas ou positivas b) Camada de solvente (solvatação)

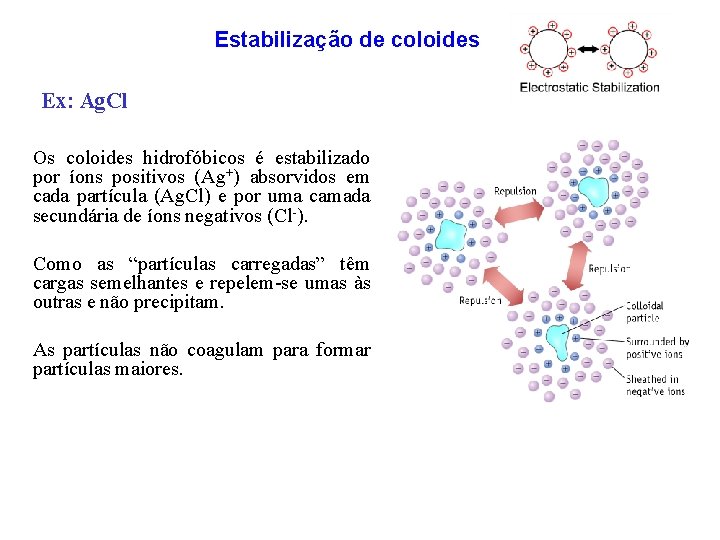
Estabilização de coloides Ex: Ag. Cl Os coloides hidrofóbicos é estabilizado por íons positivos (Ag+) absorvidos em cada partícula (Ag. Cl) e por uma camada secundária de íons negativos (Cl-). Como as “partículas carregadas” têm cargas semelhantes e repelem-se umas às outras e não precipitam. As partículas não coagulam para formar partículas maiores.

Liofílico Se o meio de dispersão é separado da fase dispersa o sol pode ser reconstituído pela simples mistura com o meio de dispersão Sóis reversíveis

Liofóbico Exemplos de sols liofóbicos: - sols de metais e seus compostos insolúveis como sulfetos e óxidos. Ex: partículas coloidais de ouro em água Precipitam facilmente: - Adição eletrólitos - Agitação - Aquecimento

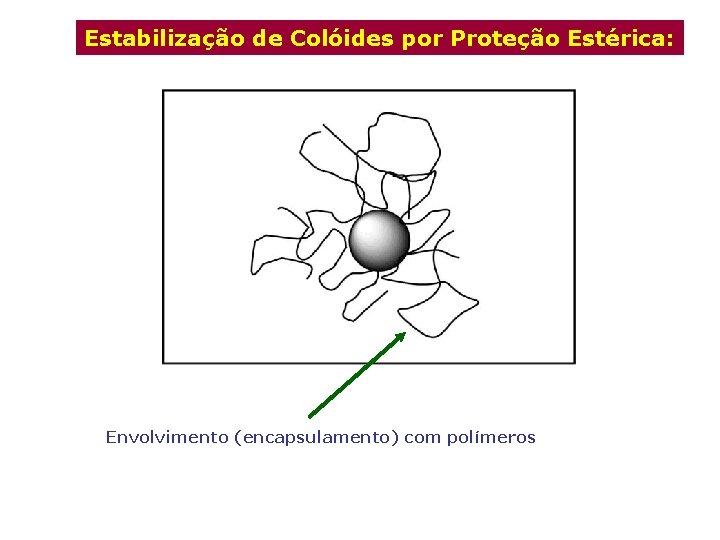
Estabilização de Colóides por Proteção Estérica: Envolvimento (encapsulamento) com polímeros

Liofóbico - Uma vez precipitados os sóis não são facilmente reconstituídos Sols irreversíveis

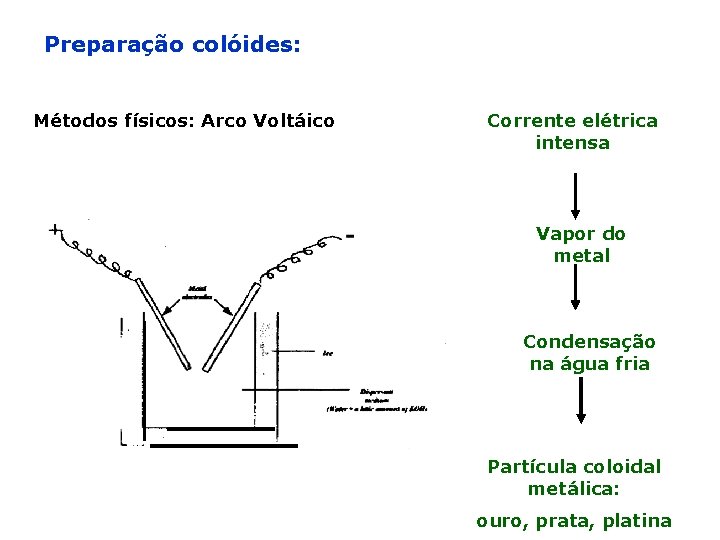
Preparação colóides: Métodos físicos: Arco Voltáico Corrente elétrica intensa Vapor do metal Condensação na água fria Partícula coloidal metálica: ouro, prata, platina

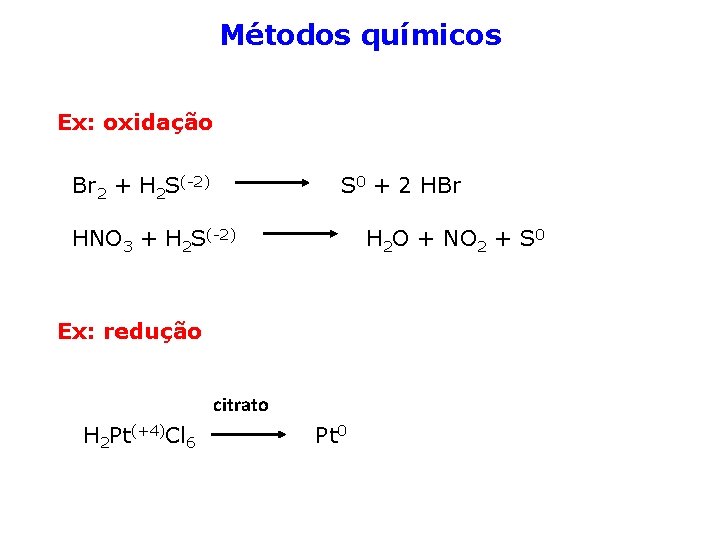
Métodos químicos Ex: oxidação Br 2 + H 2 S(-2) S 0 + 2 HBr HNO 3 + H 2 S(-2) H 2 O + NO 2 + S 0 Ex: redução citrato H 2 Pt(+4)Cl 6 Pt 0

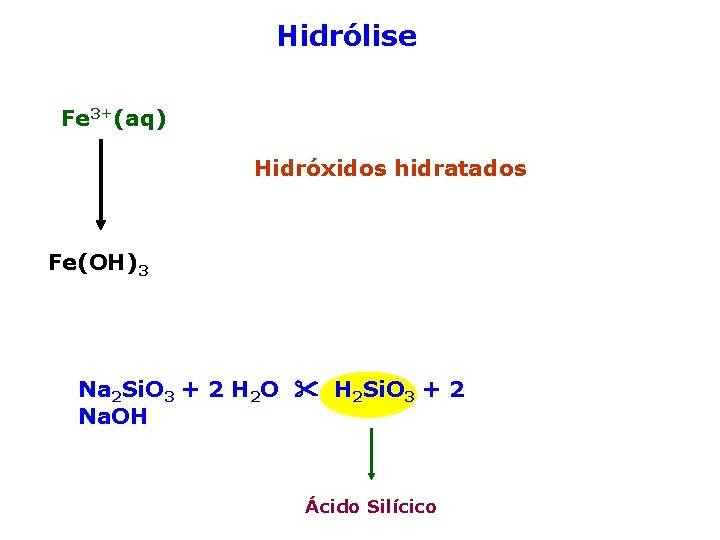
Hidrólise Fe 3+(aq) Hidróxidos hidratados Fe(OH)3 Na 2 Si. O 3 + 2 H 2 O H 2 Si. O 3 + 2 Na. OH Ácido Silícico

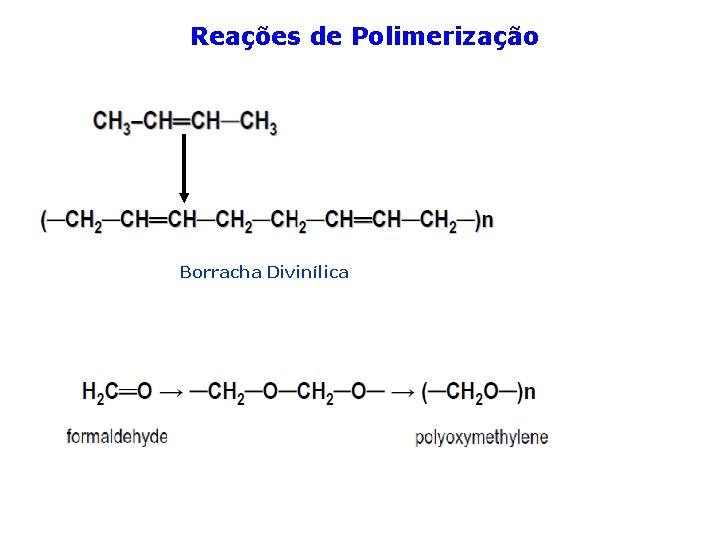
Reações de Polimerização Borracha Divinílica

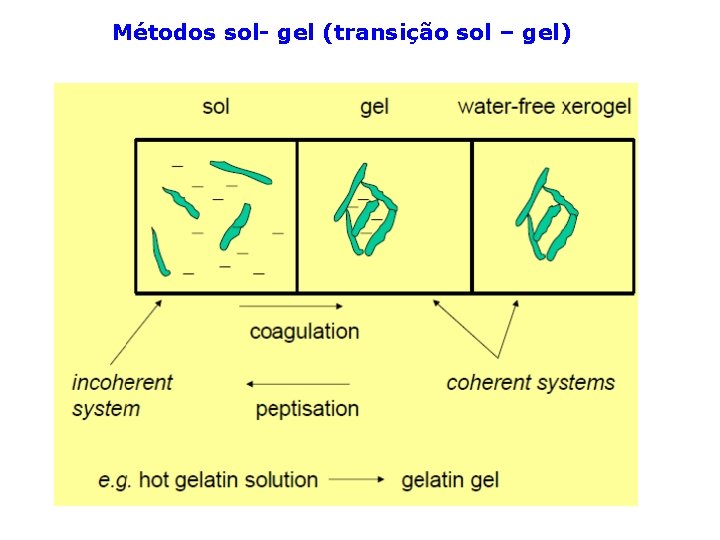
Métodos sol- gel (transição sol – gel)

Surfactantes Também chamados de tensoativos, são substâncias que diminuem a tensão superficial ou influenciam a superfície de contato entre duas fases (ex sabões, detergentes. . . Afetam as propriedades das superfícies. Micro-emulsões

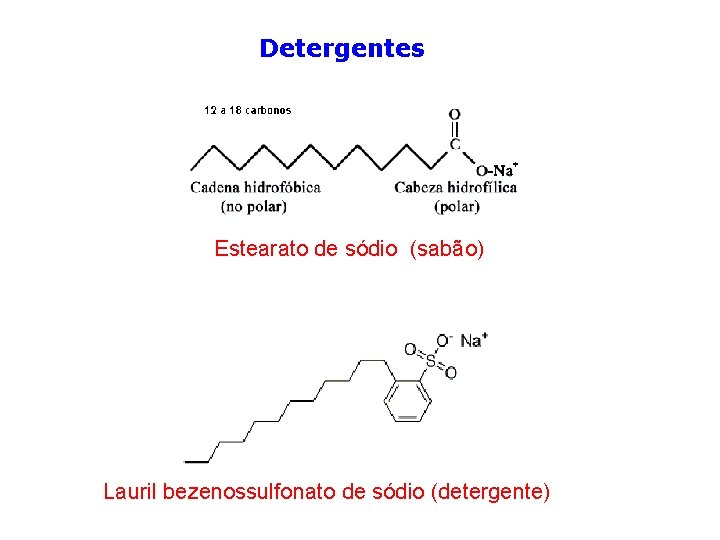
Detergentes Estearato de sódio (sabão) Lauril bezenossulfonato de sódio (detergente)


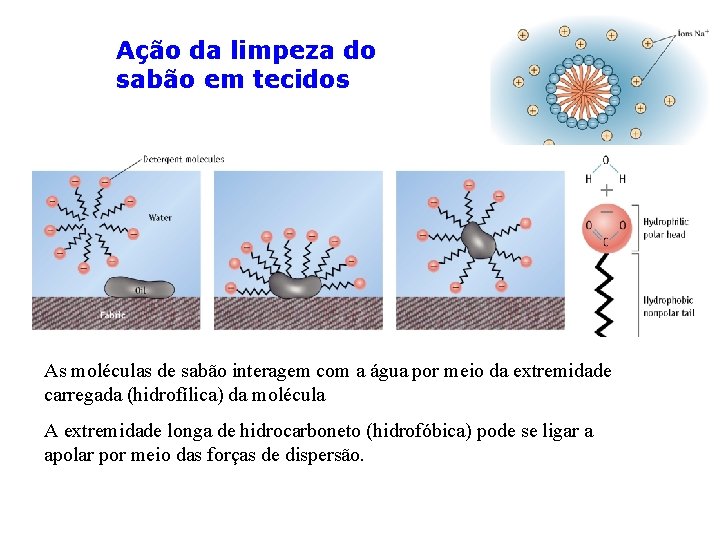
Ação da limpeza do sabão em tecidos As moléculas de sabão interagem com a água por meio da extremidade carregada (hidrofílica) da molécula A extremidade longa de hidrocarboneto (hidrofóbica) pode se ligar a apolar por meio das forças de dispersão.

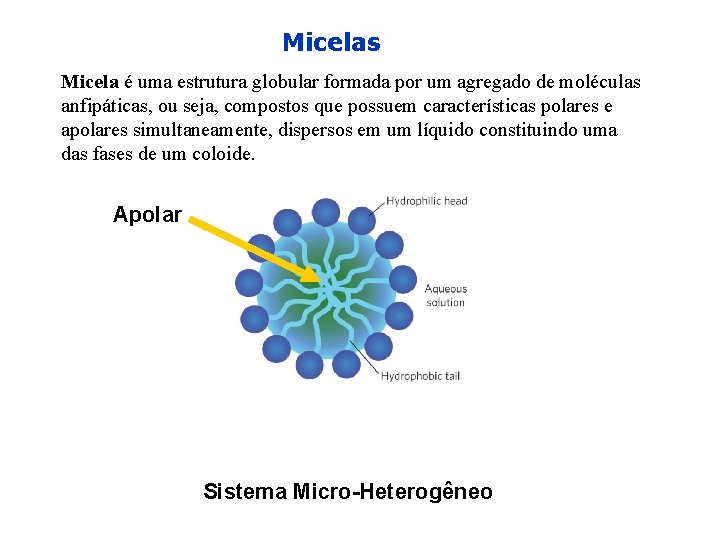
Micelas Micela é uma estrutura globular formada por um agregado de moléculas anfipáticas, ou seja, compostos que possuem características polares e apolares simultaneamente, dispersos em um líquido constituindo uma das fases de um coloide. Apolar Sistema Micro-Heterogêneo


Colóides Propriedades

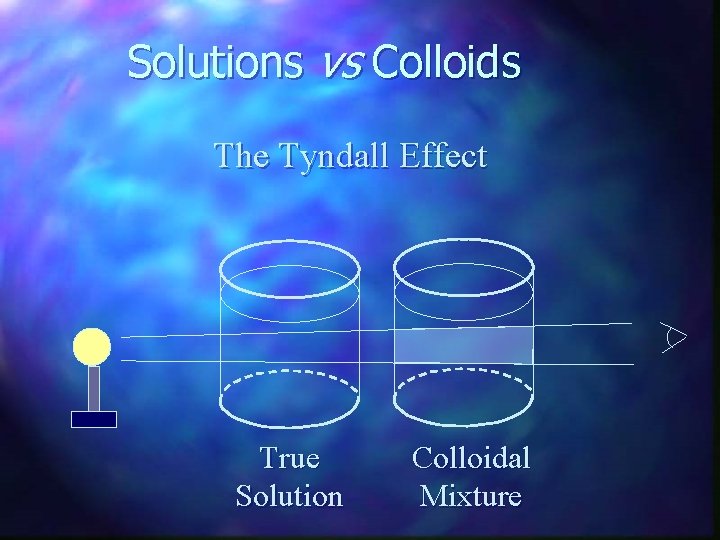
Efeito Tyndall - O efeito óptico provocado pela dispersão da luz nas partículas coloidais, confere um aspecto turvo, chamado de Efeito Tyndall. - Permite distinguir as soluções verdadeiras dos coloides, pois as soluções verdadeiras são transparentes e não dispersam a luz. h coloides soluções verdadeiras

Solutions vs Colloids The Tyndall Effect True Solution Colloidal Mixture

Solutions vs Colloids The Tyndall Effect True Solution Colloidal Mixture

Colóides Membranas Semipermeáveis

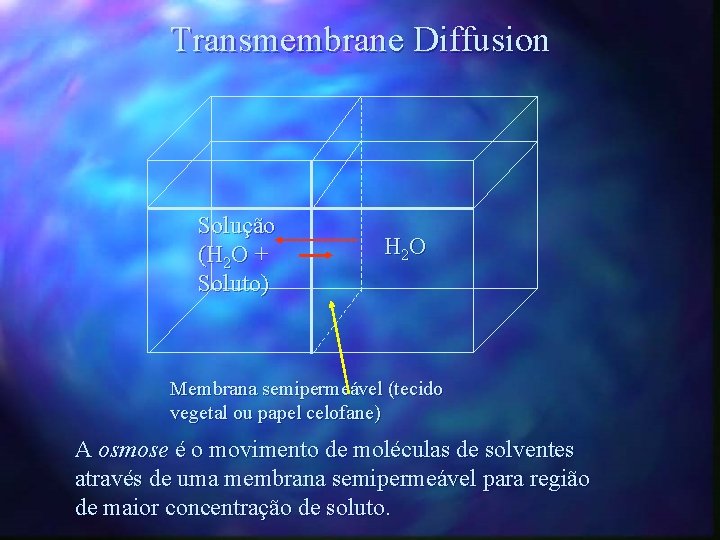
Transmembrane Diffusion Solução (H 2 O + Soluto) H 2 O Membrana semipermeável (tecido vegetal ou papel celofane) A osmose é o movimento de moléculas de solventes através de uma membrana semipermeável para região de maior concentração de soluto.

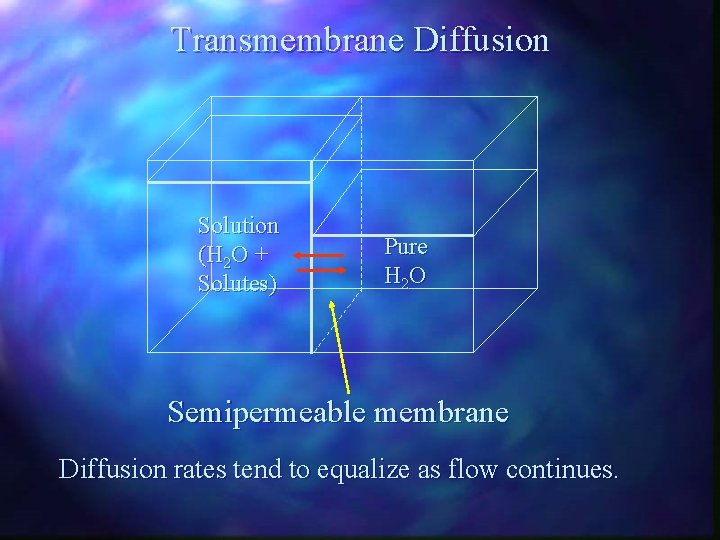
Transmembrane Diffusion Solution (H 2 O + Solutes) Pure H 2 O Semipermeable membrane Diffusion rates tend to equalize as flow continues.


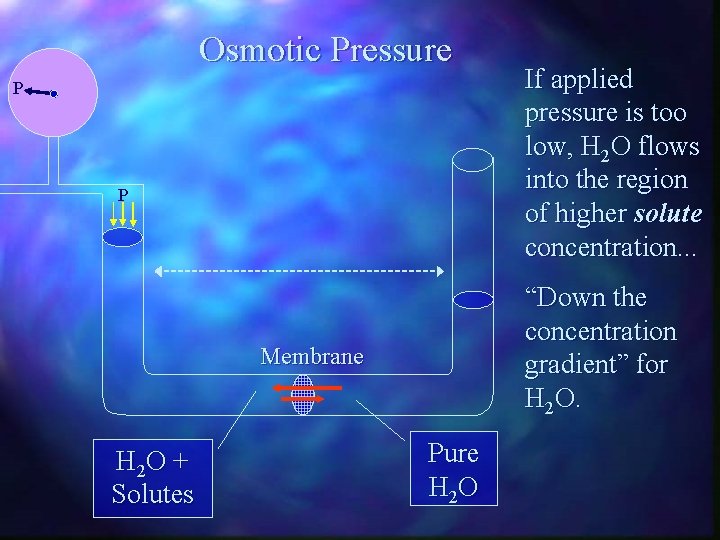
Osmotic Pressure P P “Down the concentration gradient” for H 2 O. Membrane H 2 O + Solutes If applied pressure is too low, H 2 O flows into the region of higher solute concentration. . . Pure H 2 O

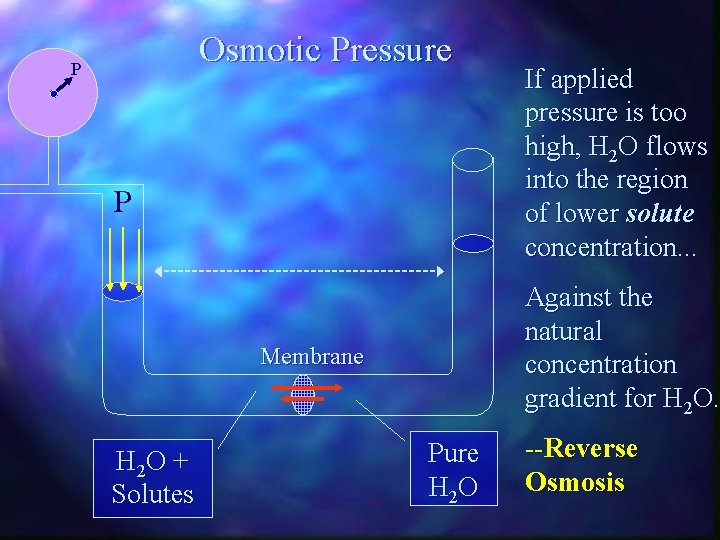
Osmotic Pressure P P Against the natural concentration gradient for H 2 O. Membrane H 2 O + Solutes If applied pressure is too high, H 2 O flows into the region of lower solute concentration. . . Pure H 2 O --Reverse Osmosis

OSMOSE REVERSA Método importante de Purificação de H 2 O

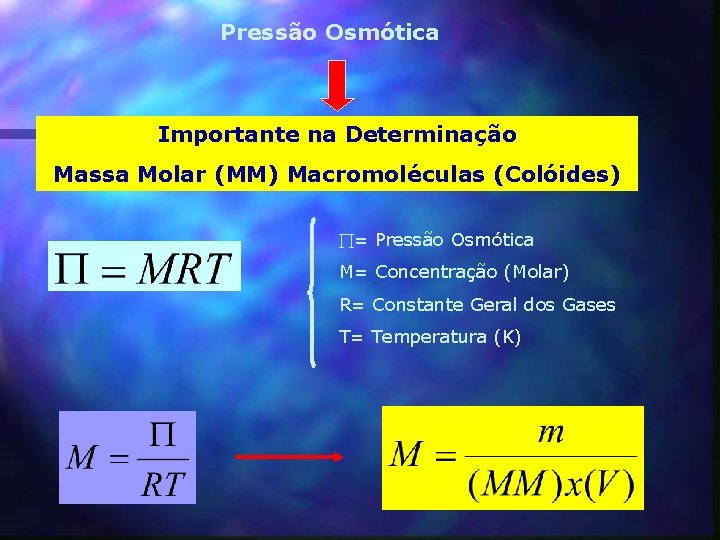
Pressão Osmótica Importante na Determinação Massa Molar (MM) Macromoléculas (Colóides) = Pressão Osmótica M= Concentração (Molar) R= Constante Geral dos Gases T= Temperatura (K)

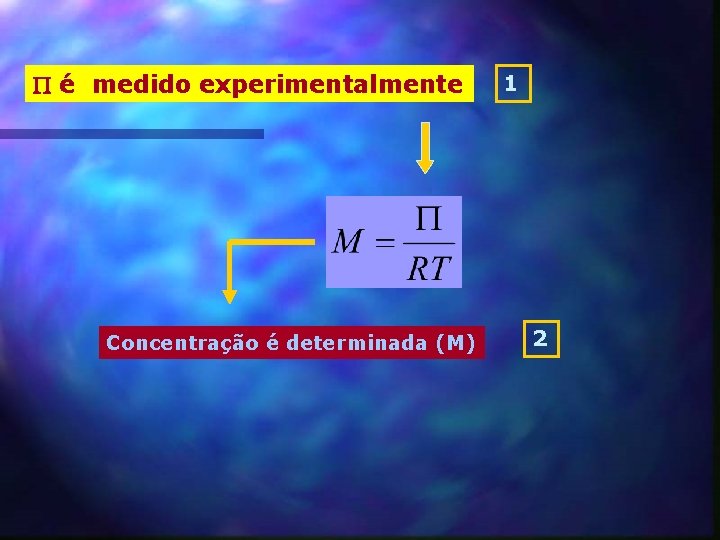
é medido experimentalmente Concentração é determinada (M) 1 2

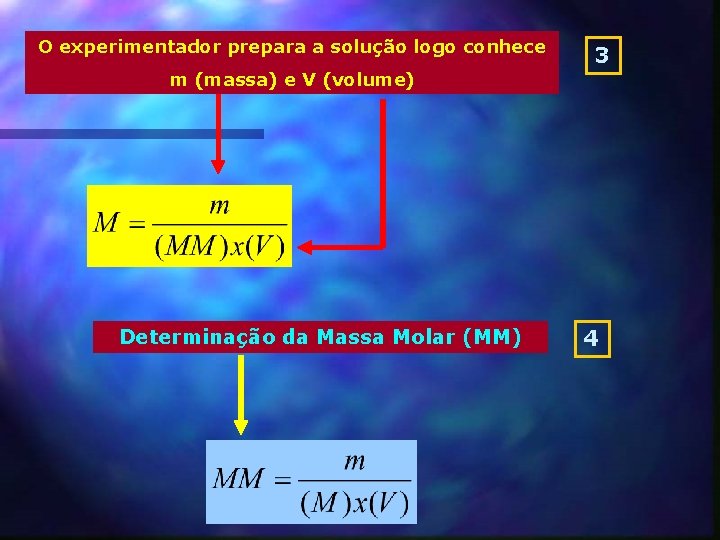
O experimentador prepara a solução logo conhece 3 m (massa) e V (volume) Determinação da Massa Molar (MM) 4

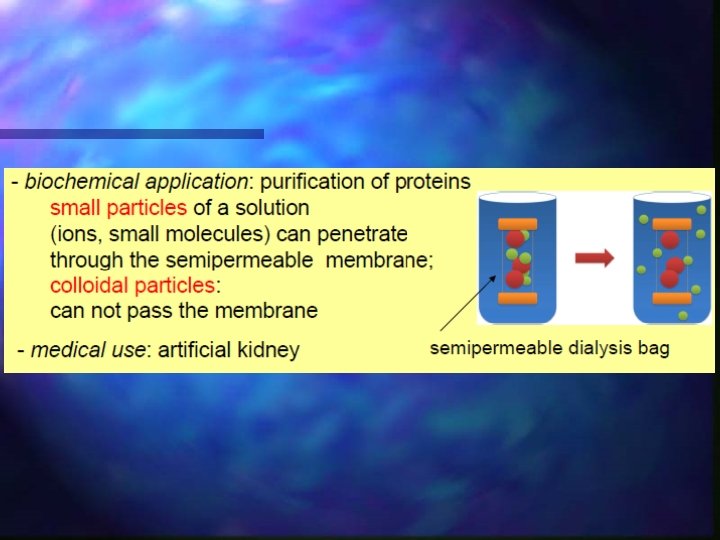
Diálise MÉTODO DE PURIFICAÇÃO COLÓIDES

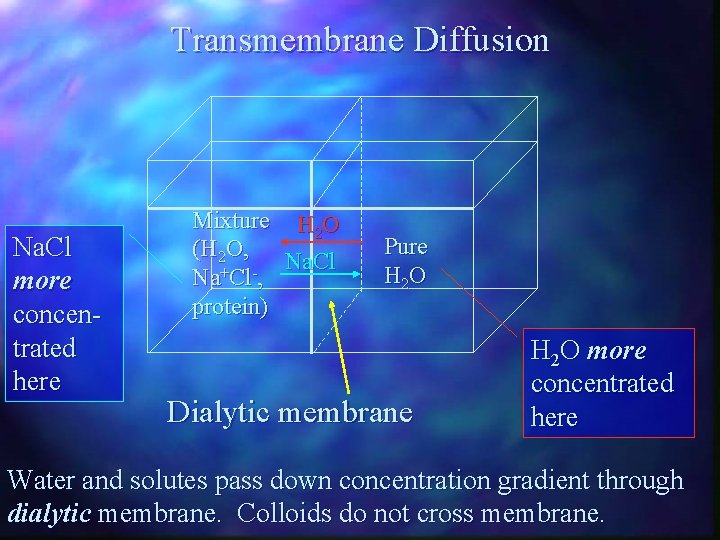
Transmembrane Diffusion Na. Cl more concentrated here Mixture H 2 O (H 2 O, Na. Cl + Na Cl , protein) Pure H 2 O Dialytic membrane H 2 O more concentrated here Water and solutes pass down concentration gradient through dialytic membrane. Colloids do not cross membrane.


Referências 1. J. C. Kotz; P. Treichel Jr. ; G. C. Weaver. Química geral e reações químicas, CENGAGE Learnig, vol. 1, 2010. 2. M. Jafelicce Jr. ; L. C. Varanda. O mundo dos colóides. Quimica Nova na Escola, No 9, maio 1999. 3. P. W. Atkins e L. Jones, Princípio de química – questionando a vida moderna e meio ambiente, 3ª ed. Bookman, 2007.

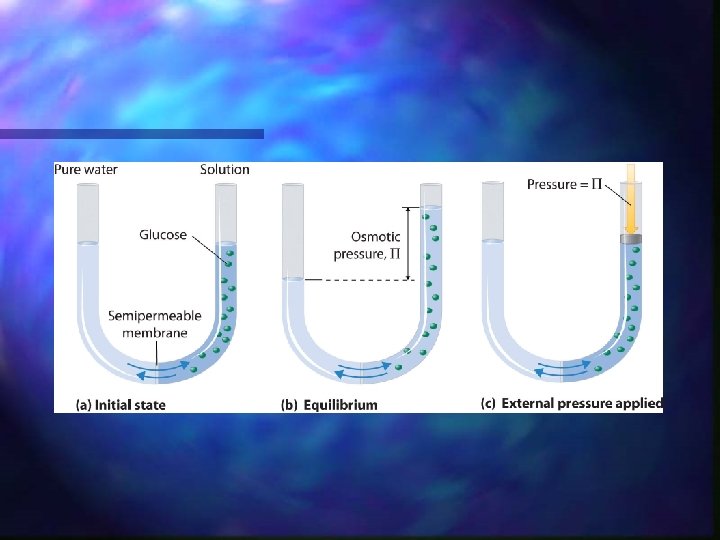
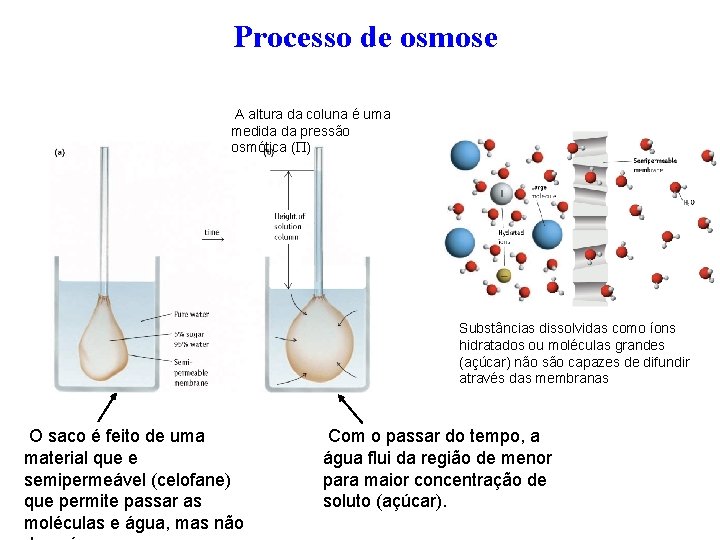
Processo de osmose A altura da coluna é uma medida da pressão osmótica ( ) Substâncias dissolvidas como íons hidratados ou moléculas grandes (açúcar) não são capazes de difundir através das membranas O saco é feito de uma material que e semipermeável (celofane) que permite passar as moléculas e água, mas não Com o passar do tempo, a água flui da região de menor para maior concentração de soluto (açúcar).
 Misturas coloidais
Misturas coloidais What is 1805 military time
What is 1805 military time 1773-1805
1773-1805 Afi 31-204
Afi 31-204 Balladen weimarer klassik merkmale
Balladen weimarer klassik merkmale The passage of gas under pressure through a tiny opening
The passage of gas under pressure through a tiny opening Scoperta dna 1869
Scoperta dna 1869 Portrait of lydia
Portrait of lydia The mendeleev lab of 1869 answer key
The mendeleev lab of 1869 answer key In 1869, dmitri ivanovich mendeléev
In 1869, dmitri ivanovich mendeléev Rīgas latviešu biedrība dibināta
Rīgas latviešu biedrība dibināta October 2, 1869
October 2, 1869 October 2, 1869
October 2, 1869 When was henri matisse born and died
When was henri matisse born and died Ernst haeckel 1869
Ernst haeckel 1869 Coloides
Coloides Osmosis
Osmosis Coloide y cristaloide
Coloide y cristaloide Agua mineral disoluciones coloides y suspensiones
Agua mineral disoluciones coloides y suspensiones Factor goteo
Factor goteo Tipos de coloides
Tipos de coloides Soluciones y coloides
Soluciones y coloides Isofundina
Isofundina Coloides
Coloides Coloides e suspensões
Coloides e suspensões Tipos de coloides
Tipos de coloides Coloides
Coloides Efeito tyndall
Efeito tyndall Suspensiones
Suspensiones 10 coloides
10 coloides Forensic anthropologist vs forensic pathologist
Forensic anthropologist vs forensic pathologist Graham laitt
Graham laitt Graham tyrer
Graham tyrer Graham choo
Graham choo Multiplication fact
Multiplication fact Graham crow
Graham crow Boyle's law examples
Boyle's law examples Mary graham colegio
Mary graham colegio Alexander graham bell
Alexander graham bell Kathryn graham alberta innovates
Kathryn graham alberta innovates Proses kreasi
Proses kreasi Carson graham summer school
Carson graham summer school Mark graham conductor
Mark graham conductor Graham vs connor
Graham vs connor Ashrey d graham
Ashrey d graham Graham parton
Graham parton Graham's number
Graham's number Journey without maps graham greene
Journey without maps graham greene Graham jenkinson
Graham jenkinson Graham-denning model
Graham-denning model Graham triggs
Graham triggs Graham
Graham Who wrote the destructors
Who wrote the destructors Bette nesmith graham family
Bette nesmith graham family Control system design graham goodwin
Control system design graham goodwin Graham denning model
Graham denning model Graham proctor
Graham proctor Graham gal
Graham gal