CHO MNG QU THY C V THM LP


















- Slides: 32

CHÀO MỪNG QUÝ THẦY CÔ VỀ THĂM LỚP 10 A Thân chào các em học sinh lớp 10


NỘI DUNG BÀI A. OXI I. Vị trí và cấu tạo II. Tính chất vật lí III. Tính chất hóa học IV. Ứng dụng V. Điều chế B. OZON I. Tính chất II. Ozon trong tự nhiên III. Ứng dụng C. LƯU HUỲNH I. Vị trí và cấu tạo II. Tính chất vật lí III. Tính chất hóa học

A. OXI (Hướng dẫn tự học) � I. VỊ TRÍ VÀ CẤU TẠO: - Tìm hiểu về vị trí, cấu hình electron, CTPT, CTCT? � II. TÍNH CHẤT VẬT LÍ - Tìm hiểu về trạng thái, màu sắc, mùi vị, nặng hay nhẹ hơn không khí, khả năng tan trong nước, to hóa lỏng, . . � III. TÍNH CHẤT HOÁ HỌC - Tính chất hóa học cơ bản và viết phương trình minh họa? � IV. ỨNG DỤNG � V. ĐIỀU CHẾ - Trong PTN và trong CN oxi được điều chế như thế nào?

B. OZON - Ozon là dạng thù hình của oxi - Công thức phân tử: O 3 I. Tính chất của ozon 1. Tính chất vật lí - Là chất khí, có màu xanh nhạt, mùi đặc trưng Em hãy cho biết một số tính chất 0 C ozon? - Hóa lỏng ởvật -112 lí của - Tan trong nước nhiều hơn oxi

2. Tính chất hóa học - Ozon có tính oxi hóa rất mạnh và mạnh hơn oxi - Ozon oxi hóa hầu hết các kim loại (trừ Au, Pt), nhiều phi kim và hợp chất vô cơ, hữu cơ - Ở điều kiện thường, O 2 không oxi hóa được Ag, nhưng O 3 oxi hóa Ag thành Ag 2 O: Ag + O 2 không phản ứng 2 Ag + O 3 Ag 2 O + O 2 - Ozon chỉ thể hiện tính oxi hóa.

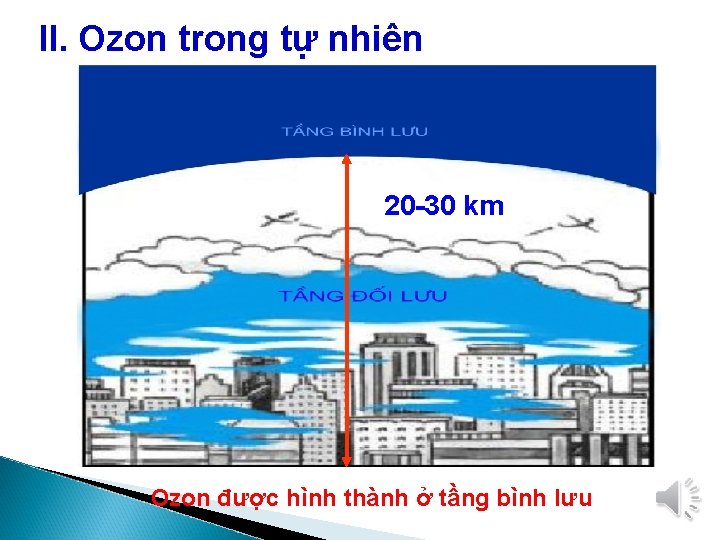
II. Ozon trong tự nhiên 20 -30 km Ozon được hình thành ở tầng bình lưu

Hình thành trong khí quyển khi có sự phóng điện Tầng ozon được hình thành do tia tử ngoại của Mặt trời chuyển hóa các phân tử oxi thành ozon 3 O 2 Tia tử ngoại 2 O 3

Trên mặt đất, ozon được sinh ra do sự oxi hóa một số chất hữu cơ (nhựa thông, rong biển)

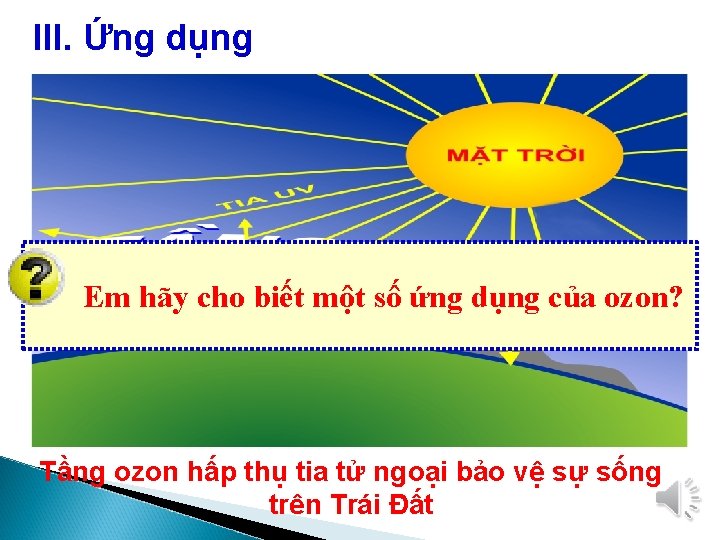
III. Ứng dụng Em hãy cho biết một số ứng dụng của ozon? Tầng ozon hấp thụ tia tử ngoại bảo vệ sự sống trên Trái Đất

Chữa sâu răng Tẩy trùng nước sinh hoạt Tẩy trắng tinh bột Tẩy trắng dầu ăn

Làm sạch không khí Làm sạch hồ nước

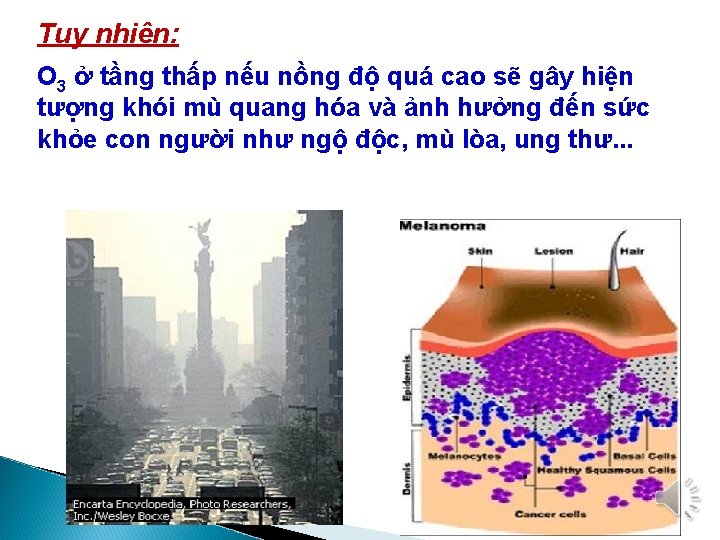
Tuy nhiên: O 3 ở tầng thấp nếu nồng độ quá cao sẽ gây hiện tượng khói mù quang hóa và ảnh hưởng đến sức khỏe con người như ngộ độc, mù lòa, ung thư. . .

Hiện nay: Một số nơi tầng ozon bị thủng do ô nhiễm môi trường, hoá chất: CFC, NOx , các Hidrocacbon. . . Chúng ta bảo vệ tầng ozon là bảo vệ chính mình

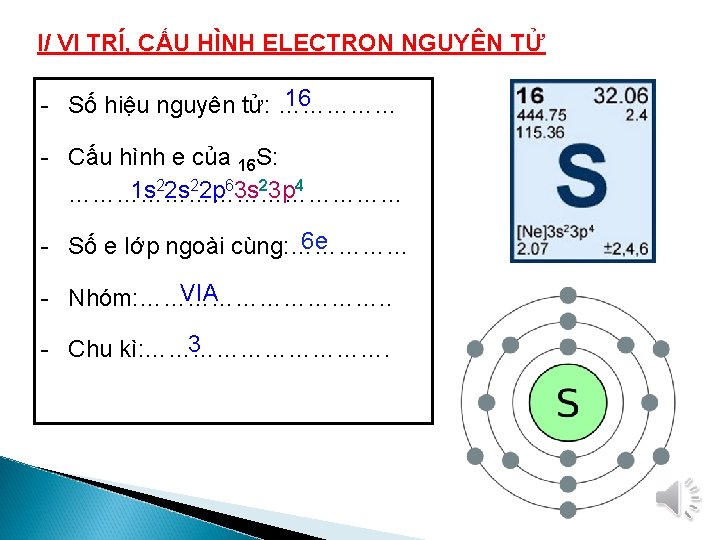
C. LƯU HUỲNH



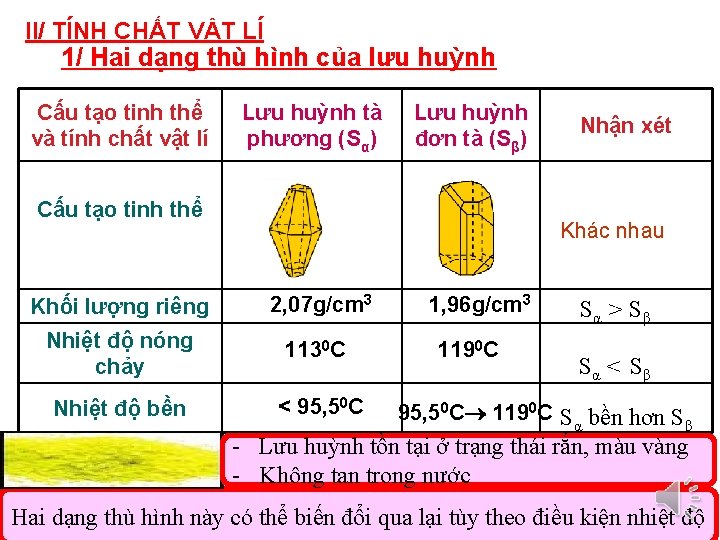
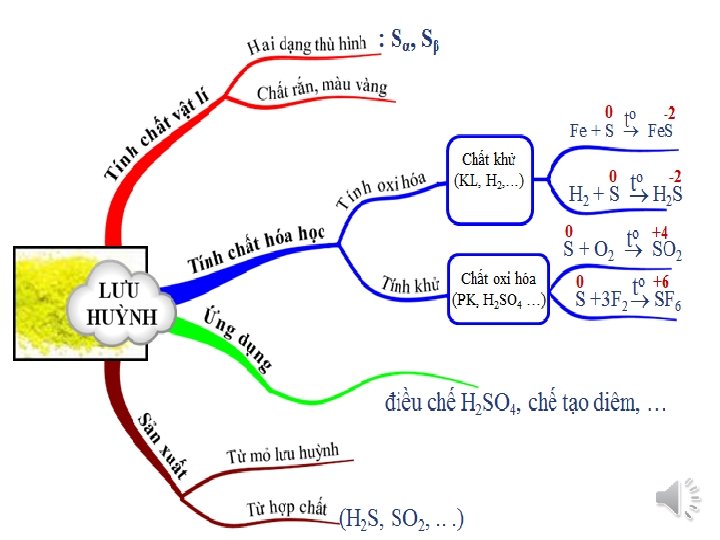
II/ TÍNH CHẤT VẬT LÍ 1/ Hai dạng thù hình của lưu huỳnh Cấu tạo tinh thể và tính chất vật lí Lưu huỳnh tà phương (Sα) Lưu huỳnh đơn tà (Sβ) Cấu tạo tinh thể Nhận xét Khác nhau Khối lượng riêng 2, 07 g/cm 3 Nhiệt độ nóng chảy 1130 C Nhiệt độ bền < 95, 50 C 1, 96 g/cm 3 1190 C Sα > Sβ Sα < Sβ 95, 50 C 1190 C S bền hơn S α β - Lưu huỳnh tồn tại ở trạng thái rắn, màu vàng - Không tan trong nước Hai dạng thù hình này có thể biến đổi qua lại tùy theo điều kiện nhiệt độ

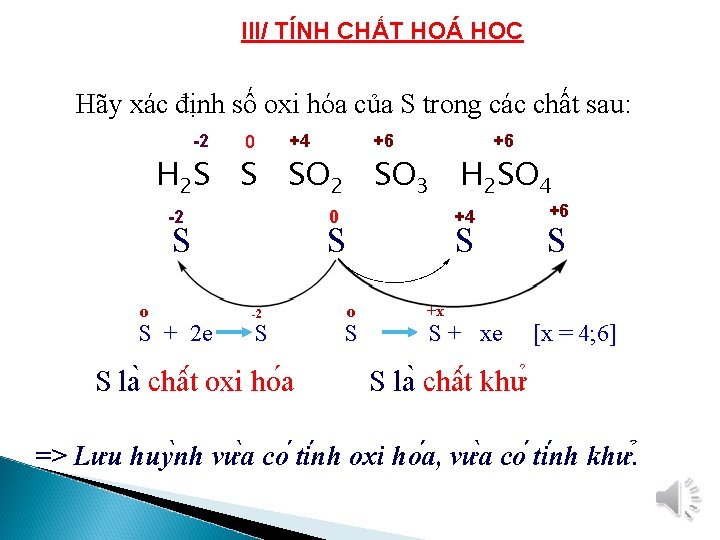
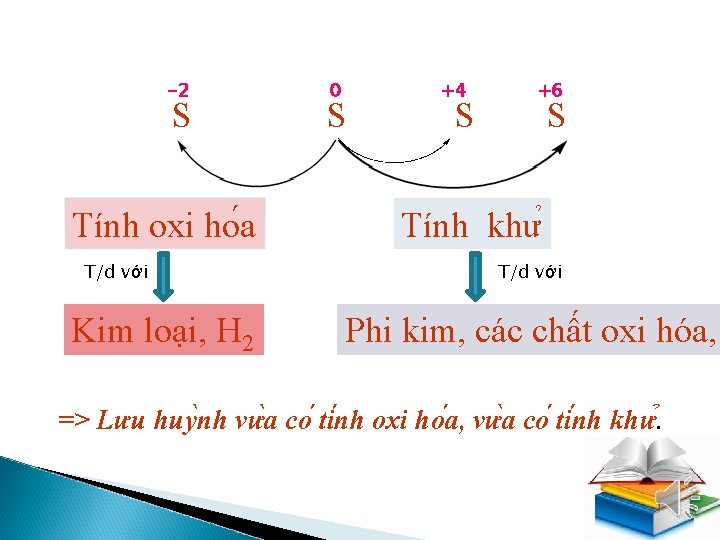
III/ TÍNH CHẤT HOÁ HỌC Hãy xác định số oxi hóa của S trong các chất sau: -2 0 +4 +6 +6 H 2 S S SO 2 SO 3 H 2 SO 4 -2 0 S o S + 2 e +4 S -2 S S la châ t oxi ho a S o S +6 S +x S + xe [x = 4; 6] S la châ t khư => Lưu huy nh vư a co ti nh oxi ho a, vư a co ti nh khư.

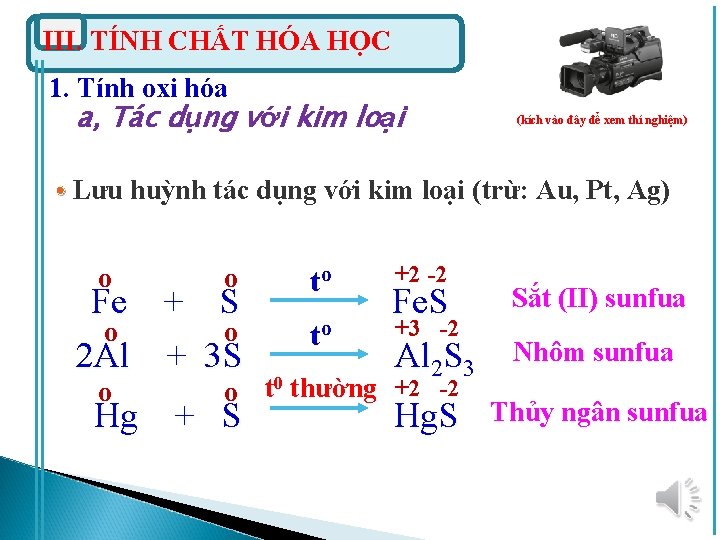
III. TÍNH CHẤT HÓA HỌC 1. Tính oxi hóa a, Tác dụng với kim loại (kích vào đây để xem thí nghiệm) • Lưu huỳnh tác dụng với kim loại (trừ: Au, Pt, Ag) o o Fe + S o o 2 Al + 3 S o to to +2 -2 Fe. S +3 -2 Al 2 S 3 Sắt (II) sunfua Hg. S Thủy ngân sunfua o t 0 thường +2 -2 Hg + S Nhôm sunfua

=> Dùng S để thu hồi thủy ngân rơi vãi

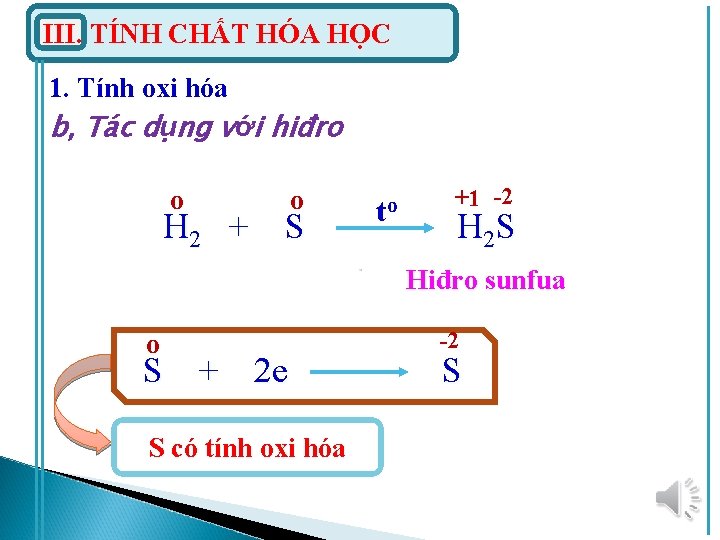
III. TÍNH CHẤT HÓA HỌC 1. Tính oxi hóa b, Tác dụng với hiđro o o H 2 + S to +1 -2 H 2 S Hiđro sunfua o S + 2 e S có tính oxi hóa -2 S

III. TÍNH CHẤT HÓA HỌC 2. Tính khử (kích vào đây để xem thí nghiệm)

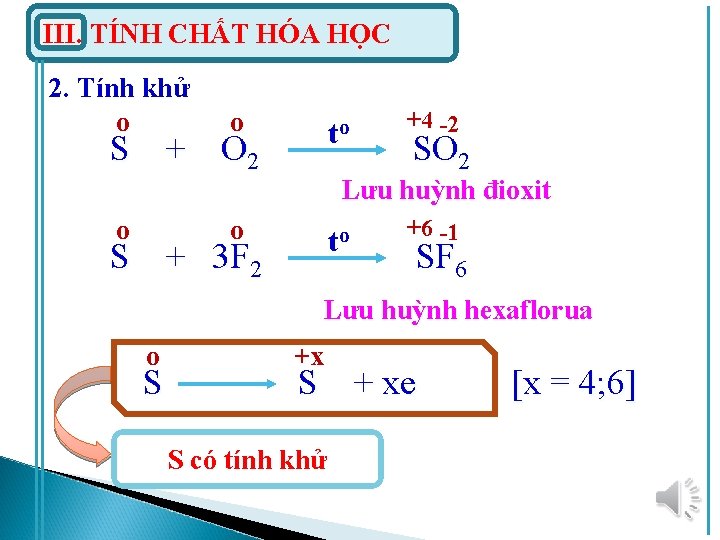
III. TÍNH CHẤT HÓA HỌC 2. Tính khử o o S + O 2 to o to +4 -2 SO 2 Lưu huỳnh đioxit o S + 3 F 2 +6 -1 SF 6 Lưu huỳnh hexaflorua o S +x S + xe S có tính khử [x = 4; 6]

-2 S Tính oxi ho a T/d với Kim loại, H 2 0 S +4 S +6 S Tính khư T/d với Phi kim, các chất oxi hóa, . => Lưu huy nh vư a co ti nh oxi ho a, vư a co ti nh khư.

IV. ỨNG DỤNG CỦA LƯU HUỲNH V. TRẠNG THÁI TỰ NHIÊN VÀ SẢN XUẤT


V. Bài tập củng cố. Câu 1: Phát biểu nào sau đây diễn tả đúng tính chất hóa học của lưu huỳnh? A Lưu huỳnh chỉ có tính oxi hóa. B Lưu huỳnh chỉ có tính khử. C Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử. Lưu huỳnh không có tính oxi hóa và không có tính khử. D

BÀI TẬP CỦNG CỐ Câu 2: Dãy đơn chất nào sau đây vừa có tính khử, vừa có tính oxi hóa? A. Cl 2, O 3 , S. B. S, Cl 2, Br 2. C. O 2, F 2, S. D. Br 2, O 3, I 2.

BÀI TẬP CỦNG CỐ Câu 3: Ở điều kiện thường, X là chất khí có màu xanh nhạt, có mùi đặc trưng. Vậy khí X là A. Cl 2. B. SO 2. C. O 3. D. H 2 S.

Câu 4: Đun nóng một hỗn hợp gồm có 0, 81 g bột nhôm và 0, 96 g bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng, người ta thu được chất nào trong ống nghiệm và khối lượng là bao nhiêu? A. Al 2 S 3: 1, 5 (g). B. Al: 0, 27 (g); Al 2 S 3: 1, 5 (g). C. Al: 0, 54 (g); Al 2 S 3: 1, 5 (g). D. S: 0, 32 (g).

VII. BÀI TẬP VỀ NHÀ • SGK : trang 127 và 132 • Chuẩn bị bài HIDRO SUNFUA