CHEMISTRY DEPT Add your company slogan Alkaline Earth



![STRUKTUR ELEKTRON UNSUR SIMBOL BERILIUM Be STRUKTUR ELEKTRON [He] 2 s 2 MAGNESIUM Mg STRUKTUR ELEKTRON UNSUR SIMBOL BERILIUM Be STRUKTUR ELEKTRON [He] 2 s 2 MAGNESIUM Mg](https://slidetodoc.com/presentation_image/4dbf84787a71b23365d6fcb6ec488378/image-4.jpg)



















![KOMPLEKS GOL IIA § PEMBENTUKAN [Be. F 4]2 AWAL 1 s 2 s 2 KOMPLEKS GOL IIA § PEMBENTUKAN [Be. F 4]2 AWAL 1 s 2 s 2](https://slidetodoc.com/presentation_image/4dbf84787a71b23365d6fcb6ec488378/image-28.jpg)
![§ PEMBENTUKAN [Be(H 2 O)4]2+ 1 s 2 s 2 p AWAL Be 2+ § PEMBENTUKAN [Be(H 2 O)4]2+ 1 s 2 s 2 p AWAL Be 2+](https://slidetodoc.com/presentation_image/4dbf84787a71b23365d6fcb6ec488378/image-29.jpg)







- Slides: 40

CHEMISTRY DEPT. “ Add your company slogan ” Alkaline Earth kusumawatikimia@yahoo. com LOGO


The Alkaline Earth elements 1 Beryllium 2 Magnesium 3 Calcium 4 Strontium 3 Barium 4 Radium
![STRUKTUR ELEKTRON UNSUR SIMBOL BERILIUM Be STRUKTUR ELEKTRON He 2 s 2 MAGNESIUM Mg STRUKTUR ELEKTRON UNSUR SIMBOL BERILIUM Be STRUKTUR ELEKTRON [He] 2 s 2 MAGNESIUM Mg](https://slidetodoc.com/presentation_image/4dbf84787a71b23365d6fcb6ec488378/image-4.jpg)
STRUKTUR ELEKTRON UNSUR SIMBOL BERILIUM Be STRUKTUR ELEKTRON [He] 2 s 2 MAGNESIUM Mg [Ne) 3 s 2 KALSIUM Ca [Ar] 4 s 2 STRONSIUM Sr [Kr) 5 s 2 BARIUM Ba [Xe] 6 s 2 RADIUM Ra [Rn] 7 s 2

LOGAM ALKALI TANAH § Kereaktifanya di bawah alkali § Dengan 2 el. Valensi (ns-2) mudah melepas elektron membentuk tingkat oksidasi +2 § Pada suhu kamar berwujud padat § Berwarna putih perak kecuali berilium berwarna abu-abu § Dalam senyawa di alam tidak mudah larut di dalam tanah

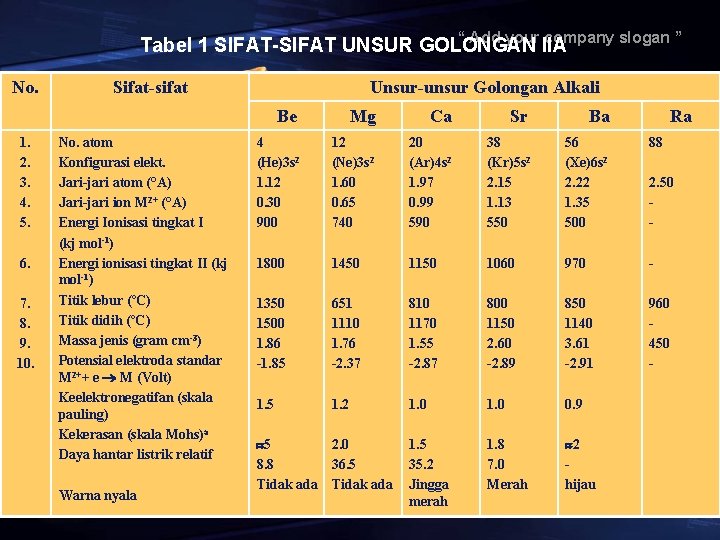
“ Add your company slogan ” Tabel 1 SIFAT-SIFAT UNSUR GOLONGAN IIA No. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Sifat-sifat No. atom Konfigurasi elekt. Jari-jari atom (°A) Jari-jari ion M 2+ (°A) Energi Ionisasi tingkat I (kj mol-1) Energi ionisasi tingkat II (kj mol-1) Titik lebur (ºC) Titik didih (ºC) Massa jenis (gram cm-3) Potensial elektroda standar M 2++ e M (Volt) Keelektronegatifan (skala pauling) Kekerasan (skala Mohs)a Daya hantar listrik relatif Warna nyala Unsur-unsur Golongan Alkali Be Mg Ca Sr Ba 4 (He)3 s 2 1. 12 0. 30 900 12 (Ne)3 s 2 1. 60 0. 65 740 20 (Ar)4 s 2 1. 97 0. 99 590 38 (Kr)5 s 2 2. 15 1. 13 550 56 (Xe)6 s 2 2. 22 1. 35 500 88 1800 1450 1150 1060 970 - 1350 1500 1. 86 -1. 85 651 1110 1. 76 -2. 37 810 1170 1. 55 -2. 87 800 1150 2. 60 -2. 89 850 1140 3. 61 -2. 91 960 450 - 1. 5 1. 2 1. 0 0. 9 1. 5 35. 2 Jingga merah 1. 8 7. 0 Merah 2 hijau 5 2. 0 8. 8 36. 5 Tidak ada Ra 2. 50 - LOGO

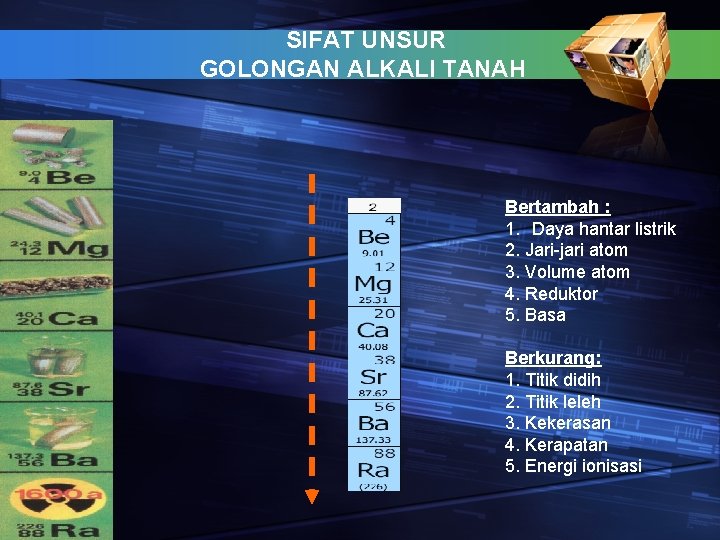
SIFAT UNSUR GOLONGAN ALKALI TANAH Bertambah : 1. Daya hantar listrik 2. Jari-jari atom 3. Volume atom 4. Reduktor 5. Basa Berkurang: 1. Titik didih 2. Titik leleh 3. Kekerasan 4. Kerapatan 5. Energi ionisasi

UNSUR KELIMPAHAN SUMBER Be 0, 0006 % kerak bumi Beryl, Be 3 Al 2(Si. O 3)6. Berynolit, Na. Be. PO 4. Krysoberyl, Be(Al. O 2)2. Bertrandit, 4 Be. O. 2 Si. O 2 Mg 1, 369 x 106 tonmetrik/km 3 air laut 2, 24 % litosfer 0, 14 % hidrosfer 2 % kulit bumi Dolomit, Mg. CO 3. Ca. CO 3. Karnalit, KCl. Mg. Cl 2. 6 H 2 O. Brucit, Mg(OH)2. Kiesenit, Mg. SO 4. H 2 O. Langbeinit, K 2 SO 4. 2 Mg. SO 4. Garam inggris, Mg. SO 4. 7 H 2 O. Magnesit, Mg. CO 3, Asbestos, H 4 Mg 3 Si 2 O 9. Merschaum, Mg 2 Si 3 O 8. 2 H 2 O. Talk, Mg 3(Si 4 O 10)(OH)2 Ca 406 x 103 tonmetrik/km 3 air laut 3, 6 % kerak bumi Batu kapur/pualam, Ca. CO 3. Batu tahu/gips, Ca. SO 4. 2 H 2 O. ACP, Ca. HPO 4. Sr 8 x 103 tonmetrik/km 3 air laut Kalsit dan aragonit. Strontianit, Sr. CO 3. Galestin, Sr. SO 4. Ba 28 tonmetrik/km 3 air laut Barit, Ba. SO 4. Witherit, Ba. CO 3. Ra 0, 08 % kerak bumi Bijih uranium, pitchblende

UKURAN ATOM DAN ION ØAtom Dan Ion Gol Iia Besar Namun Lebih Kecil daripada Gol IA ØDensitas Besar Namun Lebih Kecil daripada Gol IA ØAda Dua Elektron Yg Terlibat Dlm Ikatan Logam Shg Energi Kohesif, Ttk Leleh Dan Ttk Didih Lebih Tinggi daripada Gol IA ØTtk Leleh Tdk Menurun Secara Teratur Dari Atas Ke Bawah Krn Struktur Kristal Logam Berbeda § Relativ atomic sizes of the representative elements

Energi ionisasi Ø ENERGI IONISASI KETIGA DEMIKIAN TINGGI SHG TDK MUNGKIN TERBENTUK ION M+3 Ø ENERGI IONISASI Be +2 TINGGI SHG SENYAWANYA BERTIPE KOVALEN Ø Mg JUGA MEMBENTUK BEBERAPA SENYAWA KOVALEN, NAMUN DEMIKIAN SENYAWA-SENYAWA YG DIBENTUK OLEH Mg, Ca, Sr, DAN Ba DOMINAN IONIK

WARNA NYALA LOGAM ALKALI TANAH

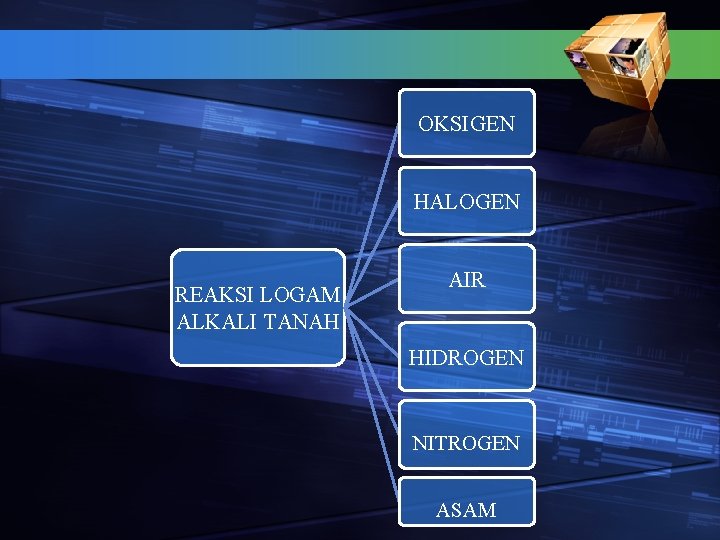
OKSIGEN HALOGEN REAKSI LOGAM ALKALI TANAH AIR HIDROGEN NITROGEN ASAM

Reaksi dengan oksigen Logam alkali bereaksi dengan oksigen membentuk : 2 M(S) + O 2(g) 2 MO(S) M(s) + O 2(g) MO 2 (S) M = Unsur alkali tanah Be & Mg dipanaskan logam Ba bereaksi dengan mudah, Sr berekasi pada tekanan tinggi, Ca. O 2 tidak berbentuk secara bereaksi langsung

Reaksi dengan Halogen Logam alkali tanah bereaksi hebat dengan halogen menghasilkan garam halida. Reaksinya: M(S) + X 2(g) MX 2(S) X = F Cl, Br, I, & At

Reaksi dengan Hidrogen Reaksinya : M(s) + H 2(g) MH 2(aq) harus dipanaskan Be & Mg tidak bereaksi

Reaksi dengan Nitrogen Bereaksi dengan Nitrogen Reaksi: 3 M + 2 N M 3 N 2

Peroksida logam alkali bereaksi dengan CO 2 menghasilkan oksigen Reaksinya : 2 M 2 O 2(s) + 2 CO 2(g) M 2 CO 3(S) + O 2 (g) M= Li dan Na

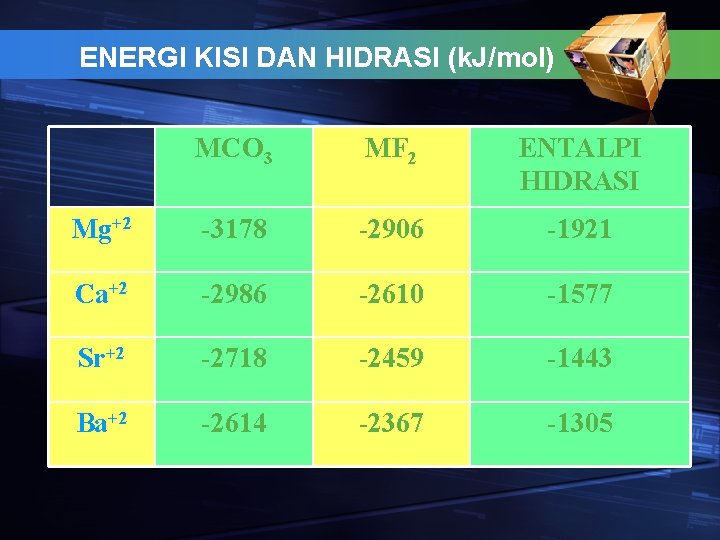
KELARUTAN DAN ENERGI KISI § Kelarutan kebanyakan garam menurun seiring dgn meningkatnya berat atom, namun berlawanan utk garam-garam fluorida dan hidroksida. § Kelarutan bergantung pada energi kisi padatan, dan energi hidrasi ion § § Energi kisi turun, kelarutan naik § Energi hidrasi turun, kelarutan turun

KELARUTAN DAN ENERGI KISI Energi kisi maupun energi hidrasi turun seiring bertambahnya ukuran logam Kebanyakan senyawa, dari atas ke bawah dlm satu golongan, energi hidrasi menurun lebih cepat drp energi kisi shg senyawanya makin kurang larut. Namun pada fluorida dan hidroksidanya, energi kisi turun lebih cepat drpd energi hidrasi shg kelarutannya meningkat dari atas ke bawah

ENERGI KISI DAN HIDRASI (k. J/mol) MCO 3 MF 2 ENTALPI HIDRASI Mg+2 -3178 -2906 -1921 Ca+2 -2986 -2610 -1577 Sr+2 -2718 -2459 -1443 Ba+2 -2614 -2367 -1305

REAKSI DGN AIR § Be BEREAKSI DGN UAP AIR MEMBENTUK Be. O ATAU TIDAK BEREAKSI SAMA SEKALI § Ca, Sr DAN Ba CUKUP MUDAH BEREAKSI DGN AIR DINGIN MENGHASILKAN HIDROKSIDA DAN H 2. § Mg TDK BEREAKSI DGN AIR DINGIN TETAPI DAPAT MENGURAIKAN DGN AIR PANAS Mg + 2 H 2 O Mg(OH)2 + H 2 ATAU Mg + H 2 O Mg. O + H 2

HIDROKSIDA GOL IIA Be(OH)2 AMFOTER, LAINNYA BASA LARUTAN Ca(OH)2 (AIR KAPUR) DAN Ba(OH)2 (AIR BARITA) DPT MENJADI KERUH BILA DITIUPKAN GAS CO 2 KARENA TERBENTUK ENDAPAN PUTIH Ca. CO 3 ATAU Ba. CO 3. BILA DITIUPKA CO 2 BERLEBIH MAKA KEKERUHAN AKAN HILANG KRN TERBENTUK KALSIUMBIKARBONAT. Ca(OH)2 + CO 2 Ca. CO 3 + H 2 O Ca(HCO 3)2 TDK LARUT ENDAPAN PUTIH LARUT

§ BIKARBONAT GOL IIA TDK STABIL. § GUA DI DAERAH BATU KAPUR SERING TUMBUH STALAGTIT DAN STALAGMIT. PENAPISAN AIR MELEWATI BATU KAPUR YG BANYAK MENGANDUNG LARUTAN KALSIUIM BIKARBONAT. SELANJUTNYA BIKARBONAT YG LARUT TERURAI SECARA PERLAHAN MENJADI KARBONAT YG TDK LARUT DAN INI MENGHASILKAN STALAGTIT DAN STALAGMIT

Air Sadah § Air sadah mengandung garam terlarut seperti karbonat, bikarbonat dan sulfat dari magnesium dan kalsium § Air sadah dengan sabun sulit menghasilkan busa dan buih yang terbentuk tidak larut. § Ion logam Mg 2+ dan Ca 2+ bereaksi dengan ion stearat dari sabun membentuk buih kalsium stearat yg tidak larut sebelum terbentuk busa.

§ Air sadah juga menghasilkan deposit tidak larut dalam pipa air, boillers, dan kettles. § Air sadah sementara mengandung Mg(HCO 3)2 dan Ca(HCO 3)2 § Air sadah sementara dapat dihilangkan dengan pemanasan. § 2 HCO 32 - + CO 2 + H 2 O

§ Air sadah tetap mengandung Mg. SO 4 atau Ca. SO 4. § Air murni dapat diperoleh dengan mendistilasinya atau melewatkannya pada resin penukar ion, yaitu ion Mg 2+ dan Ca 2+ diganti oleh Na+. § Garam sodium tidah mempengaruhi kemampuan pembentukan busa. § Metode penukar ion digunakan secara luas dalam industri

§ Resin penukar ion dapat berupa Na 3 PO 4, Na 4 P 2 O 7, Na 3 P 3 O 10. § Sejumlah besar natrium karbonat digunakan untuk proses lime-soda untuk menghilangkan kesadahannya § Ca. SO 4 + Na 2 CO 3 Ca. CO 3+2 Na 2 SO 4
![KOMPLEKS GOL IIA PEMBENTUKAN Be F 42 AWAL 1 s 2 s 2 KOMPLEKS GOL IIA § PEMBENTUKAN [Be. F 4]2 AWAL 1 s 2 s 2](https://slidetodoc.com/presentation_image/4dbf84787a71b23365d6fcb6ec488378/image-28.jpg)
KOMPLEKS GOL IIA § PEMBENTUKAN [Be. F 4]2 AWAL 1 s 2 s 2 p EKSITASI SHARING WITH F KOORDINASI DARI 2 F-
![PEMBENTUKAN BeH 2 O42 1 s 2 s 2 p AWAL Be 2 § PEMBENTUKAN [Be(H 2 O)4]2+ 1 s 2 s 2 p AWAL Be 2+](https://slidetodoc.com/presentation_image/4dbf84787a71b23365d6fcb6ec488378/image-29.jpg)
§ PEMBENTUKAN [Be(H 2 O)4]2+ 1 s 2 s 2 p AWAL Be 2+ KOORDINASI DARI 4 MOLEKUL H 2 O

BERYLLIUM (Be) GENERAL PROPERTIES ANOMALOUS BEHAVIOUR USES REACTION

UNSUR KELIMPAHAN SUMBER Be 0, 0006 % kerak bumi Beryl, Be 3 Al 2(Si. O 3)6. Berynolit, Na. Be. PO 4. Krysoberyl, Be(Al. O 2)2. Bertrandit, 4 Be. O. 2 Si. O 2 Mg 1, 369 x 106 tonmetrik/km 3 air laut 2, 24 % litosfer 0, 14 % hidrosfer 2 % kulit bumi Dolomit, Mg. CO 3. Ca. CO 3. Karnalit, KCl. Mg. Cl 2. 6 H 2 O. Brucit, Mg(OH)2. Kiesenit, Mg. SO 4. H 2 O. Langbeinit, K 2 SO 4. 2 Mg. SO 4. Garam inggris, Mg. SO 4. 7 H 2 O. Magnesit, Mg. CO 3, Asbestos, H 4 Mg 3 Si 2 O 9. Merschaum, Mg 2 Si 3 O 8. 2 H 2 O. Talk, Mg 3(Si 4 O 10)(OH)2 Ca 406 x 103 tonmetrik/km 3 air laut 3, 6 % kerak bumi Batu kapur/pualam, Ca. CO 3. Batu tahu/gips, Ca. SO 4. 2 H 2 O. ACP, Ca. HPO 4. Sr 8 x 103 tonmetrik/km 3 air laut Kalsit dan aragonit. Strontianit, Sr. CO 3. Galestin, Sr. SO 4. Ba 28 tonmetrik/km 3 air laut Barit, Ba. SO 4. Witherit, Ba. CO 3. Ra 0, 08 % kerak bumi Bijih uranium, pitchblende

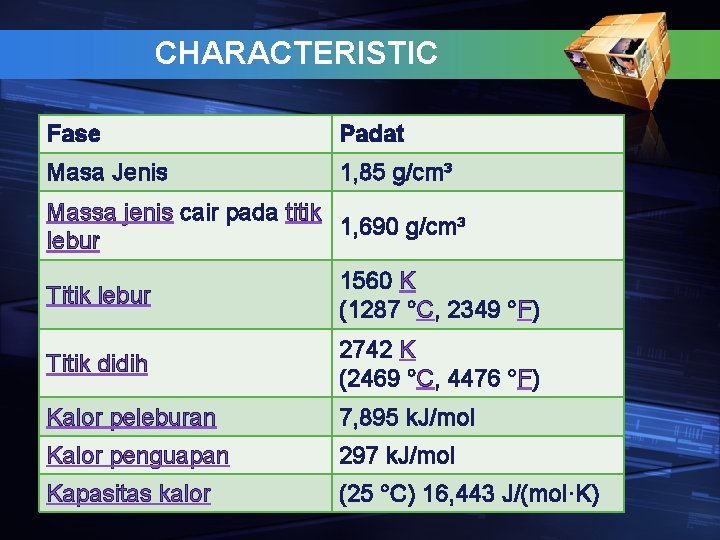
CHARACTERISTIC Fase Padat Masa Jenis 1, 85 g/cm³ Massa jenis cair pada titik 1, 690 g/cm³ lebur Titik lebur 1560 K (1287 °C, 2349 °F) Titik didih 2742 K (2469 °C, 4476 °F) Kalor peleburan 7, 895 k. J/mol Kalor penguapan 297 k. J/mol Kapasitas kalor (25 °C) 16, 443 J/(mol·K)

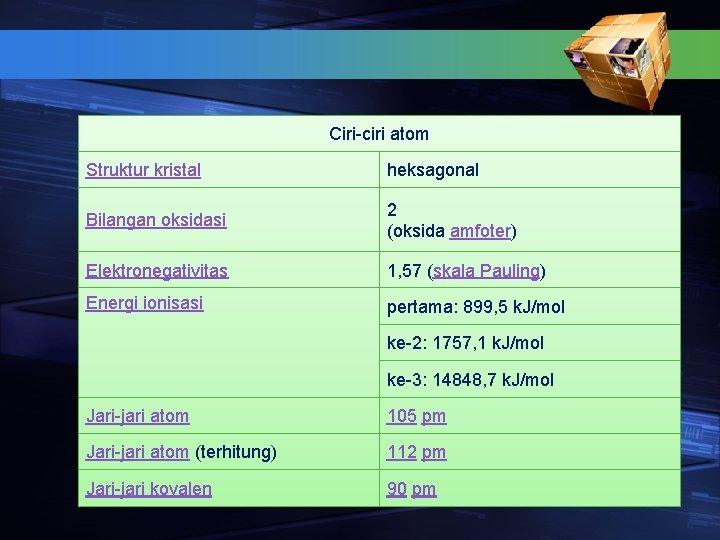
Ciri-ciri atom Struktur kristal heksagonal Bilangan oksidasi 2 (oksida amfoter) Elektronegativitas 1, 57 (skala Pauling) Energi ionisasi pertama: 899, 5 k. J/mol ke-2: 1757, 1 k. J/mol ke-3: 14848, 7 k. J/mol Jari-jari atom 105 pm Jari-jari atom (terhitung) 112 pm Jari-jari kovalen 90 pm

MAGNESIUM (Mg) Sifat Umum Kegunaan Reaksi

CALCIUM (Ca) 1 2 3 SIFAT UMUM KEGUNAAN REAKSI

STRONTIUM (Sr) Sifat umum Kegunaan Reaksi

BARIUM (Ba) Sifat Umum Kegunaan Reaksi

RADIUM (Ra)

T h e E n d

CHEMISTRY DEPT. “ Add your company slogan ” kusumawatikimia@yahoo. com LOGO
 Which group is alkali earth metals
Which group is alkali earth metals Alkaline earth metal family
Alkaline earth metal family Why beryllium not react with water
Why beryllium not react with water Reactive
Reactive Halogens valence electrons
Halogens valence electrons Slogan for kindergarten
Slogan for kindergarten Company slogan here
Company slogan here Click to add titleclick to add subtitle
Click to add titleclick to add subtitle Click to add subtitle
Click to add subtitle Click to add titleclick to add subtitle
Click to add titleclick to add subtitle Company slogan here
Company slogan here Melaleuca to amway
Melaleuca to amway Let's make things better slogan
Let's make things better slogan Company slogan here
Company slogan here Walt disney company culture and values
Walt disney company culture and values Walt disney company slogan
Walt disney company slogan Collagen seeding theory
Collagen seeding theory Staining methods
Staining methods Cytochemical stains for leukemia ppt
Cytochemical stains for leukemia ppt Alkaline phosphatase: normal range by age
Alkaline phosphatase: normal range by age Redox reaction in alkaline medium
Redox reaction in alkaline medium Redox reaction in alkaline medium
Redox reaction in alkaline medium Endothermic perm
Endothermic perm Alkaline lysis
Alkaline lysis Albumin
Albumin Function of liver
Function of liver Alkaline tonic
Alkaline tonic Increased alp
Increased alp Vollara alkaline water
Vollara alkaline water Alkaline mucus
Alkaline mucus Koh alkaline
Koh alkaline Alcohol is acidic or alkaline
Alcohol is acidic or alkaline Plicae circularis
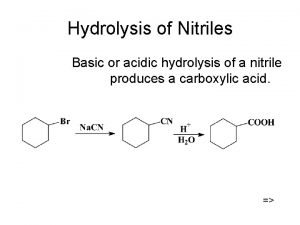
Plicae circularis Hydrolysis of nitriles
Hydrolysis of nitriles Oxidation or reduction
Oxidation or reduction Alcohol is acidic or alkaline
Alcohol is acidic or alkaline Hemosorption vs hemodialysis
Hemosorption vs hemodialysis Alkaline coil cleaner
Alkaline coil cleaner Enzymes used in recombinant dna technology pdf
Enzymes used in recombinant dna technology pdf Where is sperm produced
Where is sperm produced Alkaline fuel cell animation
Alkaline fuel cell animation