Az zon reakcii Carl Dietrich Harries 1866 1923














- Slides: 36

Az ózon reakciói Carl Dietrich Harries (1866 -1923) Az ózon kémiai tulajdonságainak vizsgálata (több mint 100 közlemény) Harries, Staudinger, Rieche Az ózon szerves vegyületekkel végbemenő reakcióinak tanulmányozása. A mechanizmusok felderítése (ciklikus peroxidok létezésének feltételezése) Rudolf Criegee (1902 -1975) Az ózon szerves vegyületekkel végbemenő reakcióinak tanulmányozása. A mechanizmusok felderítése (olefinek ózonlízisének Criegee-féle mechanizmusa. )

Az ózon kémiai tulajdonságai Az ózon szerves vegyületekkel való reakciói során molekulaszerkezetéből kifolyólag szerepelhet 1, 3 -dipólként, elektrofil és nukleofil partnerként. O + O O - O O 4 e- O O Az esetek többségében oxigénatom-transzferrel, vagy közvetlen töltésátmenettel reagál, oldatfázisbeli bimolekuláris reakcióinak sebességi együtthatója széles tartományban (10 -3 – 105 mol-1 dm 3 s-1) mozog. Az esetek jelentős részében (főleg oldat fázisban) nem az ózon, hanem a bomlása során keletkező gyökök reagálnak. Nehéz elkülöníteni a gyökös és nem gyökös folyamatokat.

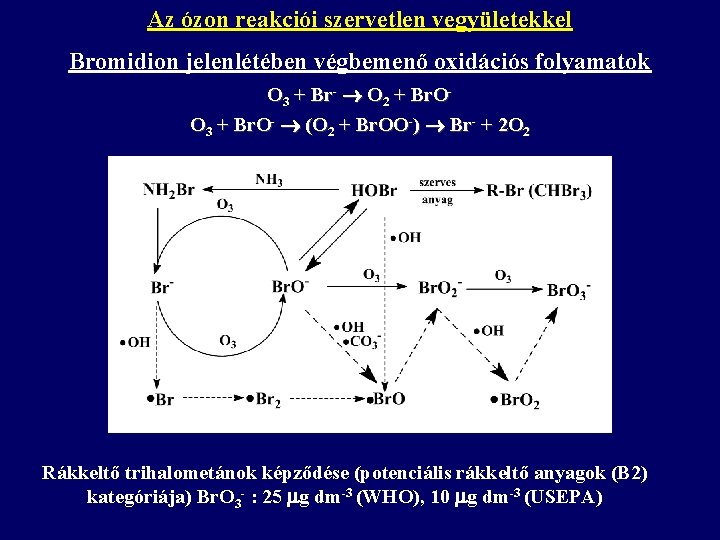
Az ózon reakciói szervetlen vegyületekkel Bromidion jelenlétében végbemenő oxidációs folyamatok O 3 + Br- O 2 + Br. OO 3 + Br. O- (O 2 + Br. OO-) Br- + 2 O 2 Rákkeltő trihalometánok képződése (potenciális rákkeltő anyagok (B 2) kategóriája) Br. O 3 - : 25 g dm-3 (WHO), 10 g dm-3 (USEPA)

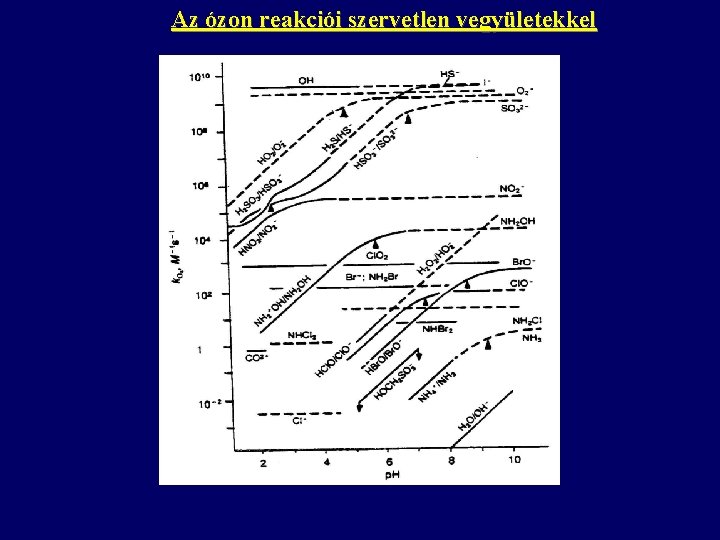
Az ózon reakciói szervetlen vegyületekkel

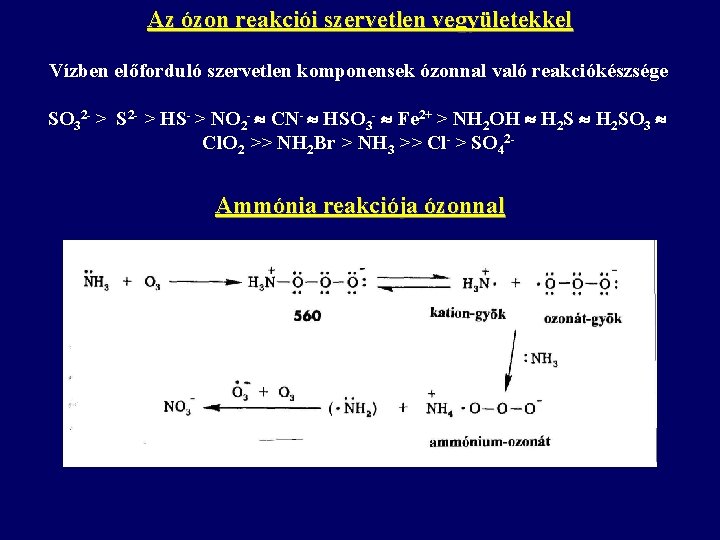
Az ózon reakciói szervetlen vegyületekkel Vízben előforduló szervetlen komponensek ózonnal való reakciókészsége SO 32 - > S 2 - > HS- > NO 2 - CN- HSO 3 - Fe 2+ > NH 2 OH H 2 SO 3 Cl. O 2 >> NH 2 Br > NH 3 >> Cl- > SO 42 - Ammónia reakciója ózonnal

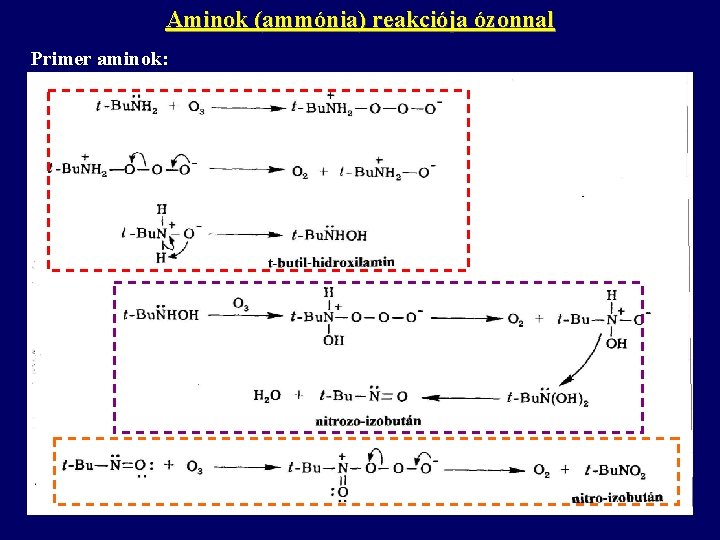
Aminok (ammónia) reakciója ózonnal Primer aminok:

Aminok (ammónia) reakciója ózonnal Abban az esetben, ha az amino-csoporthoz primer alkil-csoport kapcsolódik, lejátszódhat az alkil-oldallánc intramolekuláris oxidációja. Csak protonálatlan (nukleofil) aminocsoport (ammónia) lép reakcióba közvetlenül ózonnal. Reaktivitásuk megközelíti az alkének ózonnal szembeni reaktivitását. Tercier aminok:

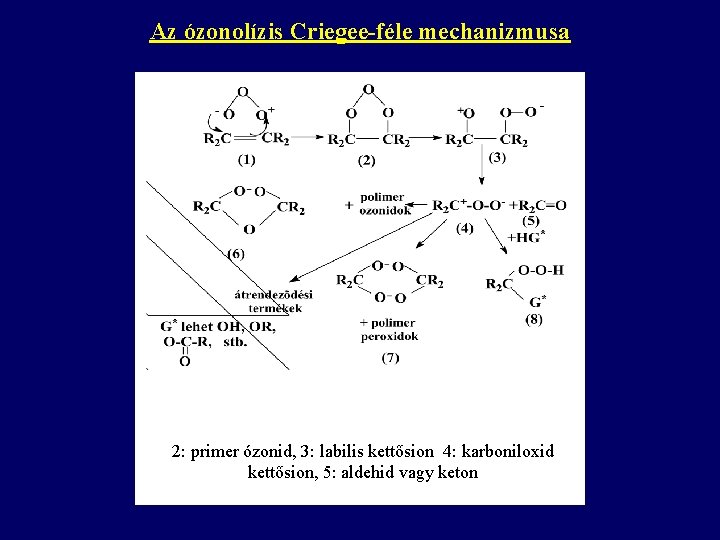
Az ózonolízis Criegee-féle mechanizmusa 2: primer ózonid, 3: labilis kettősion 4: karboniloxid kettősion, 5: aldehid vagy keton

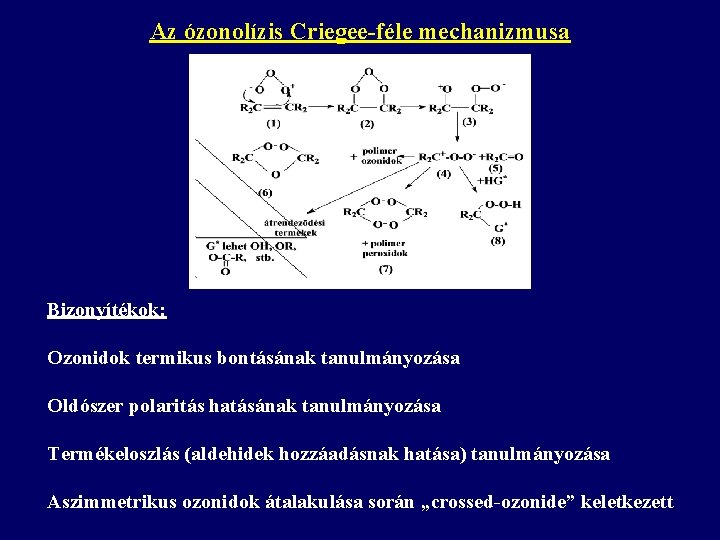
Az ózonolízis Criegee-féle mechanizmusa Bizonyítékok: Ozonidok termikus bontásának tanulmányozása Oldószer polaritás hatásának tanulmányozása Termékeloszlás (aldehidek hozzáadásnak hatása) tanulmányozása Aszimmetrikus ozonidok átalakulása során „crossed-ozonide” keletkezett

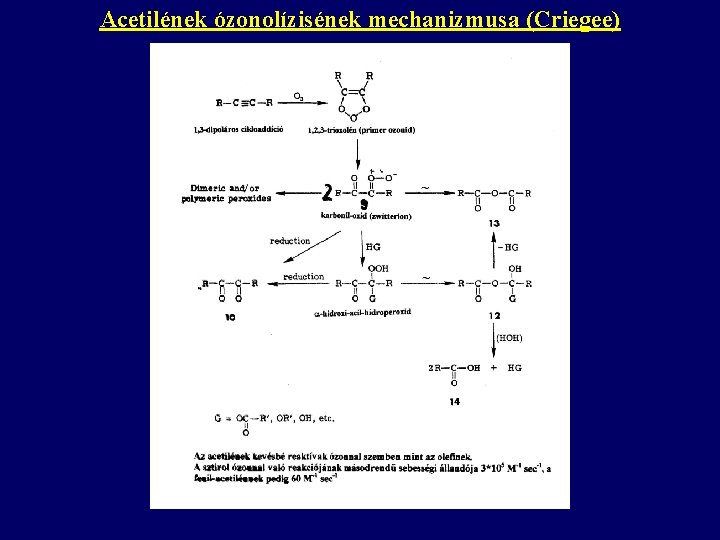
Acetilének ózonolízisének mechanizmusa (Criegee)

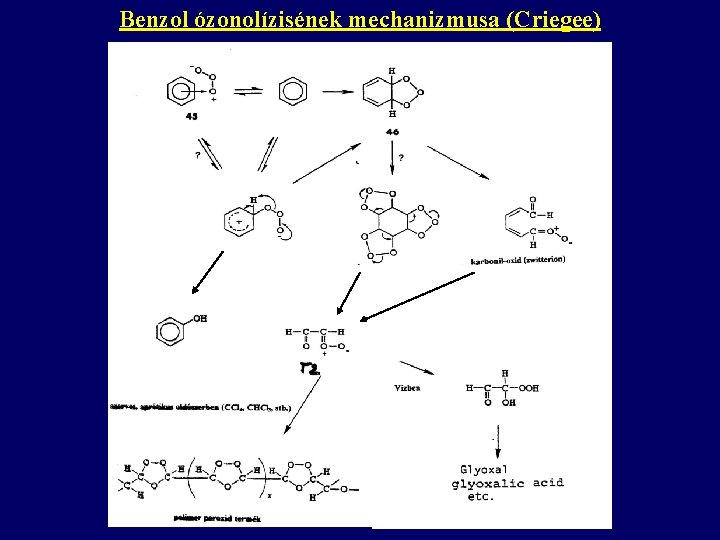
Benzol ózonolízisének mechanizmusa (Criegee)

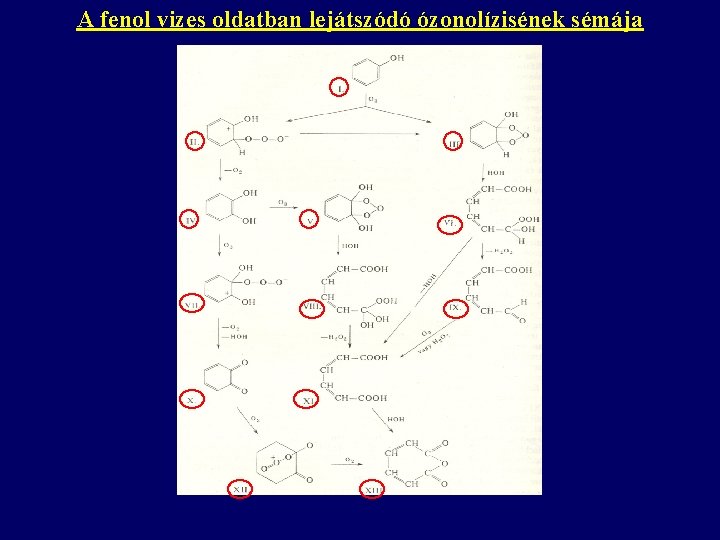
A fenol vizes oldatban lejátszódó ózonolízisének sémája

Ózon hidrogén-absztrakciós reakciói R-H + O 3 = R • + • OH + O 2 Azon vegyületekre jellemző, melyekben a C-H kötés felszakításának energiája a szomszédos csoportok elektronszívó hatásának köszönhetően lecsökken. (aldehidek, savak, aminok) A reakciósebességet jelentősen befolyásolja az absztrahálandó H atom kémiai környezete. hangyasav + ózon k = 5 mol-1 dm 3 s-1 formiátion + ózon k = 100 mol-1 dm 3 s-1 fenol + ózon k = 103 mol-1 dm 3 s-1 fenolát + ózon k = 109 mol-1 dm 3 s-1

Szubsztituens hatása az ózon és a benzol származékok bimolekuláris sebességi együtthatójára (k 0 (benzol+ózon) = 2± 0. 4 M-1 s-1) A szubsztituált benzolok reaktivitása nagymértékben függ a benzolgyűrű szubsztituensétől. Elektronküldő (alkil-, hidroxil-) csoport aktiválja, elektronvonzó (nitro-, halogenid-, karboxil-) csoport dezaktiválja az aromás gyűrűt az ózonnal való reakcióban (elektrofil reagenssel szemben)

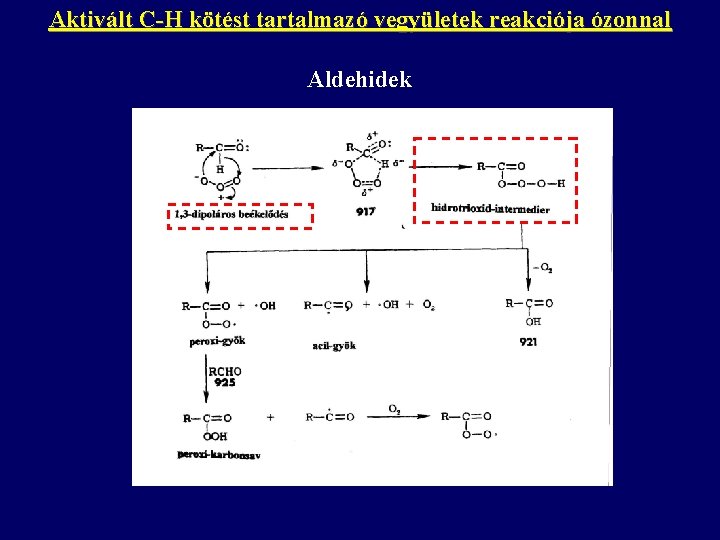
Aktivált C-H kötést tartalmazó vegyületek reakciója ózonnal Aldehidek

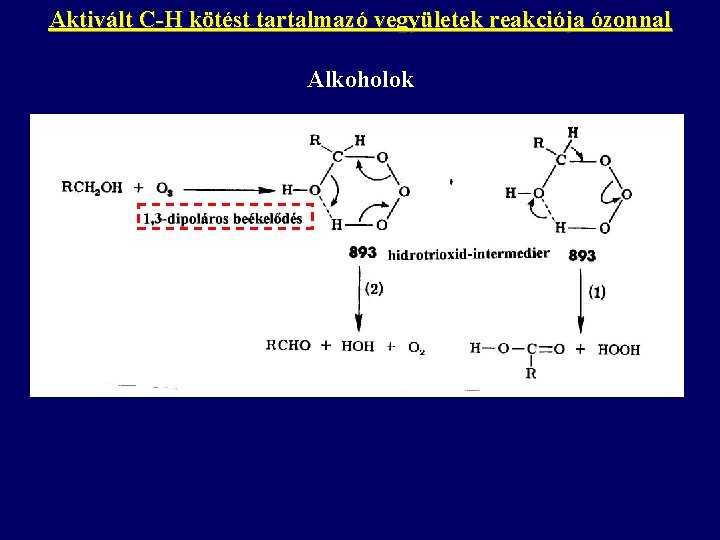
Aktivált C-H kötést tartalmazó vegyületek reakciója ózonnal Alkoholok

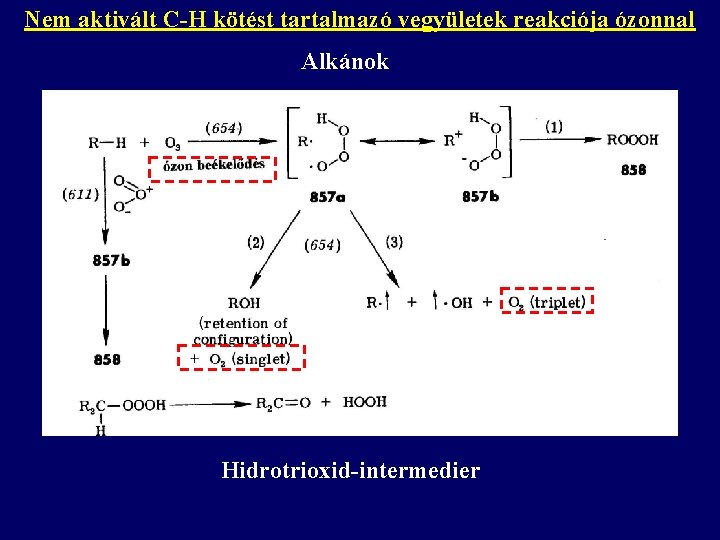
Nem aktivált C-H kötést tartalmazó vegyületek reakciója ózonnal Alkánok Hidrotrioxid-intermedier

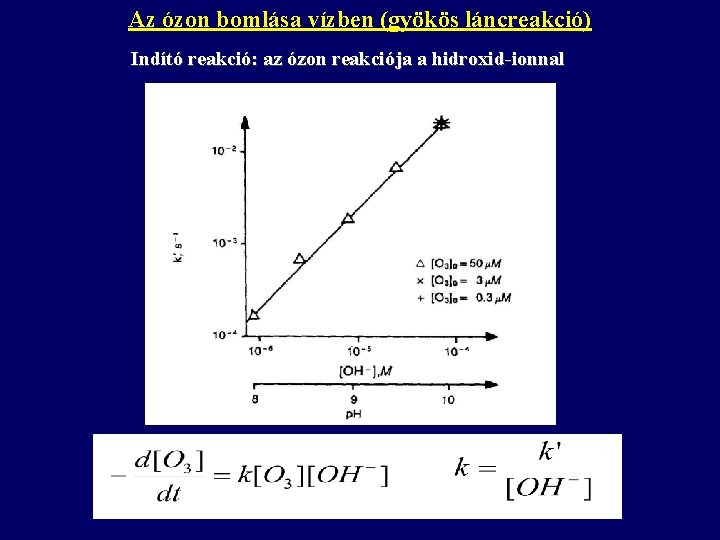
Az ózon bomlása vízben (gyökös láncreakció) Indító reakció: az ózon reakciója a hidroxid-ionnal

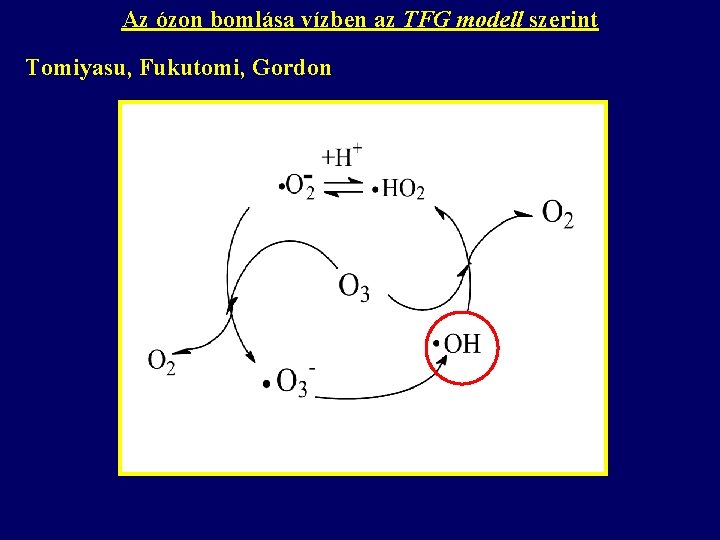
Az ózon bomlása vízben az TFG modell szerint Tomiyasu, Fukutomi, Gordon semleges, lúgos oldatban érvényes a modell Bizonyíték: H 2 O 2 hozzáadása csak p. H>4 esetén (p. K = 11. 65) növeli meg az ózon bomlásának sebességét,

Az ózon bomlása vízben az TFG modell szerint Tomiyasu, Fukutomi, Gordon

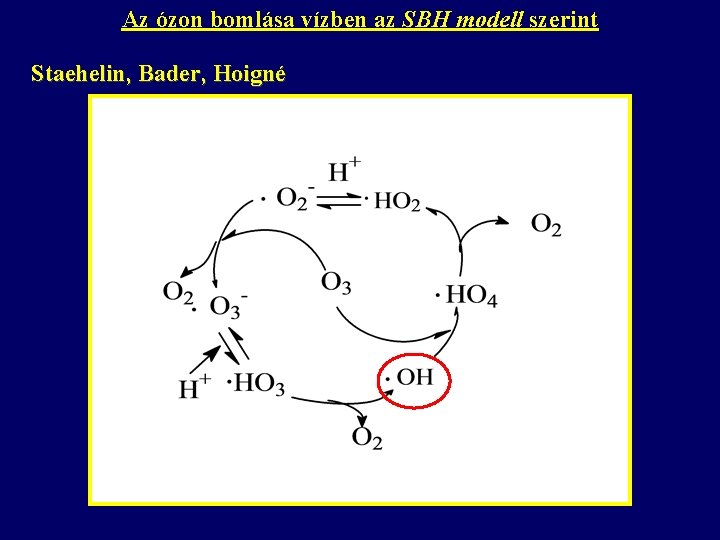
Az ózon bomlása vízben az SBH modell szerint Staehelin, Bader, Hoigné

Az ózon bomlása vízben az SBH modell szerint Staehelin, Bader, Hoigné

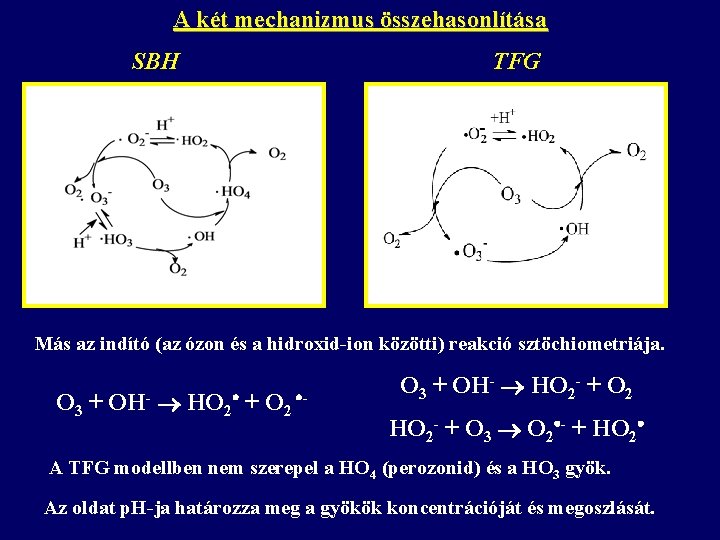
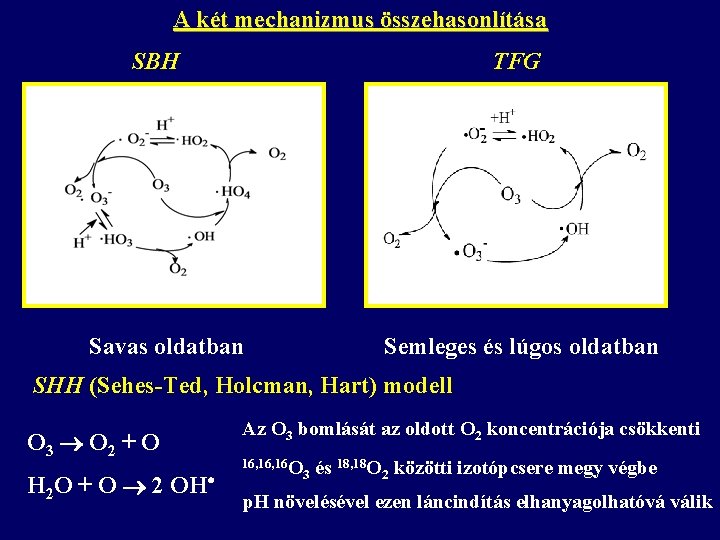
A két mechanizmus összehasonlítása SBH TFG Más az indító (az ózon és a hidroxid-ion közötti) reakció sztöchiometriája. O 3 + OH- HO 2 + O 2 - O 3 + OH- HO 2 - + O 2 HO 2 - + O 3 O 2 - + HO 2 A TFG modellben nem szerepel a HO 4 (perozonid) és a HO 3 gyök. Az oldat p. H-ja határozza meg a gyökök koncentrációját és megoszlását.

A két mechanizmus összehasonlítása SBH TFG Savas oldatban Semleges és lúgos oldatban SHH (Sehes-Ted, Holcman, Hart) modell O 3 O 2 + O H 2 O + O 2 OH Az O 3 bomlását az oldott O 2 koncentrációja csökkenti 16, 16 O 3 és 18, 18 O 2 közötti izotópcsere megy végbe p. H növelésével ezen láncindítás elhanyagolhatóvá válik

Az ózon és a hidroxil-gyök szerves vegyületekkel szembeni reaktivitásának összehasonlítása A hidroxil-gyök reaktívabb és kevésbé szelektív szerves vegyületekkel szemben mint az ózon.

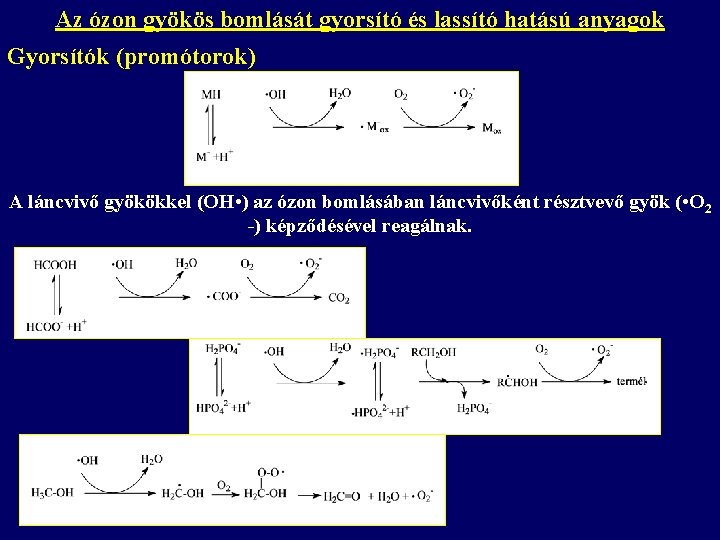
Az ózon gyökös bomlását gyorsító és lassító hatású anyagok Gyorsítók (promótorok) A láncvivő gyökökkel (OH • ) az ózon bomlásában láncvivőként résztvevő gyök ( • O 2 -) képződésével reagálnak.

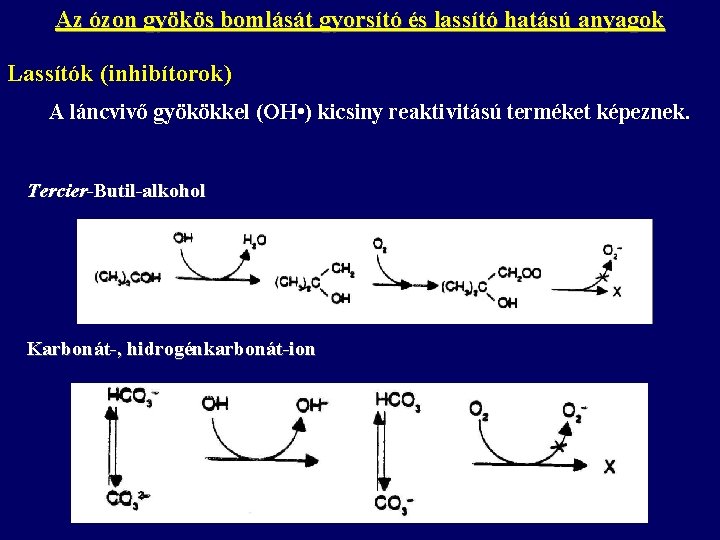
Az ózon gyökös bomlását gyorsító és lassító hatású anyagok Lassítók (inhibítorok) A láncvivő gyökökkel (OH • ) kicsiny reaktivitású terméket képeznek. Tercier-Butil-alkohol Karbonát-, hidrogénkarbonát-ion

Az ózon gyökös bomlását gyorsító és lassító hatású anyagok Iniciátorok Az ózonnal való reakció során gyököket generálnak , amelyek azután részt vesznek az ózon átalakulásában, megnövelve a rendszer gyökkészletét. Hidroxil gyök (HO • ) Formiátion UV sugárzás Hidrogén-peroxid fémionok Fe 2+ + O 3 = Fe. O 2+ + O 2 2 Fe. O 2+ + 2 H 2 O = 2 Fe 3+ + H 2 O 2 + 2 OHFe. O 2+ + H 2 O 2 = Fe 3+ + HO 2 + OHFe. O 2+ + H 2 O = Fe 3+ + HO + OH-

Az elsődlegesen képződő gyökök reaktivitása Szelektív, specifikus gyökgenerálási módszerek csak elvétve fordulnak elő, így a reakciórendszerek rendkívül összetettek és nehezen jellemezhetők. A gyökök reaktivitása a következő sorrendben változik: • OH >> • O 2 - > • O 3 - • O- > • HO 2 A hidroxil-gyök reakciói szerves anyagokkal 1. Hidrogén absztrakció: OH • + RH R • + H 2 O k = 107 -109 mol-1 dm 3 s-1 2. Gyökaddíció: Ph. X + • OH = HOPh. X • k = 108 -1010 mol-1 dm 3 s-1 3. Töltésátvitel: R-COO- + • OH = R-COO • + OH- k = 106 -108 mol-1 dm 3 s 1 4. Rekombinációs: R + OH = ROH k = 108 -1010 mol-1 dm 3 s-1

Az elsődlegesen képződő gyökök reaktivitása A szuperoxid gyökion ( • O 2 -) reakciói 1. Rekombinációjának sebessége nagyon kicsi, a folyamat általában 2. elhanyagolható 2. Protonálódva HO 2 • keletkezik 3. Töltésátvitel: R + O 2 • - = R- + O 2 E 0(O 2/ O 2 • -)=-0, 33 V és E 0(O 2 • -, 2 H+/H 2 O 2) =+1, 71 V 4. Hidrogén absztrakció: RH 2 + O 2 • - = RH • + HO 2 - A HO 2 • reakciói 1. 2. HO 2 • = O 2 • - + H+ p. K= 4, 8 Rekombinációs reakciók során H 2 O 2 keletkezik 3. 2 HO 2 • = H 2 O 2 + O 2 4. HO 2 • + O 2 • - + H 2 O = H 2 O 2 + OH- 3. Hidrogén absztrakció: RH 2 + HO 2 • = RH • + H 2 O 2

Az elsődlegesen képződő gyökök reaktivitása A gyökök reaktivitása a következő sorrendben változik: • OH >> • O 2 - > • O 3 - • O- > • HO 2 Az • O 3 - és • O- reakciói 1. • O 3 - = O 2 + • O 2. 3. • O 3 - + H 2 O = OH • + O 2 + OHTöltésátvitel , addíció

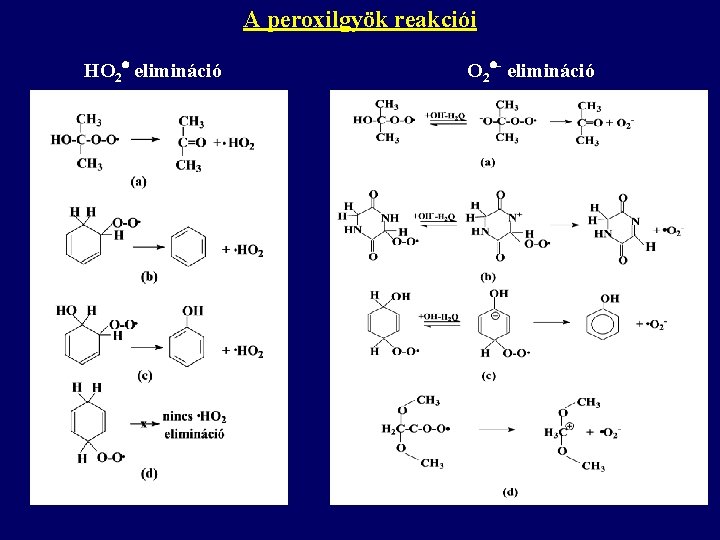
Az elsődlegesen képződő gyökök reakciói Molekuláris oldott oxigén jelenlétében a szerves gyökre addícionálódik az oxigén. R + O 2 = ROO • peroxilgyök A reakció általában irreverzibilis, sebességi állandójának értéke sok esetben megközelíti a diffúzió kontrollált reakciók sebességi állandójának értékét. A peroxilgyök reakciói 1. HO 2 elimináció: RHOO • R • + HO 2 2. O 2 - elimináció 3. Rekombináció: 2 ROO • = 2 ROOOOR (Russel-mechanizmus) 4. Rekombinációs: R + OH = ROH 5. H absztrakció: HR + ROO = ROOH + R

A peroxilgyök reakciói HO 2 elimináció O 2 - elimináció

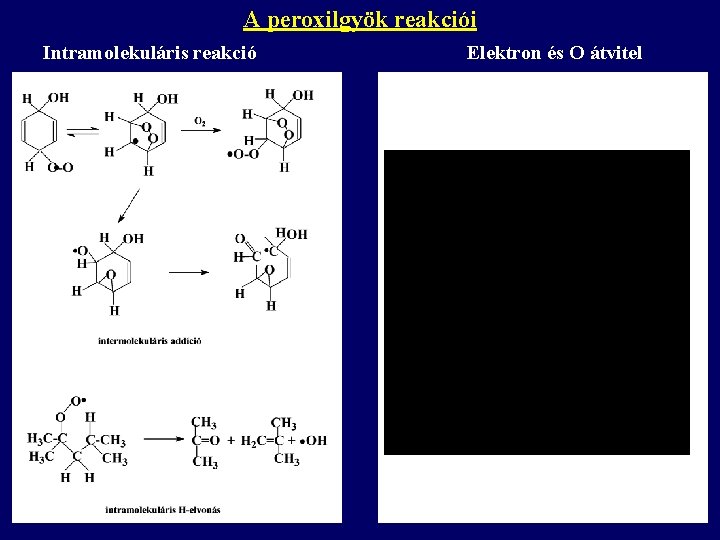
A peroxilgyök reakciói Intramolekuláris reakció Elektron és O átvitel

A peroxilgyök reakciói Rekombináció - tetroxidok további átalakulásai

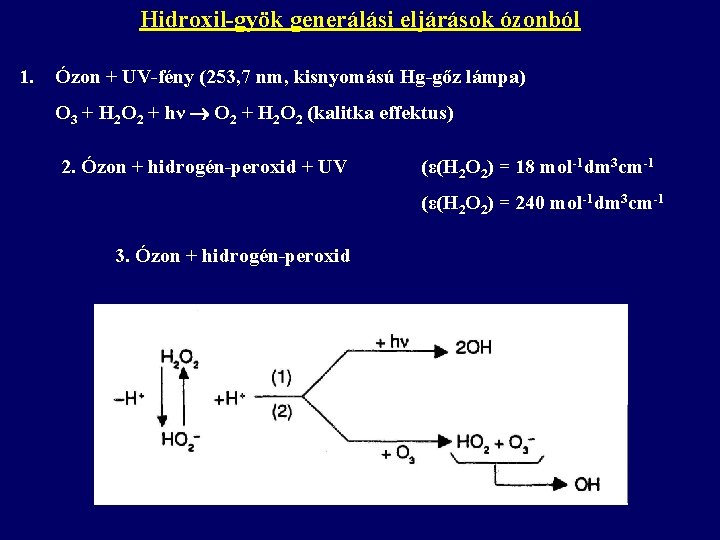
Hidroxil-gyök generálási eljárások ózonból 1. Ózon + UV-fény (253, 7 nm, kisnyomású Hg-gőz lámpa) O 3 + H 2 O 2 + hν O 2 + H 2 O 2 (kalitka effektus) 2. Ózon + hidrogén-peroxid + UV (ε(H 2 O 2) = 18 mol-1 dm 3 cm-1 (ε(H 2 O 2) = 240 mol-1 dm 3 cm-1 3. Ózon + hidrogén-peroxid
 Maksud kemahiran servis
Maksud kemahiran servis Francesca harries
Francesca harries Hemiski reakcii primeri
Hemiski reakcii primeri Izramnuvanje na hemiski ravenki
Izramnuvanje na hemiski ravenki Ovplyvňovanie rýchlosti chemických reakcií v praxi
Ovplyvňovanie rýchlosti chemických reakcií v praxi Vplyv teploty na rýchlosť chemickej reakcie
Vplyv teploty na rýchlosť chemickej reakcie Wassily kandinsky 1866-1944
Wassily kandinsky 1866-1944 What was the significance of the metric act of 1866
What was the significance of the metric act of 1866 Ernst haeckel ecology definition
Ernst haeckel ecology definition Wassily kandinsky schule
Wassily kandinsky schule Prantsuse kirjanik 1866-1944
Prantsuse kirjanik 1866-1944 What was the significance of the metric act of 1866?
What was the significance of the metric act of 1866? Aqui hay sabiduria entendimiento cuente numero bestia
Aqui hay sabiduria entendimiento cuente numero bestia Cumhuriyet dönemi'nde tiyatro 1923 1950
Cumhuriyet dönemi'nde tiyatro 1923 1950 1923 1924
1923 1924 Nein mich zwingt ihr nicht
Nein mich zwingt ihr nicht Riforma gentile 1923
Riforma gentile 1923 O ego e o id (1923 resumo)
O ego e o id (1923 resumo) Ruhr crisis 1923
Ruhr crisis 1923 Ben day dots stencil
Ben day dots stencil Lei eloy chaves
Lei eloy chaves Henryk żeglarz ur 1923
Henryk żeglarz ur 1923 Fms movie
Fms movie Auto dealership compliance training
Auto dealership compliance training 1923cmp
1923cmp Ilüviyal zon
Ilüviyal zon Kepentingan zee kepada malaysia
Kepentingan zee kepada malaysia Stuwingsneerslag
Stuwingsneerslag Snelheid aarde om zon
Snelheid aarde om zon Elüviasyon nedir
Elüviasyon nedir Organizma ekolojisi
Organizma ekolojisi Een eigen huis een plek onder de zon
Een eigen huis een plek onder de zon Rigel oppervlaktetemperatuur
Rigel oppervlaktetemperatuur Opwekking 733
Opwekking 733 Afotik zon
Afotik zon Zony jmk
Zony jmk Bello zon
Bello zon