ALDEIDI E CHETONI Sono composti caratterizzati dalla presenza






- Slides: 14

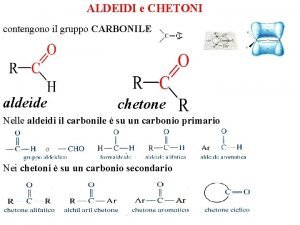
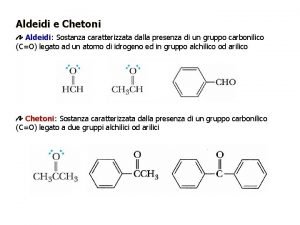
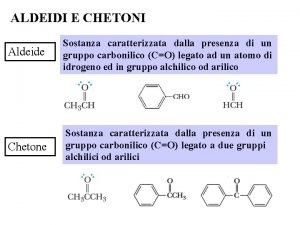
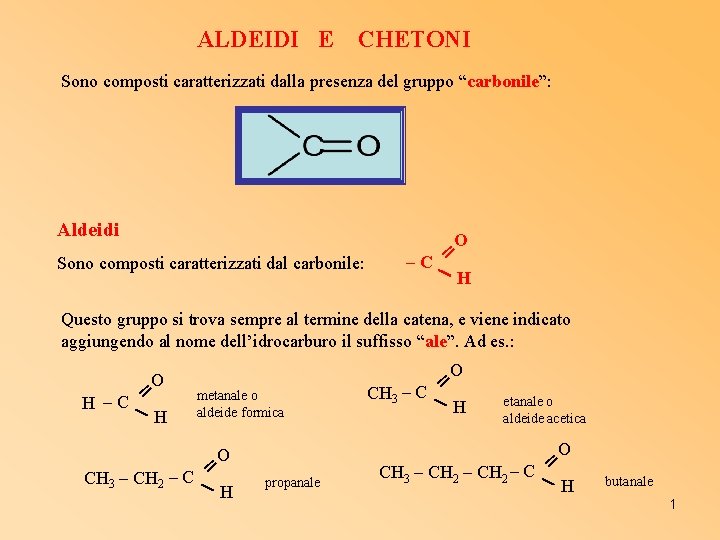
ALDEIDI E CHETONI Sono composti caratterizzati dalla presenza del gruppo “carbonile”: Aldeidi Sono composti caratterizzati dal carbonile: O ═ –C H Questo gruppo si trova sempre al termine della catena, e viene indicato aggiungendo al nome dell’idrocarburo il suffisso “ale”. Ad es. : O ═ H –C H metanale o aldeide formica O ═ CH 3 – CH 2 – C H propanale O ═ CH 3 – C H etanale o aldeide acetica O ═ CH 3 – CH 2 – C H butanale 1

Nella nomenclatura IUPAC il gruppo aldeidico non è numerato poiché è sempre terminale. L’aldeide formica è l’unica aldeide gassosa, le altre sono liquide, e quelle a catene lunga sono solide. SOLUBILITÀ delle Aldeidi Le aldeidi sono composti molto poco solubili in H 2 O, e la loro solubilità diminuisce con l’aumentare del numero di atomi di C. Se confrontiamo l’aldeide acetica e l’etanolo: CH 3 – CH 2 – OH bolle a 78°C O ═ CH 3 – C H bolle a 20°C La grande differenza nella temperatura di ebollizione è dovuta al fatto che essendo composti poco polari hanno legami idrogeno molto più deboli degli alcoli. 2

Chetoni Sono composti caratterizzati dal carbonile: ═ O C Questo gruppo non si trova mai al termine della catena, e viene indicato aggiungendo al nome dell’idrocarburo il suffisso “one”. Ad es. : ═ O CH 3 – CH 3 propanone o acetone E’ un chetone simmetrico, ed è il più semplice chetone ═ O CH 3 – CH 2 – CH 3 butanone O CH 3 – CH 2 – CH 3 2 pentanone ═ ═ O CH 3 – CH 2 – CH 3 3 pentanone 3

Nella nomenclatura IUPAC il composto carbonilico ha sempre la precedenza nella dizione. SOLUBILITÀ dei Chetoni I chetoni sono relativamente poco solubili in H 2 O, e come per le aldeidi la loro solubilità diminuisce mano che aumenta il n° di atomi di C della catena. I chetoni che hanno un numero di atomi di C > 4 non sono solubili in H 2 O. 4

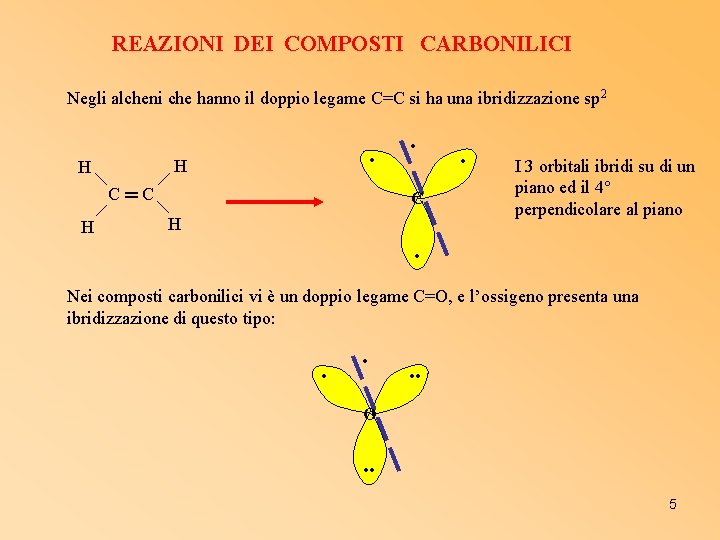
REAZIONI DEI COMPOSTI CARBONILICI Negli alcheni che hanno il doppio legame C=C si ha una ibridizzazione sp 2 • H H C═C H • I 3 orbitali ibridi su di un piano ed il 4° perpendicolare al piano • Nei composti carbonilici vi è un doppio legame C=O, e l’ossigeno presenta una ibridizzazione di questo tipo: • • • • O • • 5

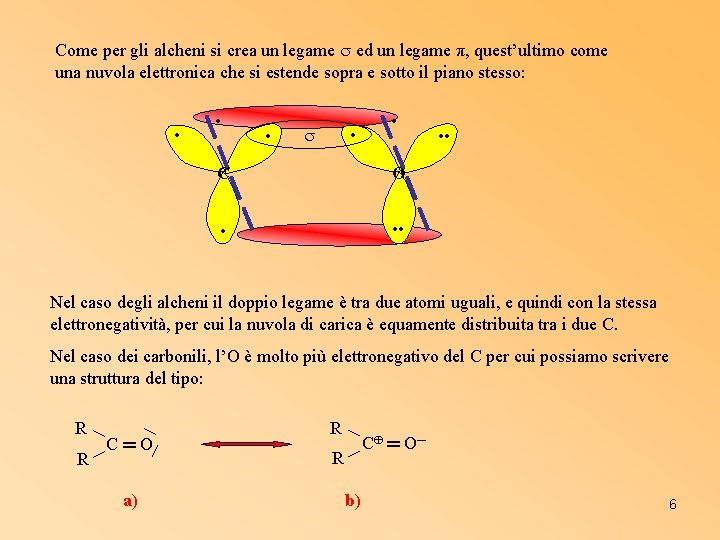
Come per gli alcheni si crea un legame ed un legame π, quest’ultimo come una nuvola elettronica che si estende sopra e sotto il piano stesso: • • • C O • • • Nel caso degli alcheni il doppio legame è tra due atomi uguali, e quindi con la stessa elettronegatività, per cui la nuvola di carica è equamente distribuita tra i due C. Nel caso dei carbonili, l’O è molto più elettronegativo del C per cui possiamo scrivere una struttura del tipo: R R C═O a) R C ═ O─ R b) 6

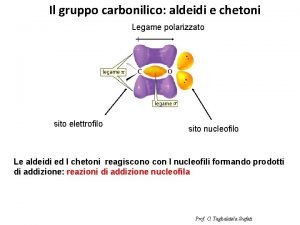
In questo caso dunque il gruppo carbonilico è rappresentato da entrambe le strutture. Sono due strutture limite: a) indica che gli elettroni sono a metà tra O e C b) indica che gli elettroni sono sull’O In realtà dobbiamo parlare di polarizzazione, ossia il legame in questo caso è fortemente polarizzato: R R + C═O Un tale composto allora potrà reagire sia con elettrofili che con nucleofili, ed in particolare gli elettrofili reagiranno con l’O─ (nucleofilo) mentre i nucleofili reagiranno con il C (elettrofilo). 7

Sia le aldeidi chetoni danno reazioni di ADDIZIONE NUCLEOFILA: O─ O ═ R –C H + N─ R–C–H N Il nucleofilo attacca il C sia da sopra che da sotto il piano, e l’O richiama su di sé gli e- del = legame In questo meccanismo il C passa da una ibridizzazione sp 2 ad una ibridizzazione sp 3. La reazione dipenderà dalla forza del nucleofilo. Caso A O ═ R –C H + H 2 O R–O–H Cl-, Br- + R – ONH 3, R – NH 2 OH- Caso B O R –C ═ H 8

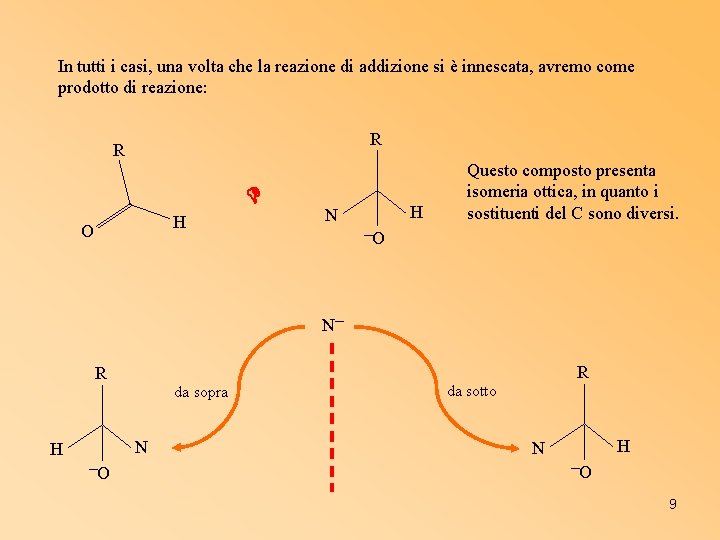
In tutti i casi, una volta che la reazione di addizione si è innescata, avremo come prodotto di reazione: R R H O H N Questo composto presenta isomeria ottica, in quanto i sostituenti del C sono diversi. ─O N─ R R da sopra N H ─O da sotto H N ─O 9

R R N H ─O Le due strutture sono enantiomeri, e si formano in uguale quantità. H N ─O NOTA: Quando una reazione porta alla scomparsa di un C sp 2 ed alla formazione di un C sp 3 il meccanismo comporta la formazione di un C asimetrico (chirale) e il prodotto sarà un RACEMO. Il racemo è una miscela di enantiomeri in uguale quantità per cui il potere ottico rotatorio è zero (l’angolo di rotazione = 0). Se si forma una quantità diversa dei due enentiomeri la reazione viene detta “ENANTIO-SELETTIVA”. In natura le reazione sono quasi sempre enantio-selettive, come ad es. nella sintesi degli Amminoacidi. 10

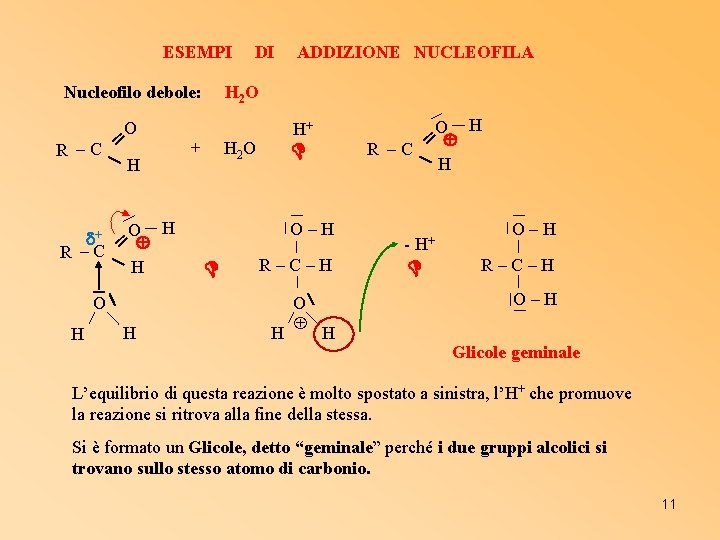
ESEMPI Nucleofilo debole: O ═ R –C H H + ═O R –C H DI H 2 O + H O H R –C ═ H H+ H 2 O O–H R–C–H O H ADDIZIONE NUCLEOFILA H O - H+ O–H R–C–H O–H H Glicole geminale L’equilibrio di questa reazione è molto spostato a sinistra, l’H+ che promuove la reazione si ritrova alla fine della stessa. Si è formato un Glicole, detto “geminale” perché i due gruppi alcolici si trovano sullo stesso atomo di carbonio. 11

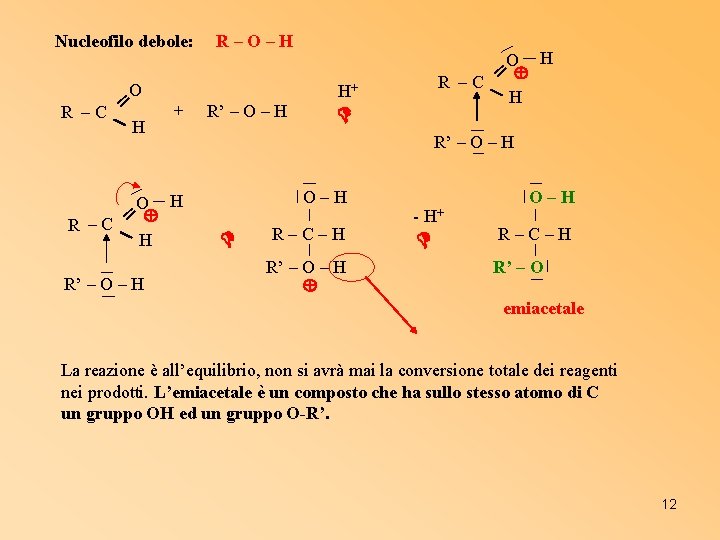
Nucleofilo debole: O R –C ═ H + O H R –C ═ H R’ – O – H R–O–H R’ – O – H O H ═ R –C H H+ R’ – O – H O–H R–C–H R’ – O – H - H+ O–H R–C–H R’ – O emiacetale La reazione è all’equilibrio, non si avrà mai la conversione totale dei reagenti nei prodotti. L’emiacetale è un composto che ha sullo stesso atomo di C un gruppo OH ed un gruppo O-R’. 12

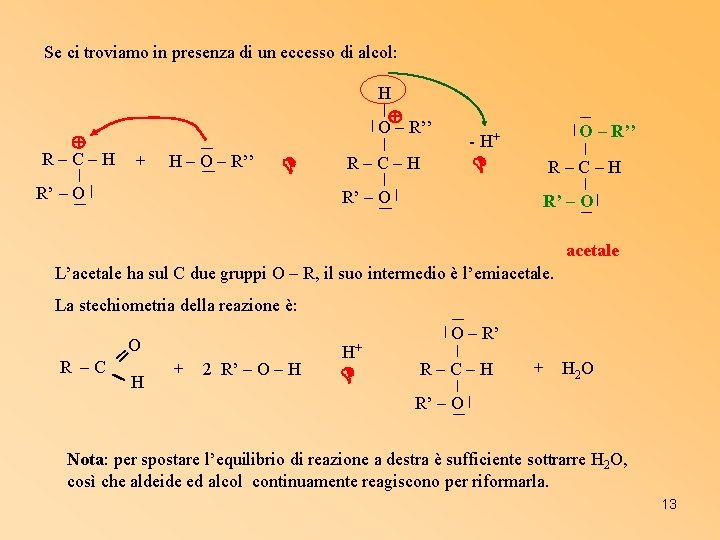
Se ci troviamo in presenza di un eccesso di alcol: R–C–H H O – R’’ + H – O – R’’ R’ – O O – R’’ - H+ R–C–H R’ – O acetale L’acetale ha sul C due gruppi O – R, il suo intermedio è l’emiacetale. La stechiometria della reazione è: O R –C ═ H + 2 R’ – O – H H+ O – R’ R–C–H + H 2 O R’ – O Nota: per spostare l’equilibrio di reazione a destra è sufficiente sottrarre H 2 O, così che aldeide ed alcol continuamente reagiscono per riformarla. 13

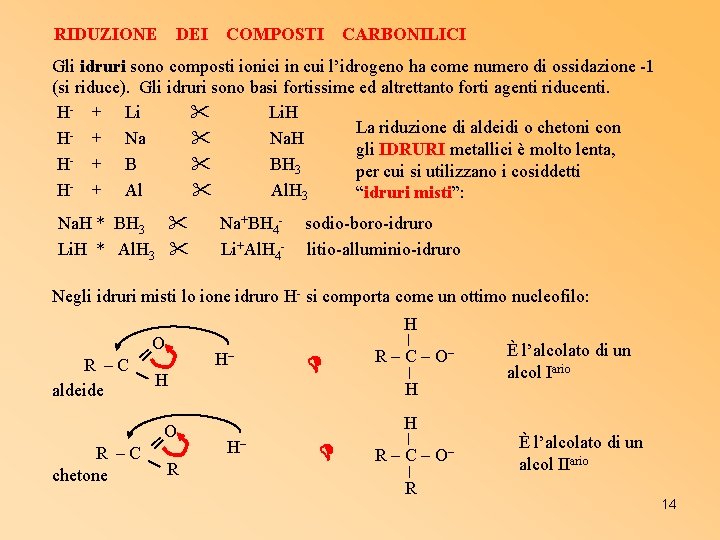
RIDUZIONE DEI COMPOSTI CARBONILICI Gli idruri sono composti ionici in cui l’idrogeno ha come numero di ossidazione -1 (si riduce). Gli idruri sono basi fortissime ed altrettanto forti agenti riducenti. H- + Li Li. H La riduzione di aldeidi o chetoni con H- + Na Na. H gli IDRURI metallici è molto lenta, H + B BH 3 per cui si utilizzano i cosiddetti H + Al Al. H 3 “idruri misti”: Na. H * BH 3 Li. H * Al. H 3 Na+BH 4 Li+Al. H 4 - sodio-boro-idruro litio-alluminio-idruro Negli idruri misti lo ione idruro H- si comporta come un ottimo nucleofilo: O ═ R –C H aldeide O ═ R –C R chetone H H– R – C – O– H H H– R – C – O– R È l’alcolato di un alcol Iario È l’alcolato di un alcol IIario 14
 Aldeide più semplice
Aldeide più semplice Riduzione aldeidi e chetoni meccanismo
Riduzione aldeidi e chetoni meccanismo Gruppi funzionali
Gruppi funzionali Nomenclatura aldeidi
Nomenclatura aldeidi I tectosilicati sono silicati caratterizzati da
I tectosilicati sono silicati caratterizzati da Per me l'ago della bilancia sei sempre tu
Per me l'ago della bilancia sei sempre tu Emiacetale esempio
Emiacetale esempio Aldeide più semplice
Aldeide più semplice Composti sum
Composti sum Ossiacidi
Ossiacidi Nomenclatura composti aromatici
Nomenclatura composti aromatici Sali acidi esempi
Sali acidi esempi Riparti composti
Riparti composti Funzione delle proteine
Funzione delle proteine Alchilazione ammine
Alchilazione ammine