2011 Fortalecimiento de las Autoridades Reguladoras Nacionales de




























- Slides: 32


2011 Fortalecimiento de las Autoridades Reguladoras Nacionales de Medicamentos y Productos Biológicos en la Región de las Américas María Luz Pombo Especialista en Productos Biológicos (HSS/MT) James Fitzgerald Coordinador Proyecto Medicamentos y Tecnologías Sanitarias (HSS/MT) Organización Panamericana De la Salud Rio de Janeiro 3 de Octubre de 2011

2011 Contenido ü Antecedentes: ü De dónde surge? ü Cómo se ha manifestado y cómo se lleva a cabo en la actualidad? ü Resolución del Consejo Directivo CD 50. R 9, Octubre 2010 ü Manual para la evaluación de Autoridades Reguladoras de Referencia Regional para Medicamentos y Productos Biológicos ü Red Panamericana para la Armonización de la Reglamentación Farmacéutica (Red PARF) ü Resutados - Avances logrados ü Desafíos a enfrentar Organización Panamericana De la Salud

2011 ANTECEDENTES Organización Panamericana De la Salud

2011 Antecedentes ü El fortalecimiento de la capacidad reguladora de la autoridad sanitaria como parte de las funciones esenciales de salud pública, es un concepto reconocido y aprobado en diferentes instancias de la Organización Panamericana de la Salud. ü En 2007, reguladores de Latinoamérica y la OPS identificaron la necesidad de establecer una metodología transparente y uniforme que permita calificar la funcionalidad de las Autoridades Reguladoras en las funciones básicas recomendadas por la Organización Mundial de la Salud. ü La participación inicial de reguladores provenientes de siete países permitió consensuar los indicadores que deberían estar contenidos en el instrumento que se emplearía para dicho fin (México 2008) ü En el año 2009, la guía de evaluación y los procedimientos correspondientes fueron desarrollados. Organización Panamericana De la Salud

2011 Antecedentes ü El proceso de calificación de las Autoridades Reguladoras Nacionales es basado en: ü El procedimiento para calificar a los postulantes que manifiestan interés por participar como evaluadores (en base a: formación académica, experiencia laboral en el área regulatoria, y manejo de gestión), ü La aplicación del Manual para la evaluación de Autoridades Reguladoras de Referencia Regional para Medicamentos y Productos Biológicos, y ü La verificación de indicadores contenidos en una herramienta de recolección de datos. ü El instrumento de evaluación fué desarrollado siguiendo las recomendaciones de la Organización Mundial de la Salud, reflejados en: – Practical Guidance for Conducting a Review (based on the WHO Data Collection Tool for the Review of Drug Regulatory Systems), – A WHO manual for assessment of the national regulatory system for vaccines Organización Panamericana De la Salud

2011 RESOLUCIÓN CD 50. R 9, 2010: “FORTALECIMIENTO DE LAS AUTORIDADES REGULADORAS NACIONALES DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS” Organización Panamericana De la Salud

2011 ü En Junio 2010, durante el Comité Ejecutivo de la OPS, los países miembros solicitaron discutir la iniciativa en el marco del Consejo Directivo de la OPS. ü En Octubre 2010, el Consejo Directivo de la OPS sostuvo la discusión sobre el tema y como resultado los Estados Miembros aprobaron por concenso la Resolución CD 50. R 9 de “Fortalecimiento de las Autoridades Reguladoras Nacionales de Medicamentos y productos biológicos”. Organización Panamericana De la Salud

CD 50. R 9, 2010: “Fortalecimiento de las Autoridades Reguladoras Nacionales de Medicamentos y productos biológicos” 2011 Insta a los Estados Miembros a: ü Fortalecer y evaluar su capacidad reguladora con respecto a las funciones propias de un organismo de regulación y fiscalización de medicamentos y productos biológicos, ü Utilizar los resultados de la calificación y la designación de la autoridad reguladora de referencia regional para fortalecer su desempeño en cuanto a la función rectora de la autoridad sanitaria, ü Apoyar a las autoridades reguladoras nacionales para que puedan beneficiarse de los procesos y la información de autoridades de referencia regional, ü Promover la difusión de información sobre los resultados y procesos de regulación y fiscalización de medicamentos, productos biológicos y otras tecnologías sanitarias, ü Promover el intercambio y la cooperación técnica entre países, ü Participar activamente de la Red Panamericana de Armonización de la Reglamentación Farmacéutica (Red PARF) Organización Panamericana De la Salud

CD 50. R 9, 2010: “Fortalecimiento de las Autoridades Reguladoras Nacionales de Medicamentos y productos biológicos” 2011 Solicita a la Directora: ü Apoyar las iniciativas para el fortalecimiento y calificación de ARN a fin de garantizar la calidad, inocuidad y eficacia de los medicamentos, biológicos y otras tecnologías sanitarias, ü Mantener y fortalecer la colaboración de la OPS con los Estados Miembros en materia de regulación en medicamentos y biológicos, ü Promover la cooperación técnica entre ARN así como el reconocimiento de las capacidades instaladas en la Región. . . Organización Panamericana De la Salud

2011 MANUAL DE CALIFICACIÓN DE AUTORIDADES REGULADORAS DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS, VERSIÓN FEBRERO 2011 Organización Panamericana De la Salud

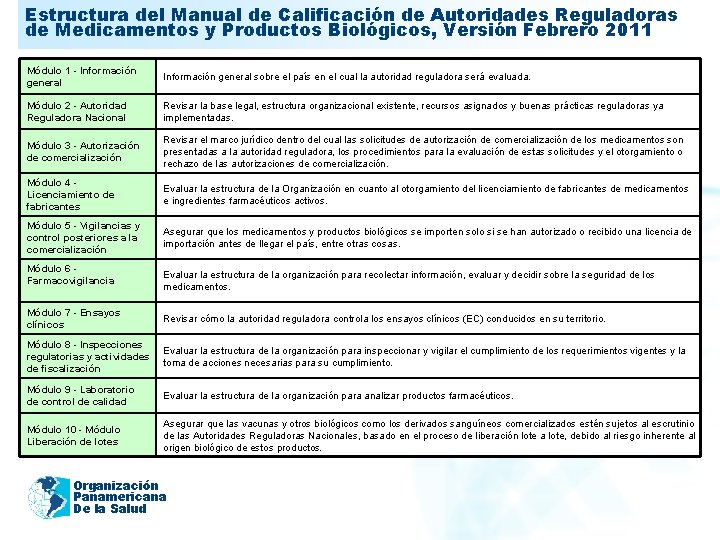
Estructura del Manual de Calificación de Autoridades Reguladoras 2011 de Medicamentos y Productos Biológicos, Versión Febrero 2011 Módulo 1 - Información general sobre el país en el cual la autoridad reguladora será evaluada. Módulo 2 - Autoridad Reguladora Nacional Revisar la base legal, estructura organizacional existente, recursos asignados y buenas prácticas reguladoras ya implementadas. Módulo 3 - Autorización de comercialización Revisar el marco jurídico dentro del cual las solicitudes de autorización de comercialización de los medicamentos son presentadas a la autoridad reguladora, los procedimientos para la evaluación de estas solicitudes y el otorgamiento o rechazo de las autorizaciones de comercialización. Módulo 4 Licenciamiento de fabricantes Evaluar la estructura de la Organización en cuanto al otorgamiento del licenciamiento de fabricantes de medicamentos e ingredientes farmacéuticos activos. Módulo 5 - Vigilancias y control posteriores a la comercialización Asegurar que los medicamentos y productos biológicos se importen solo si se han autorizado o recibido una licencia de importación antes de llegar el país, entre otras cosas. Módulo 6 Farmacovigilancia Evaluar la estructura de la organización para recolectar información, evaluar y decidir sobre la seguridad de los medicamentos. Módulo 7 - Ensayos clínicos Revisar cómo la autoridad reguladora controla los ensayos clínicos (EC) conducidos en su territorio. Módulo 8 - Inspecciones regulatorias y actividades de fiscalización Evaluar la estructura de la organización para inspeccionar y vigilar el cumplimiento de los requerimientos vigentes y la toma de acciones necesarias para su cumplimiento. Módulo 9 - Laboratorio de control de calidad Evaluar la estructura de la organización para analizar productos farmacéuticos. Módulo 10 - Módulo Liberación de lotes Asegurar que las vacunas y otros biológicos como los derivados sanguíneos comercializados estén sujetos al escrutinio de las Autoridades Reguladoras Nacionales, basado en el proceso de liberación lote a lote, debido al riesgo inherente al origen biológico de estos productos. Organización Panamericana De la Salud

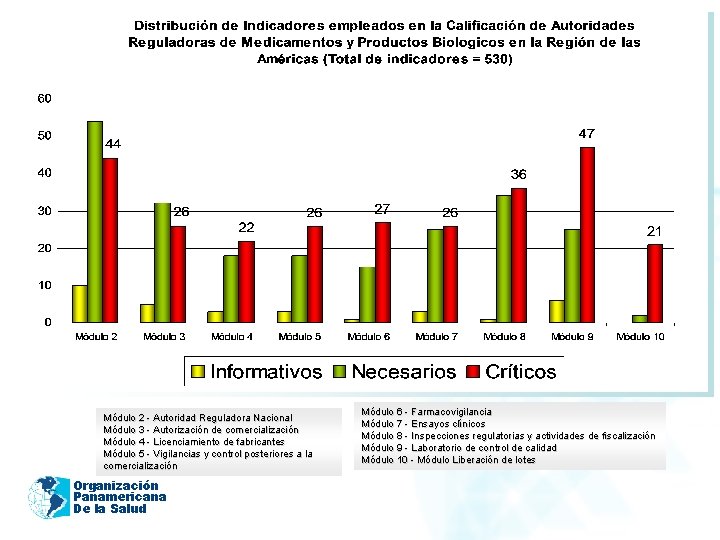
2011 Módulo 2 - Autoridad Reguladora Nacional Módulo 3 - Autorización de comercialización Módulo 4 - Licenciamiento de fabricantes Módulo 5 - Vigilancias y control posteriores a la comercialización Organización Panamericana De la Salud Módulo 6 - Farmacovigilancia Módulo 7 - Ensayos clínicos Módulo 8 - Inspecciones regulatorias y actividades de fiscalización Módulo 9 - Laboratorio de control de calidad Módulo 10 - Módulo Liberación de lotes

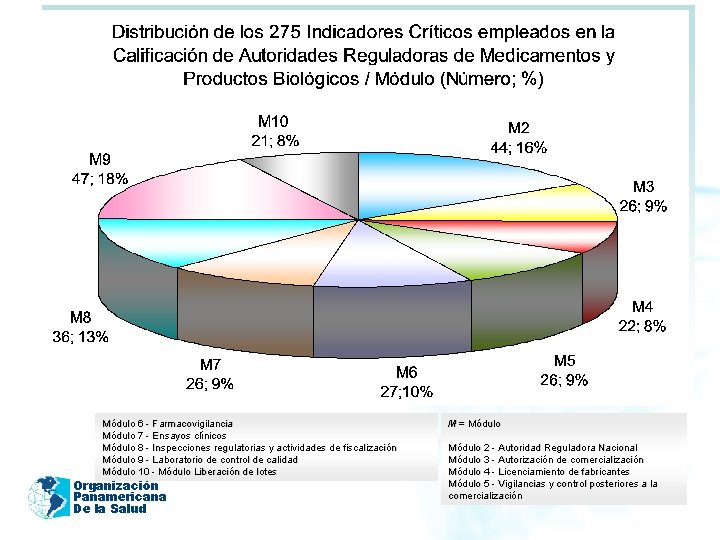
2011 Módulo 6 - Farmacovigilancia Módulo 7 - Ensayos clínicos Módulo 8 - Inspecciones regulatorias y actividades de fiscalización Módulo 9 - Laboratorio de control de calidad Módulo 10 - Módulo Liberación de lotes Organización Panamericana De la Salud M = Módulo 2 - Autoridad Reguladora Nacional Módulo 3 - Autorización de comercialización Módulo 4 - Licenciamiento de fabricantes Módulo 5 - Vigilancias y control posteriores a la comercialización

Ejemplos de indicadores Críticos 2011 Módulos de Calificación de Autoridades Reguladoras de Medicamentos y Productos Biológicos, Versión Febrero 2011 Módulo 2 - Autoridad Reguladora Nacional Sub-Indicador 2. 1. 3: Todas las funciones de regulación deben encontrarse bajo la responsabilidad y supervisión de al menos un organismo/ autoridad reguladora. Módulo 3 - Autorización de comercialización Sub-Indicador 3. 1. 6: Existencia de reglamentación relativa a la información que debe ser entregada con los productos (envase, etiquetado, folletos, resumen de las características del producto, etc. ) Módulo 4 - Licenciamiento de fabricantes Sub-Indicador 4. 1. 2: La legislación faculta a la ARN para emitir la licencia pero también para suspender y cerrar / detener actividades de producción. Módulo 5 - Vigilancias y control posteriores a la comercialización Sub-indicador 5. 1. 1: La legislación requiere que una compañía que importa o intenta importar medicamentos y productos biológicos medicamentos debe tener licencia o autorización sanitaria específica para ejercer su actividad emitida por la ARN. Módulo 6 Farmacovigilancia Sub-indicador 6. 4. 3: Existen procedimientos documentados en la ARN para registrar y evaluar los reportes diarios de reacciones adversas. Módulo 7 - Ensayos clínicos Sub-indicador 7. 2. 7: Se proporciona información detallada sobre los requisitos de cumplimiento con BPC en una guía para los centros de investigación, investigadores, patrocinadores, CRO y todos los involucrados en el ensayo clínico. Ésta guía está de acuerdo con el modelo de OMS. Módulo 8 - Inspecciones regulatorias y actividades de fiscalización Sub-indicador 8. 5. 7: Existen procedimientos / herramientas para verificar el cumplimiento con las BPM, BPD, BPC, BPL, Buenas Prácticas de Vigilancia y Buenas Prácticas de dispensación. Módulo 9 - Laboratorio de control de calidad Sub-indicador 9. 5. 7: Están definidas las especificaciones y los criterios de validez para cada ensayo. Módulo 10 - Módulo Liberación de lotes Sub-indicador 10. 2. 3: Existe un Sistema de Gestión que garantice la interrelación entre las actividad de liberación de lotes y las otras funciones regulatorias (registro sanitario, inspección de buenas prácticas de manufactura, etc. ) Organización Panamericana De la Salud

2011 Evaluación cuantitativa de indicadores críticos En implementación Parcialmente implementado Nivel No implementado I Hasta 50 % C 50 -75 % C 0 -24 % C II Hasta 25 % C 25 -50 % C 25 -49 % C 25 -50 % C 50 -74 % C III Hasta 15% C IV Organización Panamericana De la Salud 0 0 -25 % Implementado 75 -100 % C

2011 Resultados de calificación de Autoridades Reguladoras Nivel IV: Autoridad Nacional Reguladora competente y eficiente en el desempeño de las funciones de regulación sanitaria recomendadas por la OPS/OMS para garantizar la eficacia, seguridad y calidad de los medicamentos. AUTORIDAD DE REFERENCIA REGIONAL Nivel III: Autoridad Nacional Reguladora competente y eficiente que debe perfeccionar el desempeño de determinadas funciones de regulación sanitaria recomendadas por la OPS/OMS para garantizar la eficacia, seguridad y calidad de los medicamentos. Nivel II: Estructuras u organizaciones con mandato de Autoridad Nacional Reguladora que cumplen determinadas funciones de regulación sanitaria recomendadas por la OPS/OMS para garantizar la eficacia, seguridad y calidad de los medicamentos. Nivel I: Dependencias de instituciones de salud que cumplen determinadas funciones de regulación sanitaria de medicamentos. Organización Panamericana De la Salud

2011 RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGLAMENTACIÓN FARMACÉUTICA (RED PARF) Organización Panamericana De la Salud

2011 Red PARF ü La Red Panamericana para la Armonización de la Reglamentación Farmacéutica (Red PARF) “es una iniciativa de las Autoridades Reguladoras Nacionales de la Región y la Organización Panamericana de la Salud que apoya los procesos de armonización de la reglamentación farmacéutica en las Américas, en el marco de las realidades y las políticas sanitarias nacionales y subregionales y el reconocimiento de las asimetrías pre - existentes”. ü Los componentes de la Red PARF son: ü La Conferencia Panamericana ü El Comité Directivo ü Los grupos técnicos de trabajo en área prioritarias ü El Secretariado (OPS) ü Toda la información está publicada y disponible en los siguientes Links: www. paho. org/PANDRH (en inglés); www. paho. org/Red. PARF(en español) Organización Panamericana De la Salud

2011 Objetivos generales y grupos de trabajo de la Red PARF ü Fortalecer a las Autoridades Reguladoras de los países de la Región, promoviendo la cooperación entre los mismos. ü Desarrollar y aprobar propuestas armonizadas (documentos técnicos, guías, etc. ) sobre la regulación de medicamentos. ü Identificar los mecanismos de apoyo para la implementación, seguimiento y evaluación de las propuestas adoptadas. ü Impulsar la calificación de las ARN de la Región. Grupos técnicos de trabajo: Bioequivalencia, Buenas prácticas de laboratorio, Buenas prácticas de manufactura, Buenas prácticas clínicas, Registro de medicamentos, Clasificación de medicamentos, Promoción de medicamentos, Farmacovigilancia, Combate a la falsificación, Farmacopeas, Plantas medicinales, Vacunas y Productos biotecnológicos Organización Panamericana De la Salud

2011 RESULTADOS - AVANCES LOGRADOS Organización Panamericana De la Salud

2011 Resultados – Avances logrados ü Al 2011, cinco (5) autoridades reguladoras nacionales han sido calificadas: ARGENTINA, BRASIL, COLOMBIA, CUBA, CHILE ü Siete (7) autoridades reguladoras nacionales han sido pre-evaluadas: ECUADOR, HONDURAS, PARAGUAY, COSTA RICA, EL SALVADOR, GUATEMALA, REPÚBLICA DOMINICANA ü Varios países sumándose al proceso, mediante autoevaluación de su gestión regulatoria y elaboración de planes estratégicos de desarrollo institucional: NORTEAMÉRICA, CENTROAMÉRICA, COMUNIDAD ANDINA Y EL CARIBE ü Cuatro autoridades reguladoras han demostrado ser competentes y eficientes en el desempeño de las funciones de regulación sanitaria recomendadas por la OPS/OMS para garantizar la eficacia, seguridad y calidad de los medicamentos: Organización Panamericana De la Salud

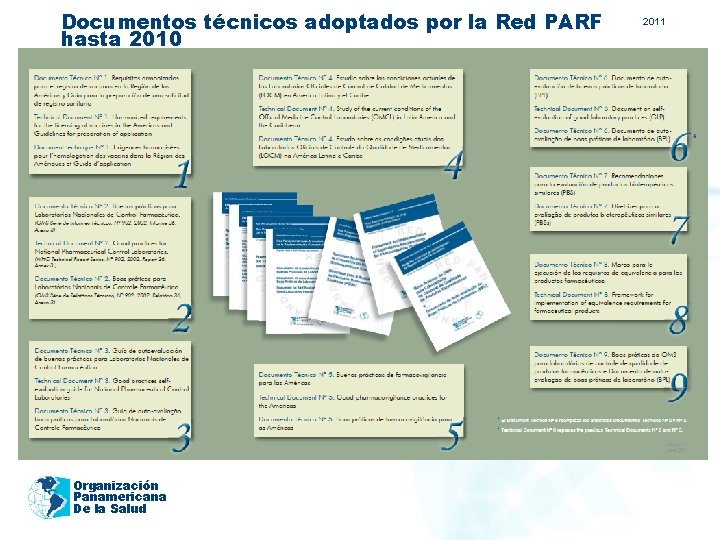
2011 Resultados – Avances logrados ü Al 2010, nueve documentos técnicos habían sido adoptados por la Red PARF. ü Durante la VI Conferencia Panamericana de Armonización de la Reglamentación Farmacéutica en Brasilia (Julio, 2011) se adoptaron los siguientes documentos: ü Recomendaciones para la evaluación de productos bioterapéuticos similares (PBS) ü Pautas a ser Consideradas por las Autoridades de Salud ante una Sospecha de Falsificación de Medicamentos y Productos Médicos ü Directrices para el Registro de Medicamentos en las Américas ü Manual del Investigador a partir de la Guía para Buenas Prácticas Clínicas ü Guía para Estudios Clínicos en Pediatría ü Consideraciones sobre el uso de Placebo ü Criterios éticos para la promoción, propaganda y publicidad de los medicamentos Organización Panamericana De la Salud

Documentos técnicos adoptados por la Red PARF hasta 2010 Organización Panamericana De la Salud 2011

2011 Resultados – Avances logrados ü A Junio de 2011, tres Laboratorios oficiales de control de medicamentos fueron precalificados por la OMS, como Laboratorios de Referencia para las Naciones Unidas: CONCAMYT (Laboratorio Oficial para el Control de Calidad de Medicamentos y Toxicología) BOLIVIA Organización Panamericana De la Salud CNCC (Laboratorio Oficial Centro Nacional de Control de Calidad) PERU CCCM ( Laboratorio Oficial Comisión Control de calidad de Medicamentos) URUGUAY

2011 Resultados – Avances logrados Otros avances subregionales: ü Consejo de Ministros de Centroamérica (COMISCA), instruye a la Secretaria Ejecutiva del Consejo de Ministros(as) de Salud de Centroamérica (SECOMISCA) para que se fortalezcan a las Autoridades Reguladoras de Medicamentos, haciendo énfasis entre otros a la regulación de productos biológicos y biotecnológicos (Resolución 32 de la XXXIII COMISCA, Belice, Diciembre 2010) ü En junio 2011, Guatemala, proponen crear un marco normativo armonizado para la región centroamericana, planteando: ü ü Superar las diferencias existentes en los países en cuanto a los niveles de funcionalidad de las autoridades reguladoras nacionales, Incentivar el desarrollo de procesos de capacitación de recurso humano, Establecer mecanismos para el intercambio de información entre los países de la región, y Realizar esfuerzos conjuntos para la instalación de un laboratorio regional que este adecuadamente equipado para realizar el control de calidad necesario durante la etapa de vigilancia post-comercialización de estos medicamentos. ü CARICOM por su parte ha realizado el análisis de situación para crear capacidad subregional Organización Panamericana De la Salud

2011 Resultados – Avances logrados Otros avances subregionales: ü El “Caribbean Community and Common Market (CARICOM)” fue establecido en 1972. Durante la VI Conferencia Panamericana de la Red PARF, en Julio de 2011, fueron presentados los avances en temas de fortalecimiento de la capacidad reguladora: ü El análisis de la situación regulatoria y sistemas de registro de medicamentos a nivel de esta Región fue diagnosticado y presentado al Consejo de Ministros de Salud (CAUCUS) en septiembre de 2009. ü Basado en estos resultados, en 2010, se desarrollo un documento concepto y una propuesta para la Política Farmacéutica del Caribe. ü En 2011, esta Política Farmacéutica fue aprobada por el Consejo de Desarrollo Humano y Social del CARICOM, estimando necesario: ü Desarrollar un marco regulatorio subregional y fortalecer la colaboración entre los países del Caribe para asegurar los componentes esenciales de la regulación de los medicamentos. Organización Panamericana De la Salud

2011 DESAFÍOS A ENFRENTAR Organización Panamericana De la Salud

2011 Desafíos a enfrentar ü Que las autoridades reguladoras puedan responder a las solicitudes y recomendaciones de la Resolución CD 50. R 9 (Washington DC - Octubre 2010) y de la VI Conferencia Panamericana de Armonización de la Reglamentación Farmacéutica (Brasilia – Julio 2011): ü Elaborando e implementando Buenas Prácticas Regulatorias. ü Implantando modelos sustentables en el tiempo, que fortalezcan la fiscalización, control y vigilancia de productos y de procesos. ü Fomentando alianzas estratégicas entre ARNs para el desarrollo e incremento de capacidades. ü Impulsando la armonización y reconocimiento mutuo entre ARNs, apoyados en la implementación de los lineamientos adoptados por la Red PARF y así poder viabilizar la homologación de los procesos. Organización Panamericana De la Salud

2011 Desafíos a enfrentar ü Que puedan identificarse los mecanismos que faciliten el apoyo real de las autoridades de referencia regional hacia las otras ARNs que aún no han podido implementar las funciones básicas, mediante: ü El establecimiento de roles y responsabilidades específicas de las autoridades reguladoras de referencia regional, ü Promoviendo el intercambio entre Autoridades para hacer transferencia de conocimiento como un mecanismo de fortalecimiento, ü Compartiendo y participando de las experiencias del proceso de calificación entre países, ü Velando por que los procesos de compra de medicamentos y productos biológicos de la OPS se apoyen en la capacidad instalada de las autoridades reguladoras de referencia , y garantizar a través de la vigilancia sanitaria, la calidad, seguridad y eficacia de los productos comercializados en la Región de las Américas. Organización Panamericana De la Salud

2011 Desafíos a enfrentar ü Solicitar al Consejo Directivo de la Red PARF: ü Desarrollar un plan estratégico que integre el mandato del Consejo Directivo CD 50. R 9 con todas las ARN, indistintamente de su nivel de desarrollo. ü Crear un grupo “ Ad-Hoc” y facilitar la elaboración e implementación del plan estratégico de fortalecimiento de capacidades técnicas, incluyendo apropiados planes de capacitación de los recursos humanos de las ARNs. ü Coordinar el trabajo de la Red PARF con otras iniciativas a nivel Regional para el manejo eficiente de recursos. ü Implementar estrategias y acciones para el fortalecimiento de capacidades reguladoras, en beneficio de la salud de los pueblos. Organización Panamericana De la Salud

2011 Gracias Personas de contacto relacionadas con el tema: James Fitzgerald (HSS/MT) fitzgerj@paho. org José Daniel Peña (OPS-CHI) penaj@chi. ops-oms. org María Luz Pombo (HSS/MT) pombomar@paho. org José María Parisi (HSS/MT) parisijo@paho. org Murilo Freitas Dias (HSS/MT) freitasm@paho. org Christophe Rerat (OPS-BRA) reratchr@paho. org Organización Panamericana De la Salud
 Funciones de las autoridades locales
Funciones de las autoridades locales Retos y limites de las autoridades
Retos y limites de las autoridades Fortalecimiento de la valoración de la sexualidad
Fortalecimiento de la valoración de la sexualidad Fortalecimiento patrimonial
Fortalecimiento patrimonial Proteinas reguladoras
Proteinas reguladoras Normas reguladoras de mineração
Normas reguladoras de mineração Pierre jeannerette
Pierre jeannerette Sustancias reguladoras
Sustancias reguladoras Secuencias reguladoras
Secuencias reguladoras Ilustracin
Ilustracin Autoridades intelectuales
Autoridades intelectuales Autoridad espiritual resumen
Autoridad espiritual resumen Textos de autoridad
Textos de autoridad Catastro9
Catastro9 Resolución 1619 de 2015
Resolución 1619 de 2015 Sistema de cuentas nacionales ecuador
Sistema de cuentas nacionales ecuador Trayectorias formativas
Trayectorias formativas Escuelas nacionales preparatorias
Escuelas nacionales preparatorias Sopas ligadas
Sopas ligadas Simbolos patrios y nacionales de nicaragua
Simbolos patrios y nacionales de nicaragua Normas nacionales e internacionales
Normas nacionales e internacionales Impuestos nacionales
Impuestos nacionales 20 ejemplos de sindicatos
20 ejemplos de sindicatos Lineamientos curriculares nacionales
Lineamientos curriculares nacionales Epoca moderna caracteristicas
Epoca moderna caracteristicas Surgimiento de los estados nacionales
Surgimiento de los estados nacionales Normas de regulacion de fecundidad
Normas de regulacion de fecundidad Wyd madrid 2011
Wyd madrid 2011 Microsoft windows small business server 2011 essentials
Microsoft windows small business server 2011 essentials Small business server 2011 end of life
Small business server 2011 end of life The practice of public relations fraser p. seitel pdf
The practice of public relations fraser p. seitel pdf Uma equipe de cientistas lançará uma expedição
Uma equipe de cientistas lançará uma expedição Per-30/pb/2011
Per-30/pb/2011























































