SISTEMA DE RECONOCIMIENTO DE AUTORIDADES REGULADORAS Calificacin OMSOPS
























- Slides: 30

SISTEMA DE RECONOCIMIENTO DE AUTORIDADES REGULADORAS Calificación OMS/OPS: Impacto sobre el desempeño de la Autoridad Reguladora Nacional de Cuba X CONFERENCIA DE LA RED PARF Buenos Aires, Argentina, 17 -19 Nov. 2008

TEMAS A TRATAR: Ø Sistema Regulador Cubano. Ø CECMED: Información General. Ø Experiencia del CECMED en las evaluaciones de OMS/OPS. Ø Impacto de las evaluaciones de OMS/OPS en el desarrollo institucional del CECMED. Ø Recomendaciones para OMS/OPS y para las Autoridades Reguladoras Nacionales.

SISTEMA REGULADOR EN CUBA MINISTERIO DE SALUD PÚBLICA Buró Regulatorio para la Protección de la Salud (BRPS) Agencia Nacional de Vigilancia Sanitaria con mandato del Ministerio de Salud Pública, para garantizar la protección de la Salud de la población mediante el ejercicio de la regulación, el control y la fiscalización de productos y servicios. Política Farmacéutica Nacional Res. Ministerial No. 170/2000 Resolución No. 228 / 96 Ministro de Economía y Planificación Resolución No. 132 / 96 Ministro de Salud Pública

MINISTRO DE SALUD PÚBLICA BURÓ REGULATORIO PARA LA PROTECCIÓN DE LA SALUD Dirección General CECMED CDF CCEEM DEPENDENCIAS PROVINCIALES INHA

CENTRO PARA EL CONTROL ESTATAL DE LA CALIDAD DE LOS MEDICAMENTOS. (CECMED) Creado en 1989 mediante Resolución Ministerial No. 73 (Ministro de Salud Pública) como la Autoridad Nacional Reguladora de Medicamentos y Diagnosticadores. Mandato: Garantizar la protección de la salud pública a través de un sistema de regulación, control y fiscalización sanitario para asegurar la calidad, seguridad y eficacia de medicamentos y medios de diagnostico in vitro.

Industria Biotecnológica Cubana Vacunas de calidad asegurada. FINLAY I. Vacuna Antimeningococcica BC Vac. Antihepatitis B rec. (PC/OMS) Vac. Haemophilus influenzae type b CIGB Vacunas combinadas (DPT, HB-Hib, DPT-HB, DPT-HB + Hib, DPT-HBHib) Toxoide Tetánico (TT) Bio. Cen Vac. Antitifoidica (Vac. Tivi) Vacuna Bi y trivalente contra la Leptospirosis

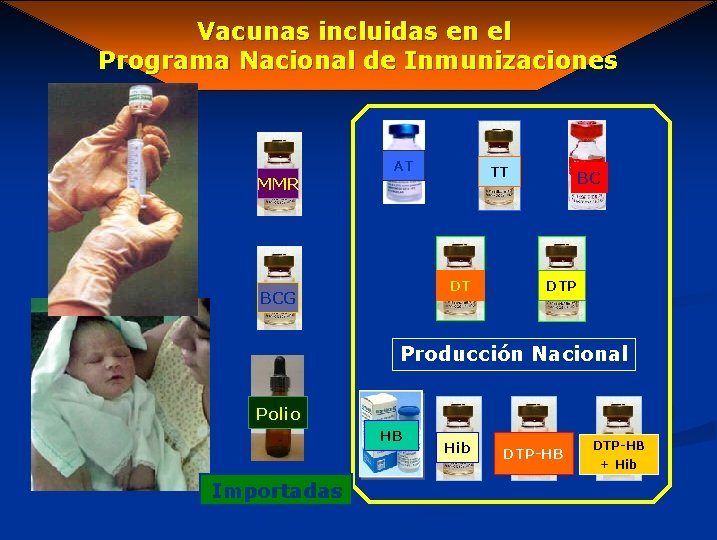
Vacunas incluidas en el Programa Nacional de Inmunizaciones MMR AT TT DT BCG BC DTP Producción Nacional Polio HB Importadas Hib DTP-HB + Hib

Reglamentación de Vacunas: desarrollo en los organismos actuales de reglamentación farmacéutica WHO / V& B / 99. 10 ARN: Principales funciones. ARN: Efectiva y funcional. • Registro (licencia) de productos. • Base legal para todas las • Inspección y licencia de fabricantes y funciones. distribuidores. • Recursos humanos y financieros • Vigilancia Postcomercialización. suficientes. • Regulación de la promoción • Apropiada experiencia científica comercial. • Acceso a Laboratorios de • Autorización de ensayos clínicos. Control de Calidad.

SISTEMA REGULADOR DE VACUNAS: Funciones básicas. WHO / V& B / 98. 03 1. Requisitos para licencia (Registro sanitario) publicado. 2. Vigilancia del comportamiento de la vacuna en el terreno. 3. Sistema de liberación de lotes. 4. Uso de laboratorios de ensayos cuando sea necesario. 5. Inspecciones regulares para verificar Practicas Adecuadas de Fabricación. 6. Evaluación clínica.

Funciones críticas de control según el origen de la vacuna Origen de la vacuna Licencia (Registro) Vigilancia Organismo de las Naciones Unidas ü ü Adquisición ü ü Producción Liberación de Lotes ü ü Acceso al laboratorio ü ü Inspección BPF ü Evaluación Clínica ü

CECMED. Funciones Reguladoras. • Sistema Regulador. • Registro de Medicamentos. (Autorización de Comercialización) / Renovación y Modificaciones en el Registro de Productos. • Autorización, Inspección y Control de Ensayos Clínicos. (Certificación de Buenas Practicas Clínicas) • Liberación de lotes. (Vacunas y productos biológicos) • Laboratorio Nacional de Control. (Físico-Químico, Microbiológico y ensayos biológicos). • Inspección Farmacéutica Estatal. Licencias SLOF (Fabricantes, Distribuidores, Importadores y Exportadores) • Vigilancia Postcomercialización. (Sistema Nacional de Vigilancia incluyendo Eventos Adversos consecutivos a la Inmunización)

PROCESO DE CALIFICACION OMS/OPS ETAPA DE PREPARACIÓN: EXPERIENCIA DEL CECMED • • • Creación de un Grupo de Trabajo central y Subgrupos para cada Función Básica. Organización de la documentación técnica y legal por cada Función Básica. Auto evaluación usando indicadores actuales OMS/OPS para obtener un diagnostico por cada Función Básica. Auto identificación de brechas y fortalezas. Solución inmediatas y Plan de Acción (corto, mediano y largo plazo). Expediente para cada función con toda la información derivada de la auto evaluación según herramientas seleccionadas.

Evaluaciones de OMS/OPS al CECMED Fecha Objetivo Resultados 2000 Precalificación de la Vacuna cubana Anti. Hepatitis B recombinante Precalificación de la Vacuna Anti Hepatitis B rec. Resultados Satisfactorios. Todas las funciones reguladoras fueron implementadas. Identificación de oportunidades de mejora. Plan de desarrollo institucional. (IOM/PDI) 2002 Seguimiento Sistema Regulador Vacunas Resultados satisfactorios. (IOM/PDI) 2003 Evaluación integral al Sistema Regulador de Vacunas Resultados satisfactorios. (IOM/PDI) 2004 Evaluación integral al Sistema Regulador de Medicamentos Resultados satisfactorios. (IOM/PDI) 2005 Seguimiento Sistema Regulador Vacunas Resultados satisfactorios. (IOM/PDI) Próxima evaluación OMS/OPS: 24 al 28 de noviembre de 2008

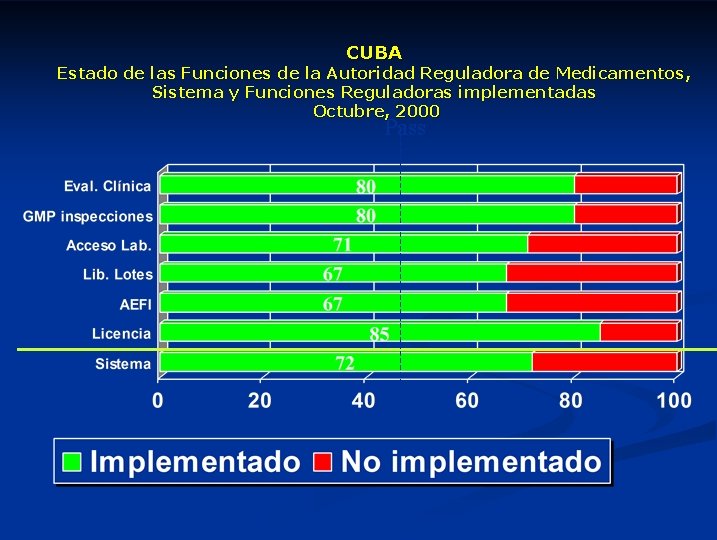
CUBA Estado de las Funciones de la Autoridad Reguladora de Medicamentos, Sistema y Funciones Reguladoras implementadas Octubre, 2000 Pass Percentage

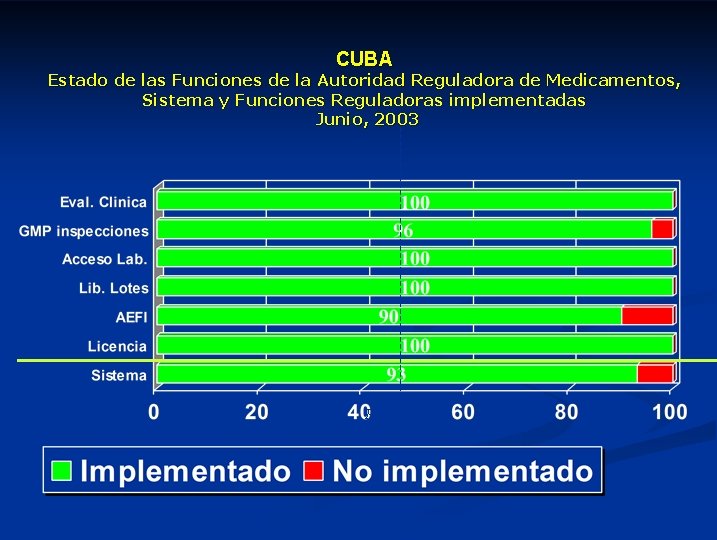
CUBA Estado de las Funciones de la Autoridad Reguladora de Medicamentos, Sistema y Funciones Reguladoras implementadas Junio, 2003 Percentage

CECMED: Resultados • Adquisición de conocimientos fruto del intercambio de experiencias entre especialistas del CECMED y expertos OMS/OPS. • Mejor aprovechamiento de las Funciones Básicas. • Procesos revisados completamente. • Lista de debilidades y fortalezas. • Estrategias para resolver las deficiencias. • Identificación de necesidades de capacitación. • Plan de Desarrollo institucional más objetivo. • Sistema Regulador de Vacunas y Medicamentos fortalecido.

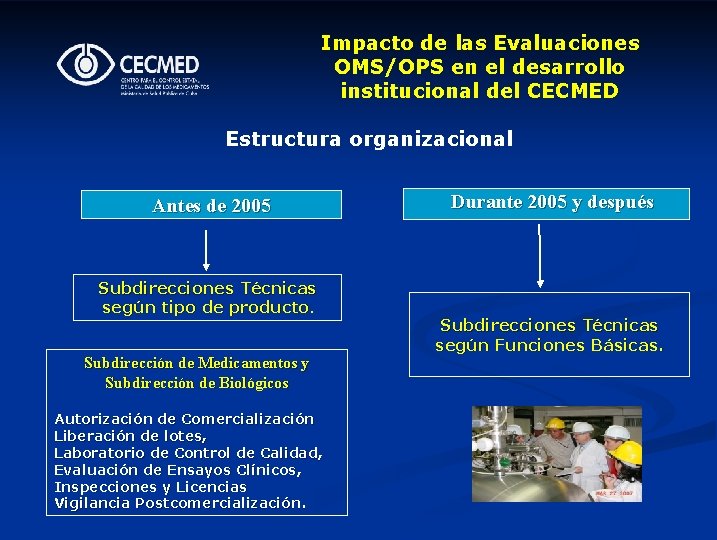
Impacto de las Evaluaciones OMS/OPS en el desarrollo institucional del CECMED Estructura organizacional Antes de 2005 Subdirecciones Técnicas según tipo de producto. Subdirección de Medicamentos y Subdirección de Biológicos Autorización de Comercialización Liberación de lotes, Laboratorio de Control de Calidad, Evaluación de Ensayos Clínicos, Inspecciones y Licencias Vigilancia Postcomercialización. Durante 2005 y después Subdirecciones Técnicas según Funciones Básicas.

En enero de 2005, la organización del CECMED fue modificada en conformidad con las Funciones Básicas Reguladoras OMS/OPS Subdirección de Autorizaciones Sanitarias • Registro de Medicamentos (Autorización de Comercialización) • Autorización de Ensayos Clínicos • Liberación de Lotes Subdirección de Inspección, Control y Vigilancia Postcomercialización • Laboratorio Nacional de Control • Inspección Farmacéutica • Vigilancia Postcomercialización

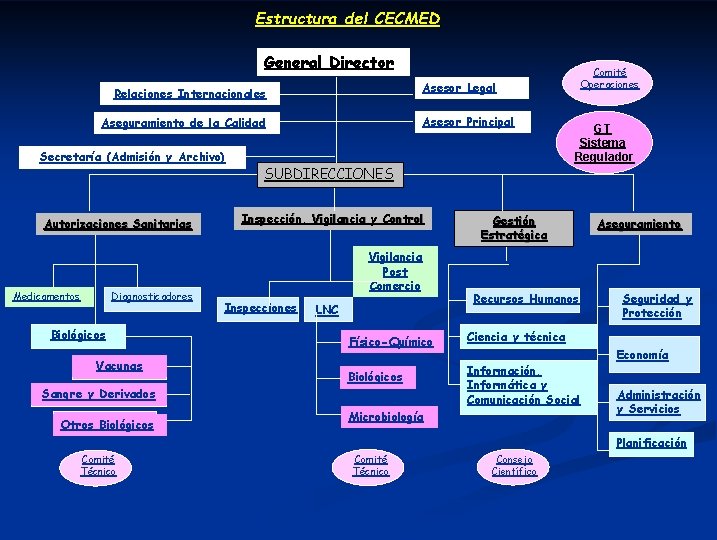
Estructura del CECMED General Director Asesor Legal Relaciones Internacionales Asesor Principal Aseguramiento de la Calidad Secretaría (Admisión y Archivo) Autorizaciones Sanitarias Diagnosticadores Medicamentos Biológicos Vacunas SUBDIRECCIONES Inspección, Vigilancia y Control Vigilancia Post Comercio Inspecciones LNC Físico-Químico Biológicos Sangre y Derivados Otros Biológicos Comité Operaciones GT Sistema Regulador Gestión Estratégica Recursos Humanos Aseguramiento Seguridad y Protección Ciencia y técnica Información, Informática y Comunicación Social Microbiología Economía Administración y Servicios Planificación Comité Técnico Consejo Científico

Impacto de las Evaluaciones de OMS/OPS sobre el CECMED Ø Consolidación del CECMED como ARN y soporte cualitativamente superior para la comercialización de los productos farmacéuticos nacionales y de importación. Ø Mayor apoyo gubernamental a las actividades del CECMED. Ø Participación de especialistas del CECMED en cursos de Red Global de Entrenamiento (GTN/OMS) y Cursos OPS para la región. Ø Incremento de la cooperación con OMS/OPS y otras ARNs: • Participación de especialistas del CECMED como parte del equipo OMS/OPS de calificación de ARNs. • Participación en la elaboración y revisión de las Guías de Evaluación OMS/OPS para ARNs. • Participación de especialistas del CECMED en la Red de Ensayos Clínicos. Precalificación OMS de Productos VIH SIDA y otros. • Precalificación OPS de Medicamentos.

Impacto de las Evaluaciones de OMS/OPS sobre el CECMED Ø Capacidad técnica para colaboración con OMS/OPS. Ø Coordinación del Grupo de Trabajo de Vacunas de la Red PARF en colaboración con OPS. Ø Colaboración con OPS en el proceso de Precalificación. Ø Contribución con OPS y las ANRs en Latinoamérica mediante cursos de entrenamientos en las funciones básicas reguladoras. Ø Mejoramiento de la colaboración con las Autoridades Reguladoras de Latinoamérica, participando en diferentes iniciativas regionales (Grupo Oaxaca) y EAMI. Ø Mejoramiento de la cooperación bilateral en el campo de productos biológicos. (Ejemplo, Comité Técnico ANVISA-CECMED). Ø Sistema de Gestión de la Calidad para las Funciones Básicas de regulación.

Sistema de Gestión de la Calidad para las Funciones Básicas de regulación. Nos complace informarle que ha sido aprobada la Certificación del Sistema de Gestión de la Calidad del Centro para el Control Estatal de Calidad de los Medicamentos, CECMED, subordinado al Ministerio de Salud Pública, para el alcance: - Servicios de desarrollo de legislación farmacéutica cubana, - Registro Sanitario de Medicamentos, - Liberación de lotes de productos, - Autorización de ensayos clínicos, - Inspección farmacéutica estatal, - Vigilancia post-comercialización de medicamentos y - Ensayos analíticos biológicos , físico-químicos y microbiológicos de medicamentos. Conforme a los requisitos de la Norma NC-ISO 9001: 2001, por acuerdo del Comité de Certificación del pasado 30 de octubre de 2008 y Resolución No. 224/2008, por lo que felicitamos a todo su colectivo de trabajadores, a la vez que los exhortamos a mantener y mejorar la eficacia demostrada en su gestión, en beneficio de sus clientes y de nuestra sociedad.

Sistema de Gestión de la Calidad para las Funciones Básicas de regulación. Certificado según ISO 9001: 2001 ONN: Oficina Nacional de Normalización de Cuba. AENOR: Asociación Española de Normalización y Certificación. IQNet: Red Internacional de Certificación.

Ejemplos de como han impactado las Evaluaciones OMS/OPS sobre el CECMED Elevación de la experticia técnica del personal/colaboración con OMS/OPS en la evaluación de otras ARNs. AÑO AUTORIDADES 2003 2004 2006 2007 2008 FDA, China Tailandia India COFEPRIS, México AIFA, Italia HPB, Canadá. ANVISA, Brasil

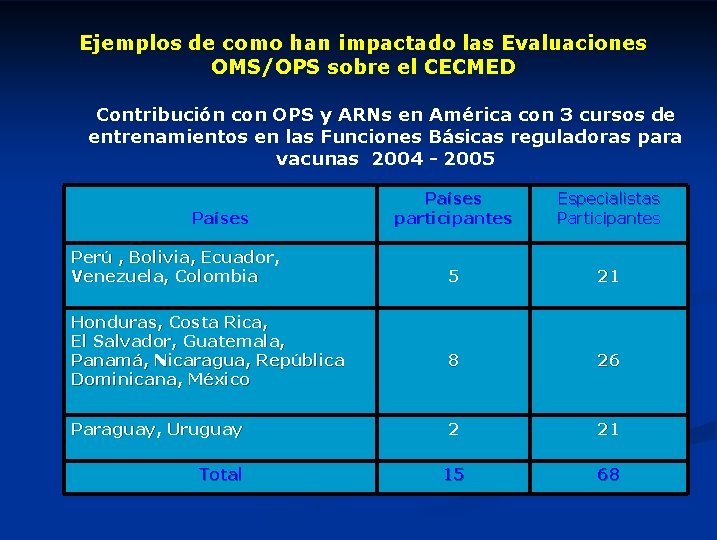
Ejemplos de como han impactado las Evaluaciones OMS/OPS sobre el CECMED Contribución con OPS y ARNs en América con 3 cursos de entrenamientos en las Funciones Básicas reguladoras para vacunas 2004 - 2005 Países participantes Especialistas Participantes Perú , Bolivia, Ecuador, Venezuela, Colombia CECMED-PAHO 5 Six basic function curses Honduras, Costa Rica, El Salvador, Guatemala, Panamá, Nicaragua, República Dominicana, México Paraguay, Uruguay Total 21 for Latin American NRA 8 26 2 21 15 68

CECMED Evaluaciones OMS/OPS: Lecciones aprendidas • Construcción y fortalecimiento de los Sistemas de Regulación y Control de Medicamentos y Vacunas. • Incremento de la capacidad de regulación sanitaria para asegurar la calidad, seguridad y eficacia. • Sistema de Gestión de la Calidad/Evaluación sistemática de la eficacia de los procesos basados en las 6 funciones básicas. • Las herramientas de OMS/OPS son muy útiles para identificar las brechas. • Cumplir los requisitos de la OMS/OPS promueve la confianza mutua entre las ARNs. • Transparencia y credibilidad de su desempeño. • Mayor confianza de la industria en los procesos regulatorios.

Recomendaciones para OPS • Evaluación de ARNs como un proceso independiente a la precalificación de medicamentos y vacunas. • Considerar como ARNs de Referencia de OPS (ARNr) a aquellas que resulten calificadas satisfactoriamente y reconocerlas oficialmente. • Asignar mayor participación y responsabilidad a las ARNr en el Comité Directivo y la Secretaria de PARF. • Evaluar mecanismos para mejorar las actividades entre ARNs tomando en consideración las fortalezas identificadas durante las evaluaciones y multiplicar sus beneficios. • Incrementar actividades de preparación de las ARNs en el aprovechamiento de sus auto inspecciones. • Promover Sistemas de Gestión de la Calidad en el desempeño de las ARNs

Recomendaciones para las ARNs • Asumir el mecanismo de evaluación de OPS y OMS de ARNs como una oportunidad de construir capacidades. • Usar las herramientas de evaluación de ARNs de OPS y OMS para conducir su auto evaluación, identificar brechas y elaborar Planes de Desarrollo Institucional. (PDI) • Actualizar sistemáticamente el PDI. • Aprovechar más los programas OPS/OMS de entrenamientos e intercambio de información. • Implementar Sistemas de Gestión de la Calidad que incorporen las Funciones Básicas de regulación recomendadas por OPS/OMS. • Implementar las Buenas Practicas Reguladoras.

Recomendaciones para las ARNs • Mejor uso de las recomendaciones de los Comités de Expertos OMS/OPS. • Promover el intercambio y mejor uso de las regulaciones proporcionadas por las ARNs con mayor desarrollo. • Promover la cooperación y el desarrollo de mecanismos para incrementar la confianza entre las ARNs. Ejemplo, Grupo Oaxaca. • Promover la convergencia y el incremento de la confianza entre ARNs y sus actividades de regulación. • Desarrollar iniciativas de regulación entre ARNs en correspondencia con las realidades de sus países.

MUCHAS GRACIAS
 Calificacin
Calificacin Linea reguladora arquitectura
Linea reguladora arquitectura Sustancias reguladoras
Sustancias reguladoras Proteinas reguladoras
Proteinas reguladoras Secuencias reguladoras
Secuencias reguladoras Nrm 1
Nrm 1 Quienes son las autoridades
Quienes son las autoridades Autoridades intelectuales
Autoridades intelectuales Retos y limites de las autoridades
Retos y limites de las autoridades Autoridades delegadas por dios
Autoridades delegadas por dios Autoridad de dios
Autoridad de dios Autoridades en españa y america
Autoridades en españa y america Clasificacion de propiedad planta y equipo
Clasificacion de propiedad planta y equipo Reconocimiento mutuo significado
Reconocimiento mutuo significado Otorga el presente
Otorga el presente Herramientas de reconocimiento
Herramientas de reconocimiento Palabras de reconocimiento
Palabras de reconocimiento Reconocimiento de inventarios
Reconocimiento de inventarios Reconocimiento del entorno
Reconocimiento del entorno Reconocimiento de patrimonio niif
Reconocimiento de patrimonio niif Reconocimiento educativo
Reconocimiento educativo Reconocimiento de valores
Reconocimiento de valores Reconocimiento de la moneda
Reconocimiento de la moneda Qué sentimiento profundo es indispensable
Qué sentimiento profundo es indispensable Reconocimiento del entorno
Reconocimiento del entorno Principios de una persona
Principios de una persona Nic 16 imagenes
Nic 16 imagenes Reconocimiento nic 12
Reconocimiento nic 12 Reconocimiento de la estructura textual
Reconocimiento de la estructura textual Reconocimiento de materiales peligrosos
Reconocimiento de materiales peligrosos Materiales amaya
Materiales amaya