17 Struktura a vlastnosti pevnch ltek Amorfn a

















- Slides: 18

17. Struktura a vlastnosti pevných látek Amorfní a krystalické látky, izotropie a anizotropie, monokrystal, polykrystal, krátkodosahové a dalekodosahové uspořádání, geometrická mřížka, ideální krystalová mřížka, (krystalografické soustavy), krychlová soustava, přehled hlavních typů vazeb v pevných látkách, kmity částic krystalové mřížky, poruchy krystalové mřížky (bodové a čárové). Vypracovala Ludmila Střechová, listopad 2007

1. KRYSTALICKÉ LÁTKY Ø Jsou charakterizovány pravidelným uspořádáním částic, z nichž jsou složeny Ø Vyskytují se ve dvou formách: monokrystaly polykrystaly

Monokrystaly Ø Mohou být: přírodní (např. : kamenná sůl, vápenec, křemen a jeho barevné odrůdy, diamant, granát, …) umělé (např. : křemík, germánium, …) Ø Částice jsou uspořádány pravidelně tak, že jejich určité rozložení se periodicky opakuje v celém krystalu - dalekodosahové uspořádání (=> některé monokrystaly mají pravidelný geometrický tvar) Ø Typickým znakem je anizotropie (viz níže)

Polykrystaly Ø Většina krystalických látek jsou polykrystaly Ø Skládají se z velkého počtu drobných krystalků – zrn (rozměr zrna: 10 μm – mm) uvnitř zrna jsou částice uspořádány pravidelně, vzájemná poloha zrn je nahodilá Ø Typickým znakem je izotropie (viz níže)

Izotropie (z řeckých slov isis = stejný, tropos = směr, způsob) Ø Určitá vlastnost těchto látek je ve všech směrech uvnitř látky stejná Ø Např. : kovová tyč se s rostoucí teplotou roztahuje do všech směrů stejně Ø Typické pro polykrystaly Anizotropie Ø Tyto látky mají některé fyz. vlastnosti závislé na směru vzhledem ke stavbě krystalu Ø Např. : kousek slídy se lehce štípe na tenké lístečky v určitých rovinách (rozdělit slídu ve směru kolmém k těmto rovinám je obtížné) Ø Typické pro monokrystaly

2. AMORFNÍ (BEZTVARÉ) LÁTKY Ø Látky, v nichž je periodické uspořádání omezeno na velmi malou vzdálenost Ø Mají strukturu, která se vyznačuje krátkodosahovým uspořádáním (kolem vybrané částice jsou částice k ní nejbližší rozloženy přibližně pravidelně, ale s rostoucí vzdáleností se tato pravidelnost porušuje) Ø Např. : pryskyřice, asfalt, vosk, sklo, … Ø Zvláštní skupinou amorfních látek jsou polymery (dlouhé makromolekuly polymerů jsou často navzájem propleteny, stočeny do klubek, vytvářejí sítě)

Vnitřní stavba krystalu Ø Trojrozměrná soustava rovnoběžek tvoří geometrickou mřížku. Ø Znám-li tvar a rozměry základního rovnoběžnostěnu a rozmístění částic v něm, je tím určena stavba krystalu jako celku

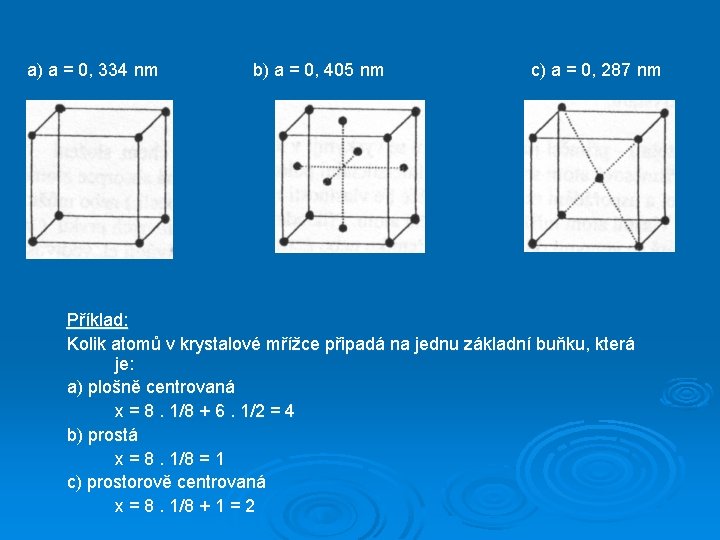
Ideální krystalová mřížka Ø Ideální kryst. mřížka vznikne sestavením velkého počtu základních buněk Základní krychle obsazená určitým způsobem částicemi se nazývá základní (elementární) buňka krystalu, který patří do krychlové (kubické) soustavy Ø Kubická základní buňka může být: prostá (obr. a) – vyskytuje se jen výjimečně plošně centrovaná (obr. b) – Al, Ni, Cu, Ag, Au, … prostorově centrovaná (obr. c) – Li, Na, K, Cr, W, … Ø Mřížkový parametr (mřížková konstanta) – a = délka hrany základní buňky Ø

a) a = 0, 334 nm b) a = 0, 405 nm c) a = 0, 287 nm Příklad: Kolik atomů v krystalové mřížce připadá na jednu základní buňku, která je: a) plošně centrovaná x = 8. 1/8 + 6. 1/2 = 4 b) prostá x = 8. 1/8 = 1 c) prostorově centrovaná x = 8. 1/8 + 1 = 2

Hlavní typy vazeb v pevných látkách 1. Iontová Ø Ø Iontové krystaly jsou značně tvrdé, ale křehké a štěpené podél rovin kolmých na hrany elementární buňky a mají poměrně vysokou teplotu tání Elektrický izolant (při běžné teplotě; při vyšších teplotách jsou elektricky vodivé) Pro viditelné světlo jsou většinou propustné Např. : alkalické halogenidy (Na. Cl, KBr) a oxidy alkalických zemin (Ca. O) 2. Vodíková (vodíkový můstek) Ø Spojuje např. : kyslíkové ionty v krystalu ledu vody, ale je častá i v organických látkách

3. Kovová Kovové krystaly mají velmi dobrou tepelnou a elektrickou vodivost, povrchový lesk, v tlustších vrstvách jsou neprůhledné. Nejsou štěpné a některé z nich se vyznačují dobrou kujností a tažností. Ø Např. : Cu, Fe, Al, W, … Ø Mřížka se skládá z 2 kladných iontů – mezi nimiž se pohybují neuspořádaným způsobem valenční elektrony – tzv. elektronový plyn Ø 4. Kovalentní (atomové) Všechny tyto krystaly jsou tvrdé, mají vysokou teplotu tání a jsou nerozpustné v běžných rozpouštědlech Ø Z elektrického hlediska patří mezi izolanty nebo polovodiče Ø Např. : diamant, germanium, křemík, karbid křemíku, … Ø

5. van der Waalsova Nízká teplota tání, jsou měkké Ø Např. : krystaly inertních plynů, organické sloučeniny Ø 6. Kovová a kovalentní Mimořádně tvrdé, těžko tavitelné, chemicky odolné Ø Např. : karbidy (např. wolframu a tantalu), nitridy, boridy Ø Pozn. : v reálných krystalech se nejčastěji uplatňuje více než jeden typ vazby (např. grafit – kovalentní + van der Waalsova vazba mezi vrstvami)

Poruchy krystalové mřížky Každý reálný krystal má ve své struktuře poruchy (defekty), které dělíme na bodové a čárové

Bodové poruchy a) Vakance Ø Poruchy vzniklé chybějícími částicemi v mřížce Ø Příčiny: kmitavý pohyb částice, který způsobí, že se částice uvolní ozáření krystalu neutrony v jaderném reaktoru vakance vznikají také při vzniku některých kovových slitin

b) Intersticiální poloha částice Projevuje se tím, že částice je v místě mimo pravidelný bod mřížky Ø Je-li touto částicí iont, přenáší při svém pohybu náboj a způsobuje tak elektrickou vodivost iontových krystalů Ø

c) Příměs (nečistota) Cizí částice, které se vyskytují v krystalu daného chemického složení Ø Může se vyskytovat: v intersticiální poloze (např. : snadná absorpce atomů C, jejichž počet a uspořádání může ovlivnit v mřížce Fe vlastnosti různých druhů oceli) nahrazovat vlastní částici mřížky – tzv. substituční atom (např. : atomy různých prvků (B, P), které se zpravují do čistého krystalu křemíku nebo germánia, a tím ovlivňují elektrickou vodivost látky) Ø

Čárové poruchy (dislokace) Ø Jedná se o přerušení pravidelného uspořádání podél určité čáry (tzv. dislokační čáry) Posunutí vrstvy hranovou dislokací: Látky s touto poruchou nejsou příliš pevné Ø Dislokace se dělí: → hranové dislokace → šroubové dislokace

Hranová x šroubová dislokace Dislokace se dělí na hranové a šroubové. Jsou to speciální případy smíšené dislokace. Obr. 4. 6. znázorňuje smyčku z translačních vektorů vedenou neporušenou oblastí krystalu tak, že ve dvou směrech je vytvořena stejným počtem kroků v kladném a záporném smyslu (Burgersova smyčka). Je zřejmé, že pro oblast krystalu bez dislokace se smyčka uzavře. Pro oblast krystalu s hranovou dislokací (obr. 4. 6 b) bude třeba smyčku uzavřít vektorem b, který se nazývá Burgersův vektor a který udává charakter dislokace. Pro hranovou dislokaci je Burgersův vektor kolmý na dislokační čáru (dislokační čára označená ┴ je kolmá k nákresně; přebývá-li polorovina v horní části krystalu nad skluzovou rovinou, označujeme dislokaci jako kladnou, přebývá-li polorovina pod skluzovou rovinou, je dislokace záporná). Burgersův vektor šroubové dislokace (obr. 4. 6 c) je s dislokační čárou rovnoběžný. V případě, že Burgersův vektor svírá s dislokační čárou úhel ležící mezi 0° a 90°, jedná se o dislokaci smíšenou.
 Ltek
Ltek Plasmorhiza
Plasmorhiza Ltek ex pro 2
Ltek ex pro 2 Ludk
Ludk Dzimumvairošanās
Dzimumvairošanās Struktura a vlastnosti kapalin test
Struktura a vlastnosti kapalin test Struktura a vlastnosti pevných látek test
Struktura a vlastnosti pevných látek test Struktura a vlastnosti kapalin příklady
Struktura a vlastnosti kapalin příklady Jevy na rozhraní pevného tělesa a kapaliny
Jevy na rozhraní pevného tělesa a kapaliny Co jsou to sulfidy
Co jsou to sulfidy Pracovní list magnetické vlastnosti látek 2 řešení
Pracovní list magnetické vlastnosti látek 2 řešení Psychické procesy
Psychické procesy Měď vlastnosti
Měď vlastnosti Rovnoběžník vlastnosti
Rovnoběžník vlastnosti Vlastnosti sportovce
Vlastnosti sportovce Karban chemie
Karban chemie Technologické vlastnosti dreva
Technologické vlastnosti dreva Lichobeznik
Lichobeznik Vlastnosti pevných látok
Vlastnosti pevných látok