Vesinikside Katrin Soika GAG Kovalentne polaarne side 1


- Slides: 10

Vesinikside Katrin Soika GAG

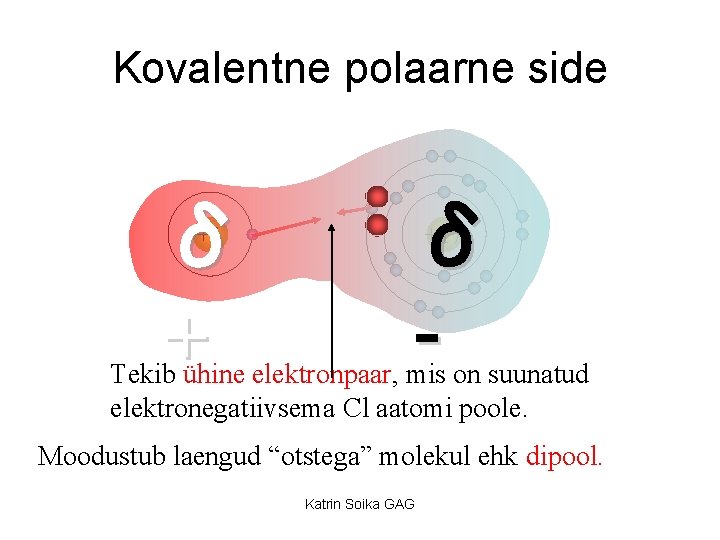
Kovalentne polaarne side δ + +1 δ +17 Tekib ühine elektronpaar, mis on suunatud elektronegatiivsema Cl aatomi poole. Moodustub laengud “otstega” molekul ehk dipool. Katrin Soika GAG

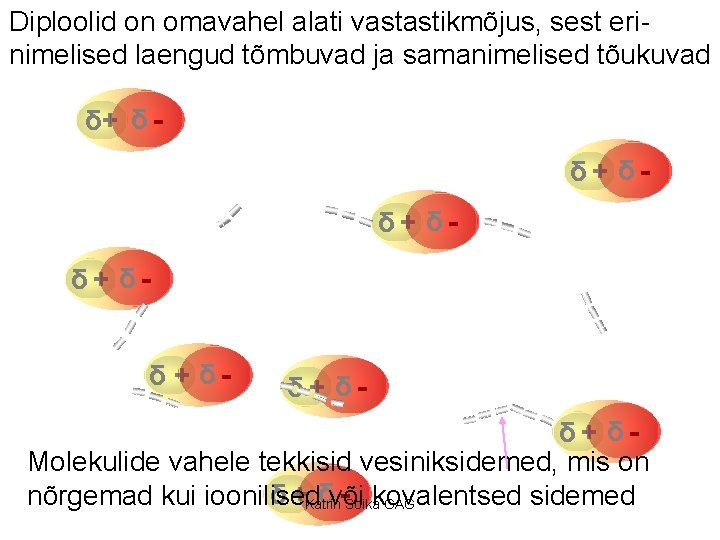
Diploolid on omavahel alati vastastikmõjus, sest erinimelised laengud tõmbuvad ja samanimelised tõukuvad δ+ δδ+ δδ + δ- δ+ δMolekulide vahele tekkisid vesiniksidemed, mis on δvõi -Soikakovalentsed δ +Katrin nõrgemad kui ioonilised sidemed GAG

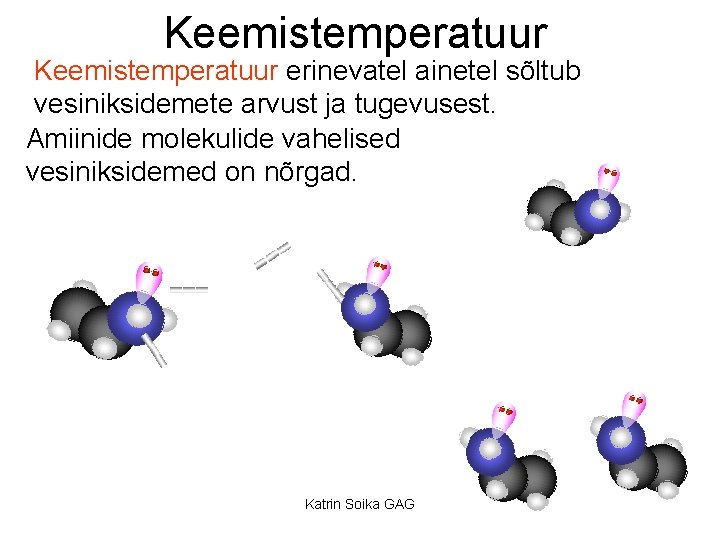
Keemistemperatuur erinevatel ainetel sõltub vesiniksidemete arvust ja tugevusest. Amiinide molekulide vahelised vesiniksidemed on nõrgad. Katrin Soika GAG

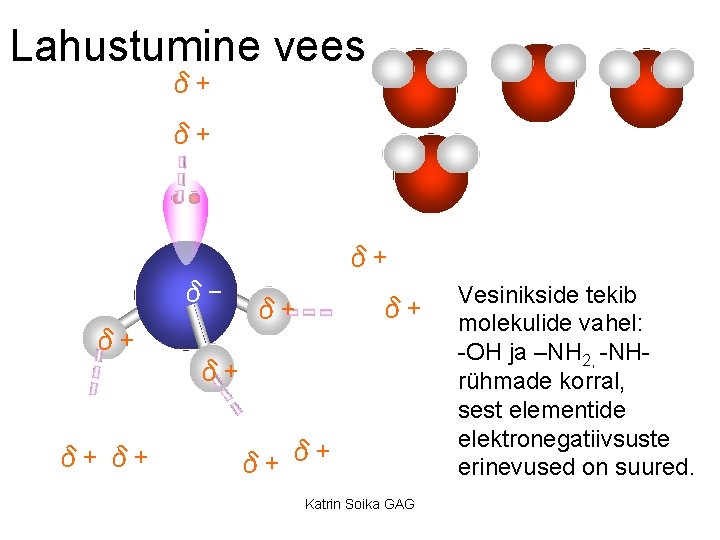
Lahustumine vees δ+ δ-δ+ δ+ δδ+ δ+ Katrin Soika GAG Vesinikside tekib molekulide vahel: -OH ja –NH 2, -NHrühmade korral, sest elementide elektronegatiivsuste erinevused on suured.

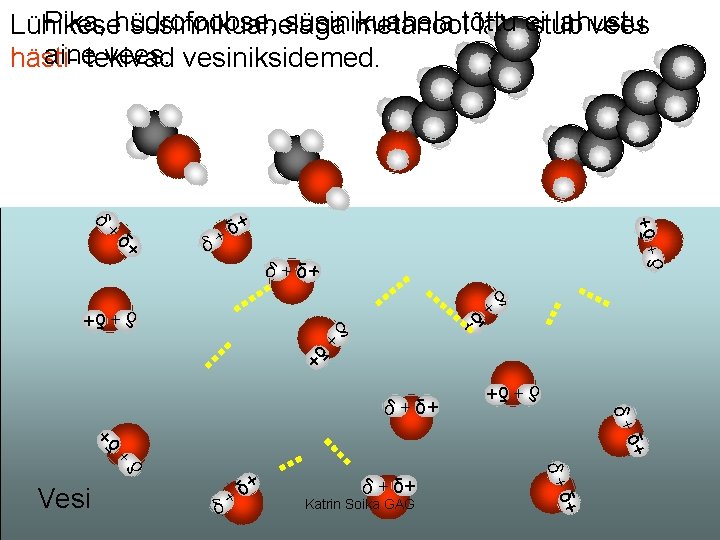
Pika, hüdrofoobse, süsinikuahela ei lahustu Lühikese süsinnikuahelaga metanooltõttu lahustub vees ainetekivad vees. vesiniksidemed. hästi- δ+ + δ+ δ + δ δ+ δ+ δ+ δ + δ+ δ+ + Katrin Soika GAG δ δ+ Vesi + δ

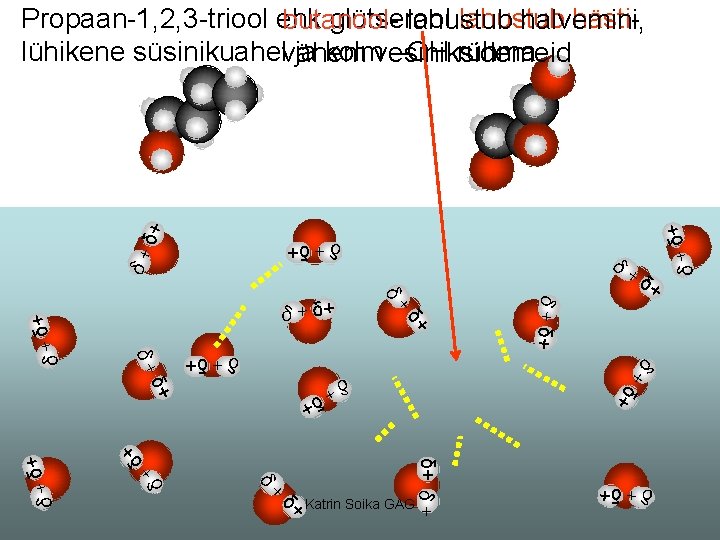
δ+ δ+ + + δ δ+ δ+ δ δ+ + + δ+ δ+ + δ +δ δ+ δ+ δ+ δ δ+ Katrin Soika GAG δ+ δ+ + δ δ+ δ+ δ +δ δ+ δ+ δ+ δ + Propaan-1, 2, 3 -triool ehk glütserool lahustub hästibutanoollahustub halvemini, lühikene süsinikuahelvähem ja kolmvesiniksidemeid –OH rühma

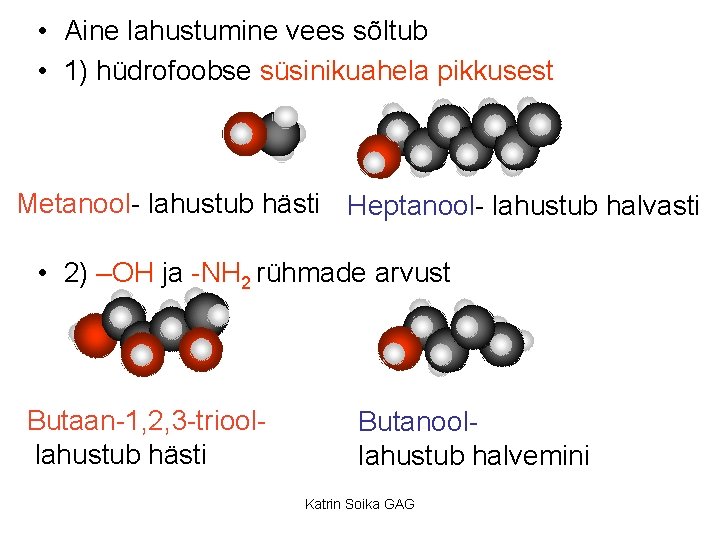
• Aine lahustumine vees sõltub • 1) hüdrofoobse süsinikuahela pikkusest Metanool- lahustub hästi Heptanool- lahustub halvasti • 2) –OH ja -NH 2 rühmade arvust Butaan-1, 2, 3 -trioollahustub hästi Butanoollahustub halvemini Katrin Soika GAG

vesi + metanool= metanooli vesilahus heptanool vesi heptanool metanool Katrin Soika GAG

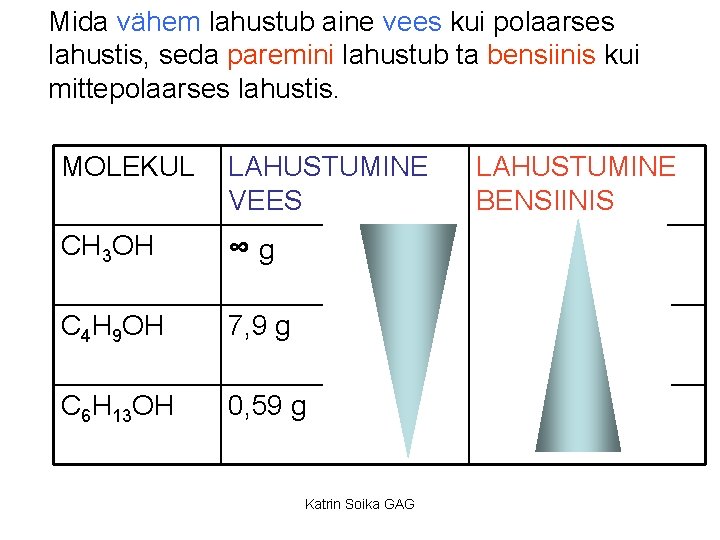
Mida vähem lahustub aine vees kui polaarses lahustis, seda paremini lahustub ta bensiinis kui mittepolaarses lahustis. MOLEKUL LAHUSTUMINE VEES CH 3 OH ∞g C 4 H 9 OH 7, 9 g C 6 H 13 OH 0, 59 g Katrin Soika GAG LAHUSTUMINE BENSIINIS
















