UNIWERSYTET MIKOAJA KOPERNIKA Pracownia Dydaktyki Fizyki ELEMENTY MECHANIKI
































- Slides: 36

UNIWERSYTET MIKOŁAJA KOPERNIKA Pracownia Dydaktyki Fizyki ELEMENTY MECHANIKI KWANTOWEJ Paweł Sankowski MSN Toruń 2006

SPIS TREŚCI 1. Po co się uczyć fizyki kwantowej? 2. Narodziny i rozwój teorii kwantów 2. 1. Hipoteza Plancka 2. 2. Zjawisko fotoelektryczne zewnętrzne 2. 3. Fale de’Brogliea 2. 4. Zasada nieoznaczoności Heisenberga 3. Postulaty mechaniki kwantowej 4. Atom wodoru – opis kwantowy 5. Zakończenie 6. Bibliografia

1. Po co się uczyć fizyki kwantowej? Wielki sukces fizyki kwantowej wiąże się z prawidłowym opisem następujących zjawisk: dyfrakcja, interferencja światła i strumieni cząstek (podstawa optyki kwantowej, elektrodynamiki kwantowej); szczegóły atomowej budowy materii, zwłaszcza struktury elektronowej pierwiastków (podstawa chemii kwantowej, fizyki ciała stałego); zjawiska rozpraszania i zderzeń w skali atomowej i subatomowej (podstawa fizyki jądrowej, fizyki cząstek elementarnych, kwantowej teorii pola, elektrodynamiki kwantowej, chromodynamiki kwantowej, standardowego modelu oddziaływań fundamentalnych); mikroskopowego opisu zjawisk transportu (przewodnictwo prądu w metalach i półprzewodnikach); zjawisk kolektywnych w skali makroskopowej (nadciekłość, nadprzewodnictwo, kondensacja Bosego-Einsteina, magnetyzm)

2. Narodziny i rozwój teorii kwantów Fizyka kwantowa narodziła się w raz z pojęciem kwantu jako elementarnej porcji pewnej wielkości fizycznej. Jako pierwszy istnienie kwantu energii zapostulował Planck. W następnych latach ruszyła lawina kolejnych odkryć: - 1901 Planck - promieniowanie ciała doskonale czarnego - 1905 Einstein - zjawisko fotoelektryczne - 1913 Bohr - kwantowa teoria widm - 1922 Compton - rozpraszanie fotonów na elektronach - 1924 Pauli - zakaz Pauliego - 1925 de Broglie - fale materii - 1926 Schrodinger - równanie falowe - 1927 Heisenberg - zasada nieoznaczoności - 1927 Davisson i Germer - własności falowe elektronu - 1927 Born - interpretacja funkcji falowej

2. 1. Hipoteza Planck starał się odnaleźć zależność pomiędzy temperaturą ciała doskonale czarnego, a gęstością energii jego promieniowania. Prowadził w tym celu zarówno doświadczenia, jak i wyliczenia teoretyczne. Klasyczny wzór Rayleigh-Jeansa zgadzał się z doświadczeniem tylko dla dużych długości fali, natomiast dla małych odbiegał znacznie od danych doświadczalnych. Niezgodność ta nosi nazwę katastrofy w nadfiolecie. Otrzymanie wzoru zgodnego z wynikami doświadczeń wymagało wprowadzenia rewolucyjnego założenia, że energia emitowana bądź pochłaniana przez ciało jest skwantowana tzn. rozchodzi się w postaci porcji, paczek. Oznaczało to w praktyce, że energia jest wielkością nieciągłą i może się zmieniać tylko o ustalony skok. Wielkość tego skoku Planck wyznaczył matematycznie, wprowadzając nową stałą przyrody - h, nazwana stałą Plancka. Wielkość stałej Plancka jest mała i wynosi h =6, 62606876∙ 10 -34 Js.

2. 2. Zjawisko fotoelektryczne zewnętrzne Zjawisko fotoelektryczne zostało odkryte w 1887 roku przez Heinrich Hertz, jednak nikt wówczas nie potrafił wyjaśnić tego zjawiska. W wyniku prowadzonych eksperymentów fizycy zaobserwowali, że pod wpływem działania światła na fotokatodę w skonstruowanym przez nich obwodzie pojawia się prąd elektryczny. Wnioskowali, że jest to efekt wybijania elektronów z materiału katody i stwierdzili, że dzieje się tak na skutek przekazania przez falę świetlną energii kinetycznej elektronom w materiale katody. Jednak sama natura zjawiska nadal wydawała się dość niejasna. W 1905 roku Albert Einstein założył (podobnie jak wcześniej Planck), że światło rozchodzi się w postaci elementarnych kwantów o energii takiej, jaka wynika ze wzoru Plancka. Te kwanty nazwał fotonami i przypisał im własności cząstek takie jak energię i pęd, przy czym założył, że masa spoczynkowa fotonu jest równa zeru. Matematyczna interpretacja zjawiska przez Einsteina wygląda następująco:

W zjawisku fotoelektrycznym energia kinetyczna wybitych elektronów zależy wyłącznie od częstotliwości padającego promieniowania, natomiast ilość wybitych elektronów od natężenia padającego promieniowania. Pojedynczy elektron jest w stanie zaabsorbować jeden foton. Jeżeli energia tego fotonu jest mniejsza od pracy wyjścia to elektron nie opuści metalu. Jeśli jest większa to elektron opuści metal z pewną energią kinetyczną.

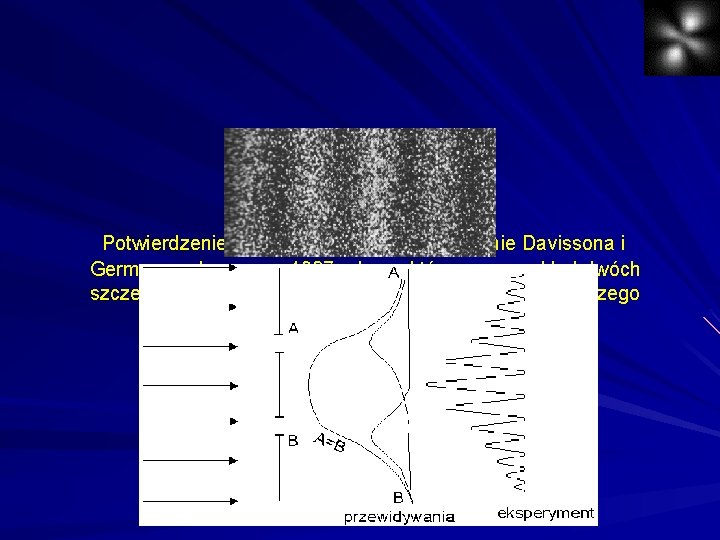
2. 3. Fale de’Brogliea W 1925 roku francuski uczony Louis de Broglie wysunął niezwykle kontrowersyjną jak na owe czasy hipotezę, która cząstkom przypisywała własności falowe. O ile Planck 23 lata wcześniej swoją koncepcję przypisującą falom własności cząstek oparł na wynikach licznych obserwacji i doświadczeń, o tyle hipoteza de Broglie'a miała charakter czysto teoretyczny. Wyszedł on bowiem z założenia, że przyroda jest zadziwiająco symetryczna, wszechświat składa się wyłącznie ze światła i z materii, jeżeli światło ma dwoistą falowo-cząstkową naturę, być może materia też ma taką naturę. De Broglie założył, że długość przewidzianych fal materii jest określana tym samym związkiem który odnosi się do światła, wiążącym długość fali świetlnej (własność falową) z pędem fotonów (własnością cząstkową). Już rok później pojawiły się pierwsze pomysły na zbadanie falowych własności materii. Długość fali de Broglie’a przedstawia równanie:

Potwierdzeniem tego faktu było doświadczenie Davissona i Germera wykonane w 1927 roku, w którym przez układ dwóch szczelin przepuszczano pojedyncze elektrony w wyniku czego otrzymano obraz interferencyjny.

2. 4. Zasada nieoznaczoności Heisenberga Werner Heisenberg jako pierwszy sformułował problem dokładności obserwacji. W świecie makroskopowym sam fakt obserwowania nie zakłóca ruchu cząstek (ponieważ mają odpowiednio dużą masę w porównaniu ze stałą Plancka), o tyle w odniesieniu do elektronów sam fakt obserwacji wprowadza istotne zakłócenie trajektorii badanej cząstki. Dzieje się tak dlatego, ponieważ żeby dokonać obserwacji musimy "odbić" od elektronu światło, zaś każdy uderzający w elektron foton znacznie zakłóca jego rzeczywisty ruch. Heisenberg w 1925 roku ogłosił, że jeśli uda nam się dokładnie określić pęd cząstki, wówczas nic nie będziemy wiedzieć o jej rzeczywistym położeniu i vice versa. Im dokładniejszy pomiar jednej wielkości, tym bardziej "rozmyty" pomiar drugiej. Dwa lata później hipotetyczne stwierdzenie Heisenberga znalazło matematyczne potwierdzenie w ogłoszonej przez niego zasadzie nieoznaczoności, w której powiązał on pęd i położenie cząstek ze stałą Plancka, ukazując głęboki sens tej ostatniej, jako stałej określającej nasze możliwości pomiarowe. Matematyczna postać zasady nieoznaczoności Haisenberga ma postać:

Przykładowo jeżeli mamy cząstkę swobodna poruszającą się w jednym wymiarze, to ponieważ nie działa na nią żadna siła jej pęd jest stały. Wówczas Założenie to wymaga aby Położenie cząstki jest wobec tego nieokreślone.

3. Postulaty mechaniki kwantowej Postulat 1 („o funkcji falowej”) Stan układu kwantowo-mechanicznego o f stopniach swobody określa funkcja falowa ( nazywana też funkcją stanu ) taka, że oznacza prawdopodobieństwo, że w chwili czasu t wartości współrzędnych zawarte są w przedziałach od q 1 do q 1+dq 1, …, od qf do qf+dqf.

Postulat 2 („o operatorach”) Każdej zmiennej dynamicznej A przyporządkowujemy pewien operator. Operatory tworzy się za pomocą reguł Jordana.

Postulat 3 („o równaniu Schrődingera”) Funkcja falowa spełnia równanie Schrődingera zależne od czasu gdzie jest operatorem energii całkowitej danego układu zwanym operatorem Hamiltona, hamiltonianem.

Postulat 4 („o zagadnieniu własnym”) Wynikiem pomiaru zmiennej dynamicznej A mogą być tylko wartości własne odpowiadającego jej operatora : Jeżeli hamiltonian nie zależy od czasu to funkcje falowe opisują stany stacjonarne czyli takie, w których gęstość prawdopodobieństwa nie zależy od czasu. Funkcje falowe odpowiadające stanom stacjonarnym spełniają równanie Schrődingera niezależne od czasu:

Postulat 5 („o wartości średniej”) Jeśli układ kwantowo-mechaniczny znajduje się w stanie opisywanym funkcją falową , (która nie jest funkcją własną operatora przyporządkowanego zmiennej dynamicznej A) to średnia wartość zmiennej A w tym stanie wynosi: W przypadku obliczania wartości średniej lub prawdopodobieństwa funkcje muszą być unormowane.

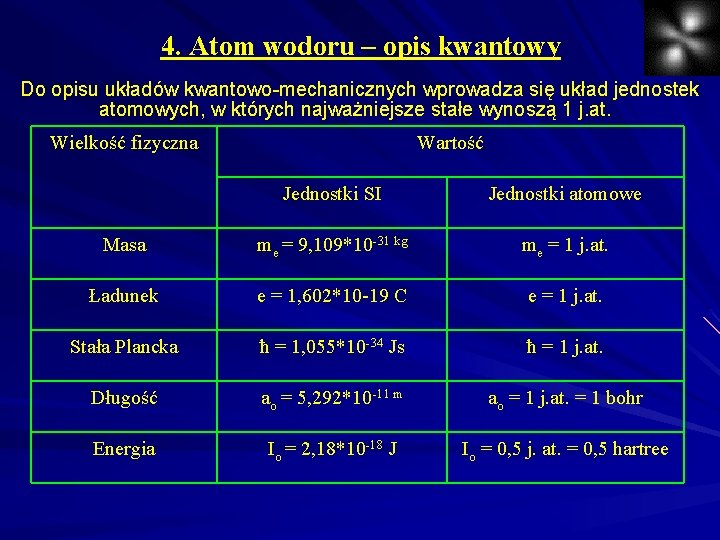
4. Atom wodoru – opis kwantowy Do opisu układów kwantowo-mechanicznych wprowadza się układ jednostek atomowych, w których najważniejsze stałe wynoszą 1 j. at. Wielkość fizyczna Wartość Jednostki SI Jednostki atomowe Masa me = 9, 109*10 -31 kg me = 1 j. at. Ładunek e = 1, 602*10 -19 C e = 1 j. at. Stała Plancka ħ = 1, 055*10 -34 Js ħ = 1 j. at. Długość ao = 5, 292*10 -11 m ao = 1 j. at. = 1 bohr Energia Io = 2, 18*10 -18 J Io = 0, 5 j. at. = 0, 5 hartree

Atom wodoru traktujemy jako nieruchome jądro (proton) i poruszający się wokół niego elektron. Operator energii potencjalnej i kinetycznej wynoszą: Równanie Schrődingera niezależne od czasu opisujące elektron ma postać: Explicite,

Żeby rozwiązać to równanie należy przejść to współrzędnych sferycznych. Można udowodnić, że równanie ma rozwiązanie o żądanych własnościach w następujących przypadkach: E > 0 – gdy elektron przelatuje w pobliżu jądra i oddala się do nieskończoności, E < 0 – odpowiada elektronowi związanemu z jądrem. Energia związanego elektronu wyraża się następująco:

Funkcje własne równania Schrődingera zawierają trzy parametry Parametr n nazywamy główną liczbą kwantową, równy jest numerowi poziomu energii. Parametry l i m są to poboczna i magnetyczna liczby kwantowe, określające moduł momentu pędu i jego rzut na pewien kierunek z. Rozwiązania równania można otrzymać tylko dla następujących wartości liczb kwantowych: n = 1, 2, 3… główna liczba kwantowa l = 0, 1, . . , (n-1) poboczna liczba kwantowa m = -l, -l+1, …, l-1, l magnetyczna liczba kwantowa

Funkcja falowa dla stanu podstawowego atomu wodoru wygląda następująco: gdzie: jest promieniem pierwszej orbity Bohra.

Kwadrat modułu funkcji falowej określa prawdopodobieństwo znalezienia elektronu przypadającym na jednostkę objętości. We współrzędnych sferycznych łatwo pokazać, że: Opisywanie prawdopodobieństwa wykrycie elektronu jest prostsze, jeśli zamiast objętościowej gęstości prawdopodobieństwa rozważymy radialną gęstość prawdopodobieństwa Prad(r):

Wykres pokazuje wyraźnie, że elektron może znajdywać się w różnej odległości wokół jądra z różnym prawdopodobieństwem. Największe prawdopodobieństwo wykrycia elektronu znajduje się w odległości 1 bohra. Natomiast rozkład gęstości prawdopodobieństwa przedstawia następujący rysunek, który może pomóc w wyobrażeniu sobie „chmury elektronowej” atomu. Rozkład gęstości prawdopodobieństwa stanu 1 s (n=1, l=0, m=0)

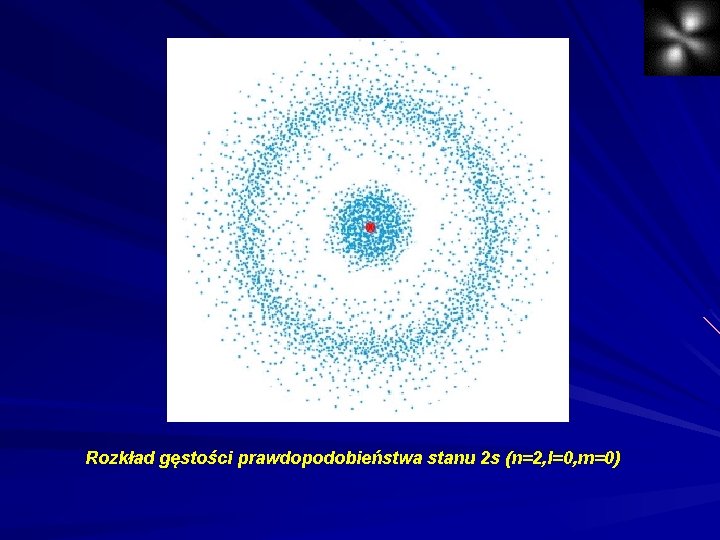
Rozkład gęstości prawdopodobieństwa stanu 2 s (n=2, l=0, m=0)

Rozkład gęstości prawdopodobieństwa stanu 2 po, 2 p 1, 2 p-1

W przypadku wzrostu głównej liczbie kwantowej przewidywania fizyki kwantowej gładko przechodzą w przewidywania fizyki klasycznej. Dla atomu wodoru o głównej liczbie kwantowej n=45 radialna gęstość prawdopodobieństwa widoczna na rysunku 8 sugeruje istnienie orbity elektronu w sensie klasycznym. Rozkład radialnej gęstości prawdopodobieństwa dla n=45 i l=44.

5. Podsumowanie Fizyka kwantowa pokazuje nam obraz świata zupełnie inny od tego, do którego przywykliśmy. Mikroświatem rządzą nowe prawa. Przyroda ukrywa przed nami swoją naturę i pozwala jedynie na probabilistyczny opis zjawisk. Pomimo ograniczeń na możliwości pomiaru fizyka kwantowa świetnie sobie radzi z opisem prostych układów jak atom wodoru czy proste cząsteczki. Opis kwantowy wymyka się nam jednak w przypadku obiektów bardziej złożonych. Fizycy muszą sięgać po przybliżenia i metody numeryczne w celu obliczenia większych struktur. Okazuje się, że im bardziej złożony staje się obiekt tym trudności obliczeniowe rosną wykładniczo. Problemem staje się szybkość obliczeniowa komputerów. Typowe obliczenia kwantowe przeprowadza się obecnie na coraz lepszym sprzęcie a i tak czas takich obliczeń sięga w tygodnie. Pomimo tych wielu problemów fizyka kwantowa rozwija się dalej i daje nam nowe pojęcie na otaczającą nas rzeczywistość. „Nikt nie rozumie teorii kwantowej. ” Richard Feynman

ATOM PO JAPOŃSKU

POWIERZCHNIA KRZEMU

UKŁADANKI I STRUKTURY ATOMÓWE

UKŁADANKI I STRUKTURY ATOMÓWE

UKŁADANKI I STRUKTURY ATOMÓWE

UKŁADANKI I STRUKTURY ATOMÓWE

UKŁADANKI I STRUKTURY ATOMÓWE

UKŁADANKI I STRUKTURY ATOMÓWE

KONIEC
 Kópernika
Kópernika Dział mechaniki klasycznej
Dział mechaniki klasycznej Szafirowa pracownia
Szafirowa pracownia Biznes plan pracownia florystyczna
Biznes plan pracownia florystyczna Pracownia alchemiczna
Pracownia alchemiczna Skrzypczyński pracownia
Skrzypczyński pracownia Pracownia ekonomiczna
Pracownia ekonomiczna Prawo pascala
Prawo pascala Shutter
Shutter Katedra fizyki prz
Katedra fizyki prz Praw fizyki pan nie zmienisz
Praw fizyki pan nie zmienisz Pwr strefa otwartej nauki
Pwr strefa otwartej nauki Instytut fizyki uj
Instytut fizyki uj Instytut fizyki umk
Instytut fizyki umk Koszykowa 75 warszawa
Koszykowa 75 warszawa Logistyka studia opole
Logistyka studia opole Najstarszy uniwersytet w polsce
Najstarszy uniwersytet w polsce Www.irk.uksw.edu.pl
Www.irk.uksw.edu.pl Katolicki uniwersytet lubelski
Katolicki uniwersytet lubelski Uniwersytet trzeciego wieku uj
Uniwersytet trzeciego wieku uj Uniwersytet rzeszowski wydział wychowania fizycznego
Uniwersytet rzeszowski wydział wychowania fizycznego Utw rzeszów
Utw rzeszów Ifa uni opole
Ifa uni opole Budowa książki - prezentacja dla dzieci
Budowa książki - prezentacja dla dzieci Architektura komputera prezentacja
Architektura komputera prezentacja Co to jest
Co to jest Zdania wielokrotnie złożone przykłady
Zdania wielokrotnie złożone przykłady Jak poprawnie napisać opowiadanie
Jak poprawnie napisać opowiadanie Dwie sciany prostopadloscianu to kwadraty o boku 2.5 cm
Dwie sciany prostopadloscianu to kwadraty o boku 2.5 cm Zalety mięsa ze znakiem jakości qafp
Zalety mięsa ze znakiem jakości qafp Elementy sieci komputerowej
Elementy sieci komputerowej Elementy decyzji administracyjnej
Elementy decyzji administracyjnej Rozprawka co to
Rozprawka co to Rzezba mlodoglacjalna a staroglacjalna
Rzezba mlodoglacjalna a staroglacjalna Jakie wyróżniamy kody barwne?
Jakie wyróżniamy kody barwne? Iso 1101:2012
Iso 1101:2012 Elementy zestawu komputerowego
Elementy zestawu komputerowego