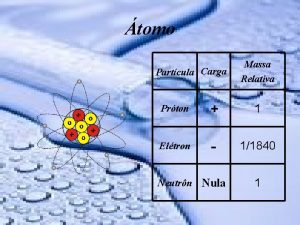
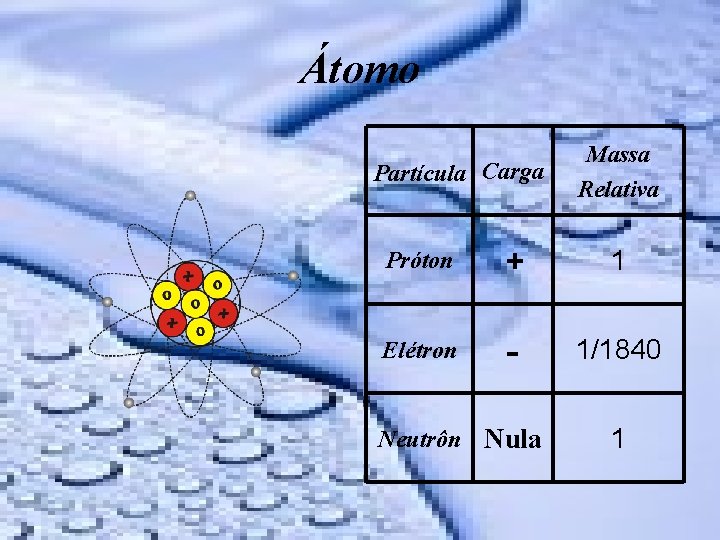
tomo Partcula Carga Massa Relativa Prton 1 Eltron












- Slides: 16

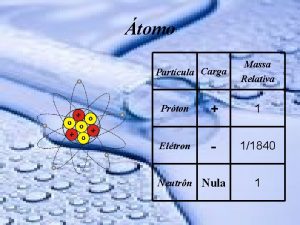
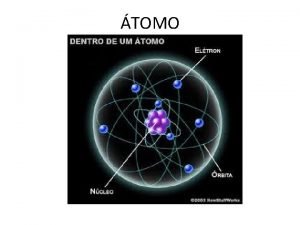
Átomo Partícula Carga Massa Relativa Próton + 1 Elétron - 1/1840 Neutrôn Nula 1

Ligações Químicas Arranjos Atômicos

As ligações químicas tem forte influência sobre diversas propriedades dos materiais Os elétrons de valência (do último nível) são os que participam das ligações químicas. Os átomos buscam a configuração mais estável dos gases nobres (com 2 ou 8 elétrons) Dependendo da energia envolvida na ligação elas podem ser divididas em Fortes Fracas

• Ligações fortes: Iônicas; Covalentes; Metálicas

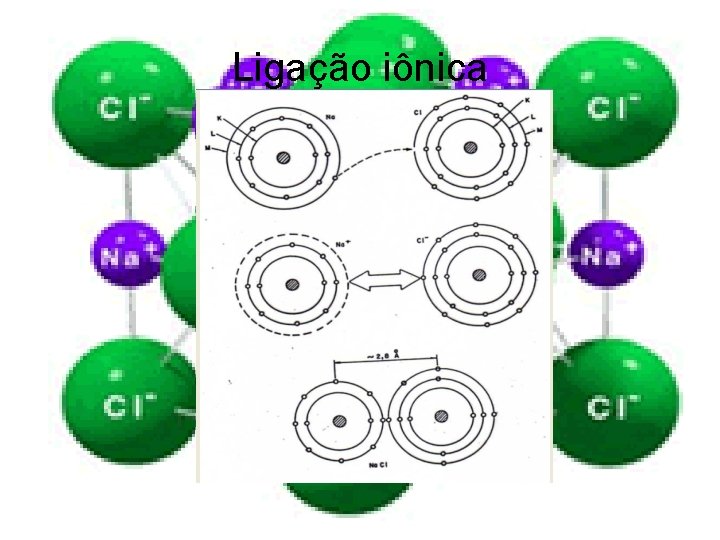
Ligação iônica Uma ligação iônica ocorre quando um ou mais elétrons são transferidos da camada de valência (A última camada que contém elétrons) de um átomo para a camada de valência de outro. Se um átomo perde elétrons torna-se um íon positivo (cátion), enquanto o átomo que ganha elétrons torna -se negativamente carregado (ânion). A ligação iônica resulta da atração entre os íons com cargas opostas.



Ligação iônica

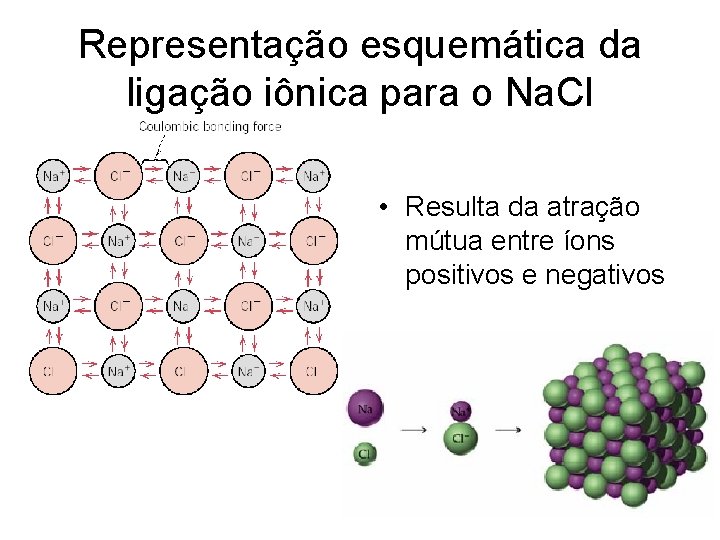
Representação esquemática da ligação iônica para o Na. Cl • Resulta da atração mútua entre íons positivos e negativos

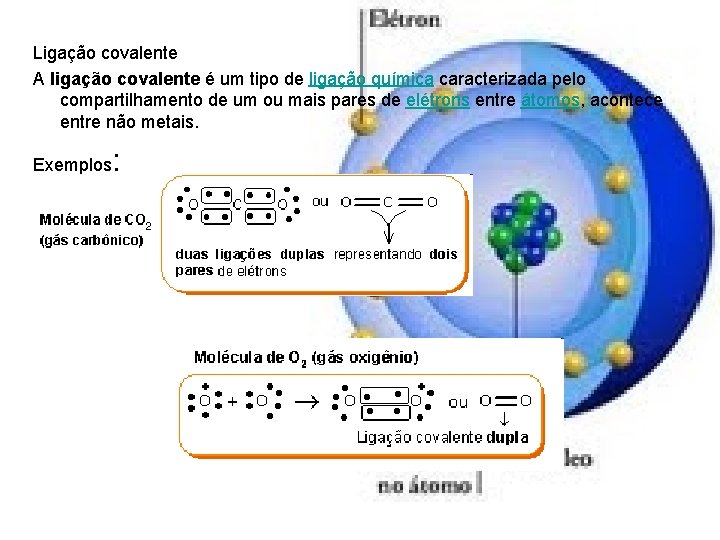
Ligação covalente A ligação covalente é um tipo de ligação química caracterizada pelo compartilhamento de um ou mais pares de elétrons entre átomos, acontece entre não metais. Exemplos :

Ligação covalente polar, é quando os átomos que estão ligados apresentam eletronegatividades variadas. Os atomos ligados tem diferente eletronegatividade. A toda ligacao covalente polar esta associado um vetor polarizacao, orientado da carga positiva para a negativa. H Cl Ligação covalente apolar Os atomos ligados tem igual eletronegatividade. H–H

Polaridade das moleculas Molecula apolar – A soma vetorial dos vetores polarizacao associados a todas as ligacoes covalentes polares da molecula e nula. Molecula polar – A soma vetorial dos vetores polarizacao associados a todas as ligacoes covalentes polares na molecula e diferente de zero.

Exercicios 1 -(U. Católica de Salvador-BA) Dentre os compostos abaixo, o que apresenta elementos com maior diferença de eletronegatividade é: (a) O 2 (b) O 3 © N 2 (d) CO 2 (e) HCl 2 - Uma roupa branca adquiriu urna mancha marrom quando nela derrubaram iodo (I 2). Qual dos líquidos a seguir é o menos eficaz para remover a mancha (a) gasolina (b) querosene (c) água (d) CCl 4 3 -(UFPA) A água (H 2 O), o sal de cozinha (Na. Cl) e o principal componente do gás de cozinha (C 4 H 10), substâncias químicas que utilizamos diariamente para o preparo de alimentos, têm suas estruturas constituídas, respectivamente, por ligações: (a) iônicas, iônicas e covalentes. (b) covalentes, iônicas e covalentes. (c) covalentes, covalentes e covalentes. (d) iônicas, iônicas e iônicas. (e) covalentes, covalentes e iônicas.

4 - (UCSal) No composto iônico de fórmula XY, o íon X é bivalente positivo. Nesse caso, Y poderia estar indicando o íon: (a) hidrogênio (b) oxigênio (c) potássio (d) magnésio (e) flúor 5 -O aumento de diferença de eletronegatividade entre os elementos ocasiona a seguinte ordem no caráter das ligações: a) covalente polar, iônica. b) iônica, covalente polar, covalente apolar. c) covalente apolar, iônica, covalente polar. d) covalente apolar, covalente polar, iônica. e) iônica, covalente apolar, covalente polar. 6 - Que tipo de ligação química que ocorre entre dois átomos de cloro para formar a molécula do Cl 2 ?

7 -Assinale a opção na qual as duas substâncias são apolares: a) Na. Cl e CCl 4. b) HCl e N 2. c) H 2 O e O 2. d) CH 4 e Cl 2. e) CO 2 e HF. 8 - As ligações químicas nas substâncias K(s), HCl(g), KCl(s) e Cl 2(g), são respectivamente: a) Metálica, covalente polar, iônica, covalente apolar. b) Iônica, covalente polar, metálica, covalente apolar. c) Covalente apolar, covalente polar, metálica, covalente apolar. d) Metálica, covalente apolar, iônica, covalente polar. e) Covalente apolar, covalente polar, iônica, metálica.

9 -O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 10 - Para que um átomo neutro de cálcio se transforme em Ca 2+, ele deve: a) receber dois elétrons. b) receber dois prótons. c) perder dois elétrons. d) perder dois prótons. e) perder um próton.
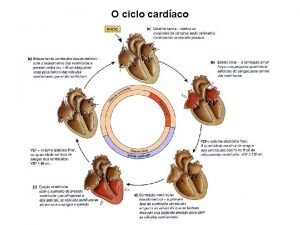
 Fluxo sanguineo
Fluxo sanguineo Prton
Prton Ufu mg o atomo é a menor particula que identifica
Ufu mg o atomo é a menor particula que identifica Kaskda
Kaskda Partcula
Partcula Cargas discretas
Cargas discretas Soledad ubilla
Soledad ubilla Encontrar
Encontrar Problemas de dinamica
Problemas de dinamica Massa isotópica relativa
Massa isotópica relativa Nuclide definizione
Nuclide definizione Rapporto massa grassa massa magra
Rapporto massa grassa massa magra Massa atomica e massa molecolare
Massa atomica e massa molecolare Solubilit
Solubilit Formula numero di moli
Formula numero di moli Rapporto massa grassa massa magra
Rapporto massa grassa massa magra Calculo de massa molar
Calculo de massa molar