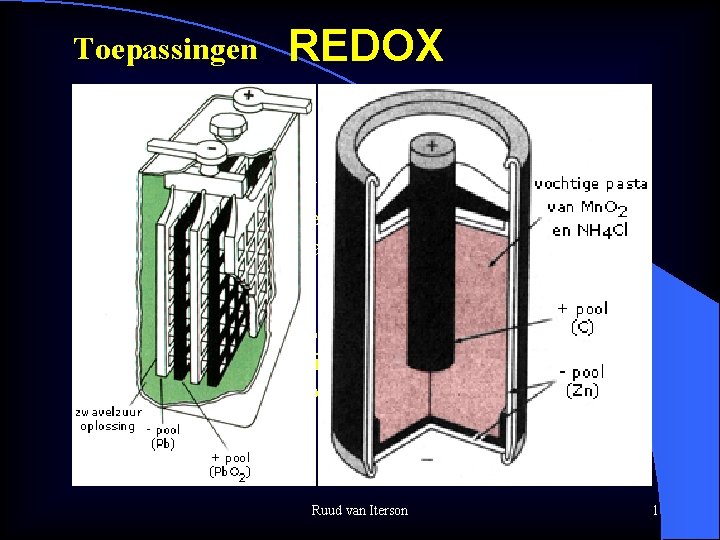
Toepassingen REDOX Wat is redox Tegelijkertijd reductie oxidatie














- Slides: 19

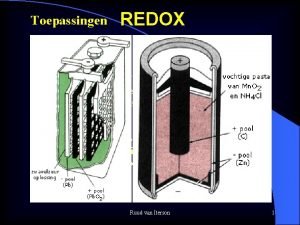
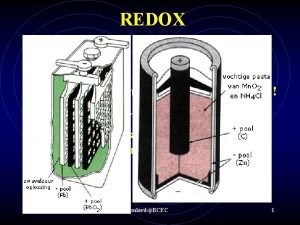
Toepassingen REDOX Wat is redox ? Tegelijkertijd reductie oxidatie reactie Met overdracht van elektronen ; het oxidatiegetal verandert. Oxideren van ijzer tot roest : ijzer(III)oxide O (zuurstof) is de oxidator en neemt electronen op van ijzer. IJzer wordt geoxideerd; ijzer is de reductor Ruud van Iterson 1

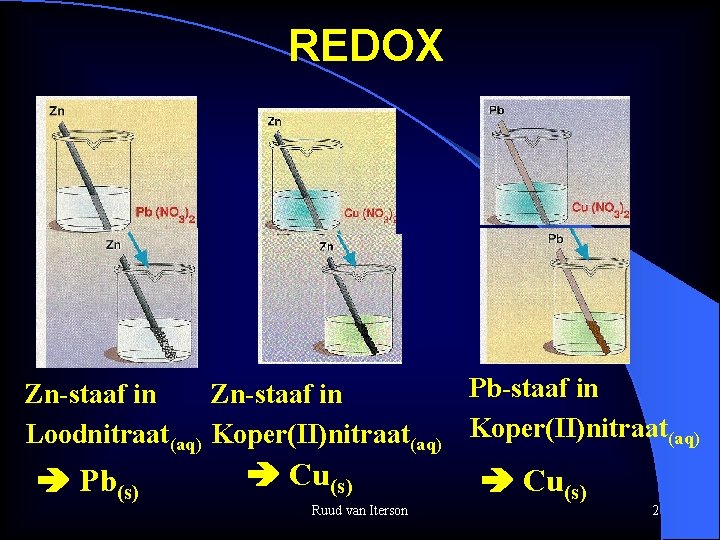
REDOX Pb-staaf in Zn-staaf in Loodnitraat(aq) Koper(II)nitraat(aq) Pb(s) Cu(s) Ruud van Iterson Cu(s) 2

Spanningsreeks der metalen Pt 4+ + 2 Fe Pt + 2 Fe 2+ Wie pakt e- ? Pt + 2 Fe 2+ Pt 4+ +2 Fe Wie pakt e- ? l De edelste houdt elektronen l De onedelste wil liefst elektronen afstaan l Platina is edeler dan ijzer dus ? ? ? Ruud van Iterson 3

Spanningsreeks l Koning Ba. Ca. Na Mag Alleen Zijn Fiets Niet Snachts Proberen Hoewel Culemborgse Aggie Kwik Pist met Goud l Kies nu de juiste: Pt 4+ + 2 Fe(s) Pt (s)+ 2 Fe 2+ of Pt(s) + 2 Fe 2+ Pt 4+ + 2 Fe (s) ? Ruud van Iterson 4

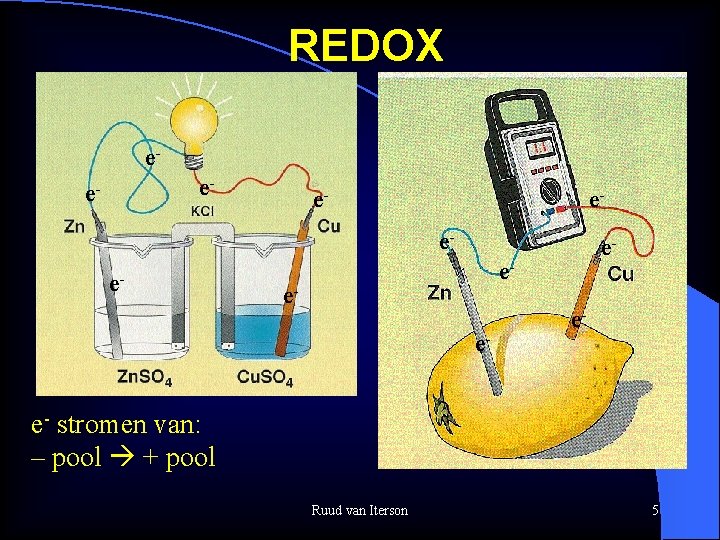
REDOX ee- e- e- stromen van: – pool + pool Ruud van Iterson 5

REDOX Overeenkomsten redox met zuur-base !! Zuur-base Redox Overdracht van H+ Overdracht van e- Sterkste zuren linksboven in Binas tabel 49 Sterkste oxidatoren linksboven in Binas tabel 48 Sterkste basen rechtsonder in Binas tabel 49 Zuursterkte: grootste Kz Basesterkte: grootste Kb Sterkste reductoren rechtsonder in Binas tabel 48 Oxidatorsterkte: hoogste V 0 Reductorsterkte: laagste V 0

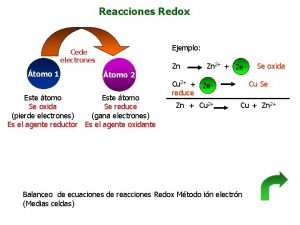
REDOX: opstellen reactievergelijkingen Stap 1: zet in een tabel of de aanwezige deeltjes reductoren of oxidatoren zijn. Linksboven reageert met rechtsonder Oxidator + e- Reductor Ox 1+ n e- Red 1 Ox 2 + m e- Red 2 Ruud van Iterson 7

Opstellen REDOX reacties Stap 1: kijk naar de verandering van oxidatiegetal Stap 2 bepaal elektronen links of rechts Stap 3: maak ionlading kloppend met H 3 O+ of OH Stap 4: Tel de O’s links en rechts en maak kloppend met H 2 O Stap 4: vertrouwen is goed, controle is beter controleer de H’s !!

Redox: chloorwater + ijzer(II)chloride-oplossing : Cl 2 + 2 e- 2 Cl. Fe 2+ Fe 3+ + e- reductie oxidatie 2 Fe 2+ + Cl 2 Fe 3+ + 2 Cl- redox Ruud van Iterson 9

Redox: invloed van omgeving Zoals je ooit wel gemerkt zult hebben of nog zult merken is er een grote invloed van de omgeving op bv de corrosiesnelheid van een stuk metaal - Een stuk metaal roest heel erg langzaam in zuurstofarm zuiver water - Een stuk metaal roest in zuurstofrijk kraanwater - Een stuk metaal roest snel in aangezuurd zuurstofrijk kraanwater Ruud van Iterson 10

Redox: invloed van omgeving - Een stuk metaal roest snel in zuur en zuurstofrijk kraanwater O 2 + 4 H+ + 4 e- 2 H 2 O Fe 2+ + 2 e- 1 x 2 x 2 Fe + O 2 + 4 H+ 2 Fe 3+ + 2 H 2 O Ruud van Iterson 11

Redox: invloed van omgeving Ox : Mn. O 4 - + 2 H 2 O + 3 e- Mn. O 2 + 4 OHRed: Fe 2+ + 2 e- 2 Mn. O 4 - + 4 H 2 O + 3 Fe 2+ + 2 Mn. O 2 + 8 OHvervolgreactie: Fe 2+ + 2 OH- Fe(OH)2 (s) Ruud van Iterson 12

Redox: invloed van omgeving aangezuurd Mn. O 4 - + 8 H+ + 5 e- Mn 2+ + 4 H 2 O Fe 2+ + 2 e- 2 x 2 Mn. O 4 - + 16 H+ + 5 Fe 2+ + 2 Mn 2+ + 4 H 2 O Ruud van Iterson 13

REDOX 2 I- I 2 (s)+ 2 e- Fe 3+ + e- Fe 2+ 1* 2* + 2 Fe 3+ + 2 I- 2 Fe 2+ + I 2 (s) De elektronen gaan van Inaar Fe 3+ waarbij I 2 en Fe 2+ ontstaan e- e- e-e- Ruud van Iterson 14

REDOX: batterijen Zn + 2 Mn. O 2 + H 2 O Zn(OH)2 + Mn 2 O 3 Zn + Ag 2 O Zn(OH)2 + 2 Ag Ruud van Iterson 15

REDOX: corrosie Als op metaal waterdruppels aanwezig zijn ontstaat er een elektrochemische cel waardoor ijzer (red) in oplossing gaat en zuurstofrijk water (ox) reageert roest Ruud van Iterson 16

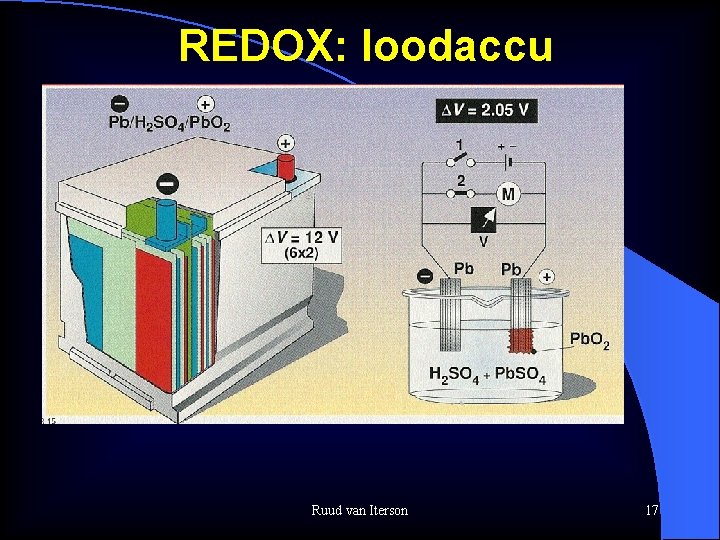
REDOX: loodaccu Ruud van Iterson 17

REDOX: loodaccu reacties Stroom levering ontladen: (+): Pb. O 2 + 4 H+ + SO 42 - + 2 e- Pb. SO 4 + H 2 O (-): Pb + SO 42 Pb. SO 4 + 2 e- Pb. O 2 + 4 H+ + Pb + 2 SO 42 - 2 Pb. SO 4 + 2 H 2 O Opladen: Pb. SO 4 + H 2 O Pb. O 2 + 4 H+ + SO 42 - + 2 e. Pb. SO 4 + 2 e- Pb + SO 42 - 2 Pb. SO 4 + 2 H 2 O Pb. O 2 + 4 H+ + Pb + 2 SO 42 Ruud van Iterson 18

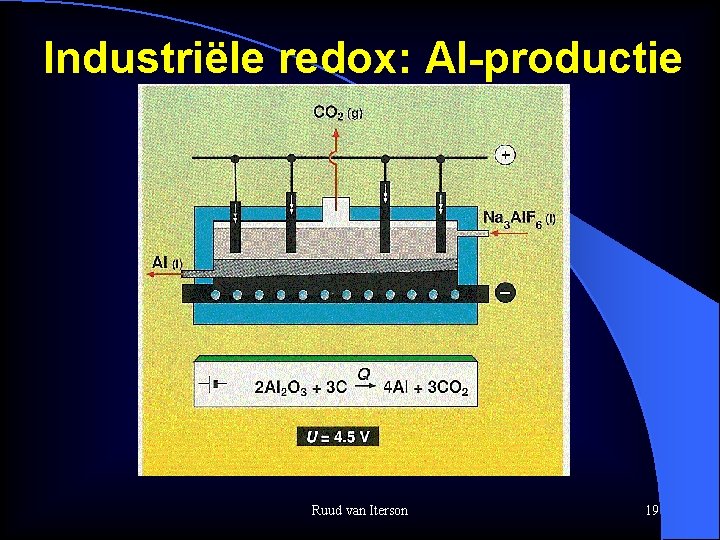
Industriële redox: Al-productie Ruud van Iterson 19
 Oxidatie en reductie
Oxidatie en reductie Pythagoras trapezium
Pythagoras trapezium Wat is redox
Wat is redox Psalm 217
Psalm 217 Balancing redox reactions in acid
Balancing redox reactions in acid Redox
Redox Cellular respiration redox
Cellular respiration redox Reaccion exotermica y endotermica ejemplos
Reaccion exotermica y endotermica ejemplos Reducing agent vs oxidizing agent
Reducing agent vs oxidizing agent Redox or nonredox
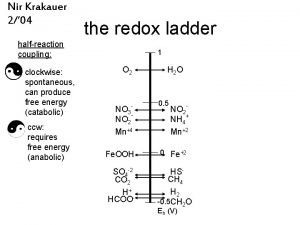
Redox or nonredox Redox ladder
Redox ladder Define permanganometry
Define permanganometry Normalidad redox
Normalidad redox Redoxchemie
Redoxchemie Bilanciare redox
Bilanciare redox Semirreacciones redox ejemplos
Semirreacciones redox ejemplos Titulação redox
Titulação redox Balancing redox reactions
Balancing redox reactions Balanceo por redox
Balanceo por redox óxido-reducción ejemplos
óxido-reducción ejemplos