TEMA 2 LA NATURALEZA CORPUSCULAR DE LA MATERIA







- Slides: 12

TEMA 2: LA NATURALEZA CORPUSCULAR DE LA MATERIA.

1. - ¿Qué es la materia? Materia es todo aquello que posee masa y ocupa un determinado volumen. Propiedades generales: masa y volumen. Propiedades específicas: temperatura de fusión, temperatura de ebullición, densidad, . . . 1. 1. Densidad:

Para averiguar la densidad de una roca, primero calculamos su masa con una balanza. Su masa es de 10, 25 g. A continuación, vertemos en una probeta con agua que marca hasta 20 cm 3 la roca, subiendo el volumen de la probeta hasta los 22, 5 cm 3. Calcula la densidad de la roca en g / cm 3 y en kg /m 3

2. - Teoría cinética de los gases. a) b) Los gases están compuestos por partículas que consideramos esferas rígidas. Estas partículas, se mueven de forma caótica por todo el espacio del recipiente que los contiene, pudiendo chocar las partículas entre sí o con las paredes del recipiente.

3. - El estado gaseoso. Un gas se caracteriza por tres variables. a) Volumen: un gas tiende a ocupar todo el volumen del recipiente que lo contiene. Además los gases son fácilmente compresibles. b) Temperatura: medida del estado de agregación de las partículas constituyentes del gas. A más temperatura, más movilidad de partículas. La temperatura se mide con el termómetro en tres escalas diferentes (Celsius, Fahrenheit y Kelvin) a) Presión: medida de los choques entre partículas y con las paredes del recipiente. Se mide en atmósferas o mm Hg. 1 atm = 760 mm. Hg

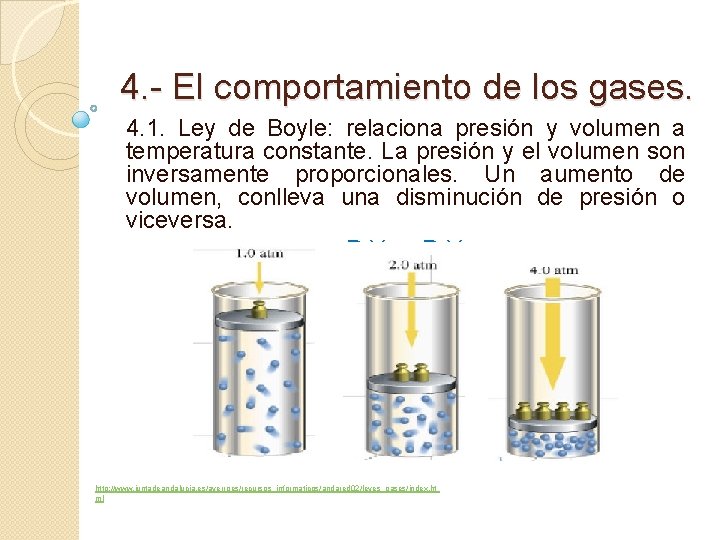
4. - El comportamiento de los gases. 4. 1. Ley de Boyle: relaciona presión y volumen a temperatura constante. La presión y el volumen son inversamente proporcionales. Un aumento de volumen, conlleva una disminución de presión o viceversa. P 1 V 1 = P 2 V 2 http: //www. juntadeandalucia. es/averroes/recursos_informaticos/andared 02/leyes_gases/index. ht ml

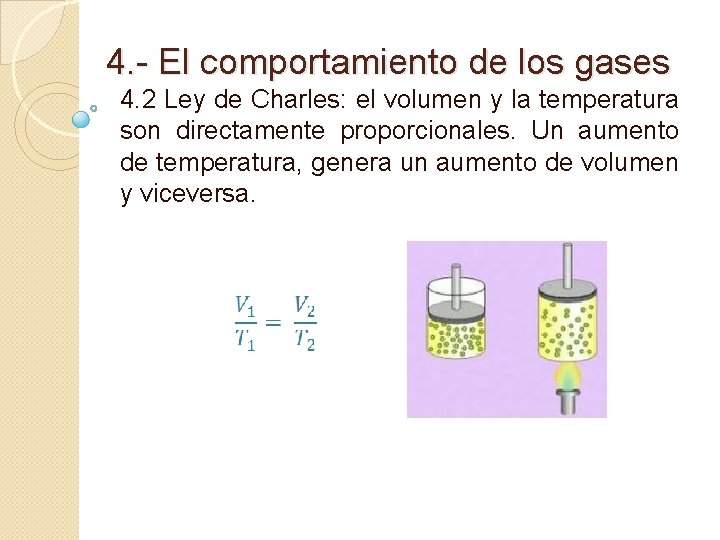
4. - El comportamiento de los gases 4. 2 Ley de Charles: el volumen y la temperatura son directamente proporcionales. Un aumento de temperatura, genera un aumento de volumen y viceversa.

4. - El comportamiento de los gases. 4. 2 Ley de Gay – Lussac: la presión y la temperatura son directamente proporcionales, es decir, un aumento de temperatura genera un aumento de presión y viceversa.

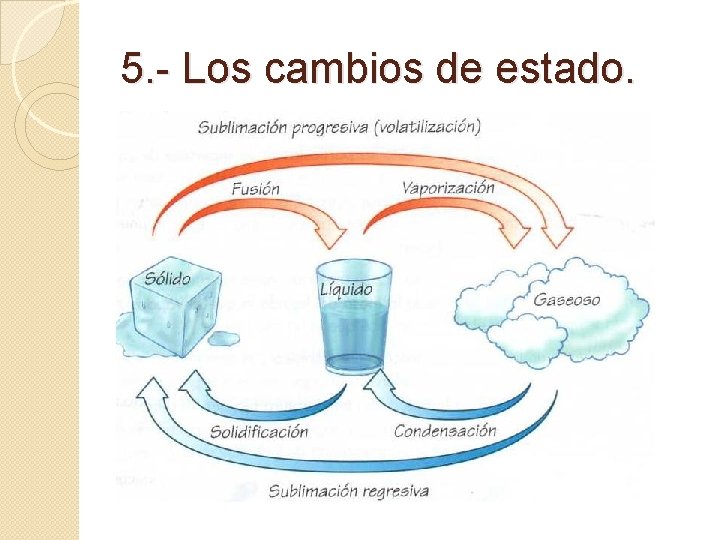
5. - Los cambios de estado.

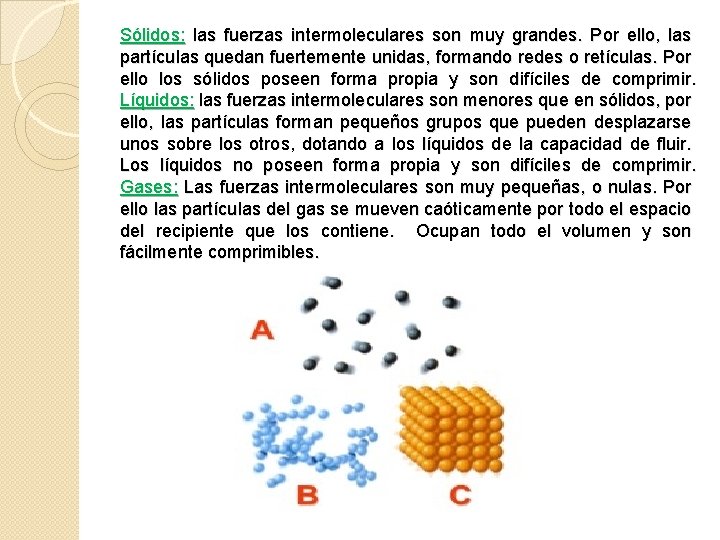
Sólidos: las fuerzas intermoleculares son muy grandes. Por ello, las partículas quedan fuertemente unidas, formando redes o retículas. Por ello los sólidos poseen forma propia y son difíciles de comprimir. Líquidos: las fuerzas intermoleculares son menores que en sólidos, por ello, las partículas forman pequeños grupos que pueden desplazarse unos sobre los otros, dotando a los líquidos de la capacidad de fluir. Los líquidos no poseen forma propia y son difíciles de comprimir. Gases: Las fuerzas intermoleculares son muy pequeñas, o nulas. Por ello las partículas del gas se mueven caóticamente por todo el espacio del recipiente que los contiene. Ocupan todo el volumen y son fácilmente comprimibles.

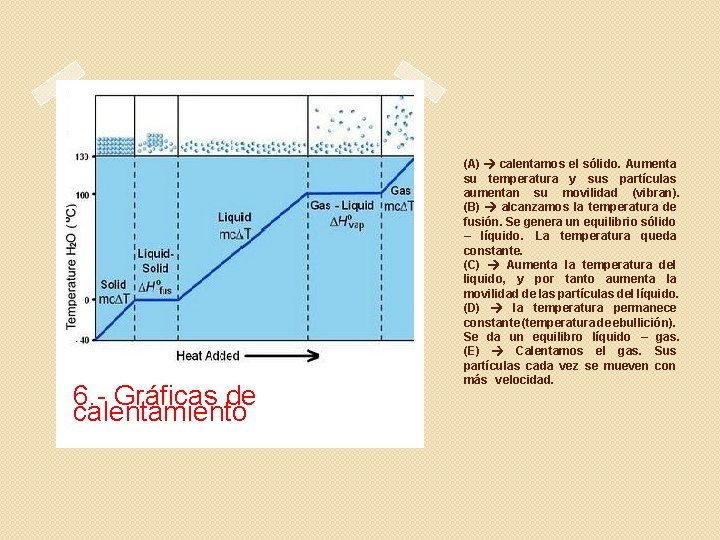
6. - Gráficas de calentamiento (A) calentamos el sólido. Aumenta su temperatura y sus partículas aumentan su movilidad (vibran). (B) alcanzamos la temperatura de fusión. Se genera un equilibrio sólido – líquido. La temperatura queda constante. (C) Aumenta la temperatura del liquido, y por tanto aumenta la movilidad de las partículas del líquido. (D) la temperatura permanece constante (temperatura de ebullición). Se da un equilibro líquido – gas. (E) Calentamos el gas. Sus partículas cada vez se mueven con más velocidad.

BUENA SUERTE !!!