8 9 Les radiacions electromagntiques CARCTER CORPUSCULAR La








- Slides: 16

8. 9 | Les radiacions electromagnètiques CARÀCTER CORPUSCULAR: -La llum es pot considerar com un conjunt de partícules o fotons que es desplacen a velocitat c. -Segons la teoria quàntica es considera que la matèria emet o absorbeix energia radiant de manera discontínua mitjançant corpuscles elementals o partícules. Cada un d’aquests corpuscles s’anomena quàntum d’energia, o també fotó. -L’energia d’un fotó es pot calcular com el producte de la freqüència de la radiació per la constant de Planck: Constant de Planck: h = 6’ 63· 10 -34 J·s Max Planck (1858 -1947). Fundador de la teoria quàntica i un dels més grans físics del segle XX. Premi Nobel de Física de 1918.

8. 10 | Els espectres atòmics Si s’analitza mitjançant un aparell anomenat espectroscopi la llum que emeten o absorbeixen les substàncies, es poden donar les següents situacions: a) Espectre continu produït per un sòlid, un líquid o un gas incandescent a pressió normal. b) Espectre d’emissió discontinu produït per l’hidrogen a baixa pressió. Consisteix en una sèrie de bandes o ratlles brillants aïllades. c) Espectre d’absorció que es produeix com a conseqüència que l’hidrogen absorbeix algunes de les radiacions del focus lluminós.

8. 10 | Els espectres atòmics -Els espectres, en general, són complexos i característics de cada element químic. (Recordar les flames de colors que són característiques de cada element. Li: vermell, Na: groc, Ba: verd. . . ) - Els espectres d’emissió i d’absorció d’un element són complementaris. -Cada ratlla d’un espectre discontinu correspon a una radiació d’una determinada longitud d’ona, freqüència i energia. -Les ratlles espectrals poden estar a la regió del visible, però també a la de l’infraroig i a la de l’ultraviolat. -Bohr va fer l’estudi i interpretació de l’espectre de l’àtom d’hidrogen, el més senzill, i va deduir que els electrons estan situats en capes o nivells a l’escorça de l’àtom: va trobar l’estructura electrònica.

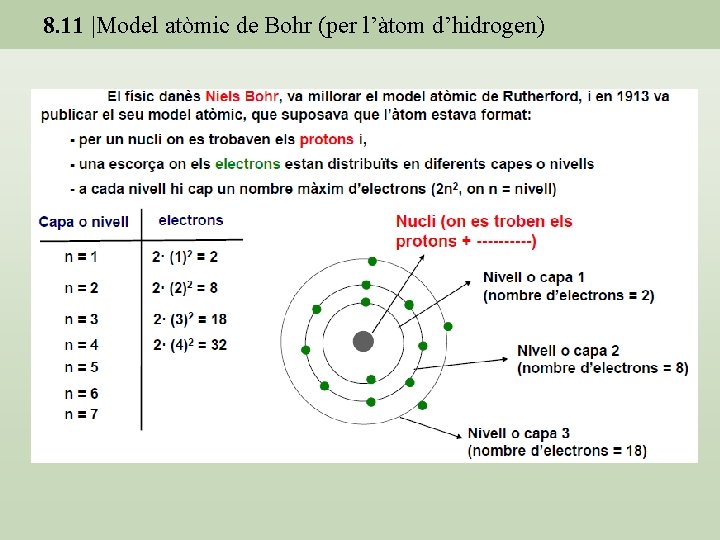
8. 11 |Model atòmic de Bohr (per l’àtom d’hidrogen)

8. 11 |Model atòmic de Bohr (per l’àtom d’hidrogen) • L’electró es mou entorn al nucli en certes capes o òrbites circulars anomenades nivells energètics principals o nivells quàntics principals. • L’energia de l’àtom està quantitzada. A cada nivell energètic principal li correspon un nombre natural n = 1, 2, 3, 4. . . anomenat nombre quàntic principal. • El pas d’un electró d’un nivell a un altre d’energia s’anomena transició electrònica. L’energia emesa o absorbida en cada transició electrònica és igual a l’energia d’un quàntum o fotó. a) Absorció d’un fotó entre els nivells E 1 de menys energia i E 2 de més energia. b) Emissió d’un fotó entre els nivells E 2 de més energia i E 1 de menys energia. c) La transició electrònica E 3 → E 1 pot tenir lloc directament o en dues etapes. En tot cas, ε 1 = ε 2 + ε 3.

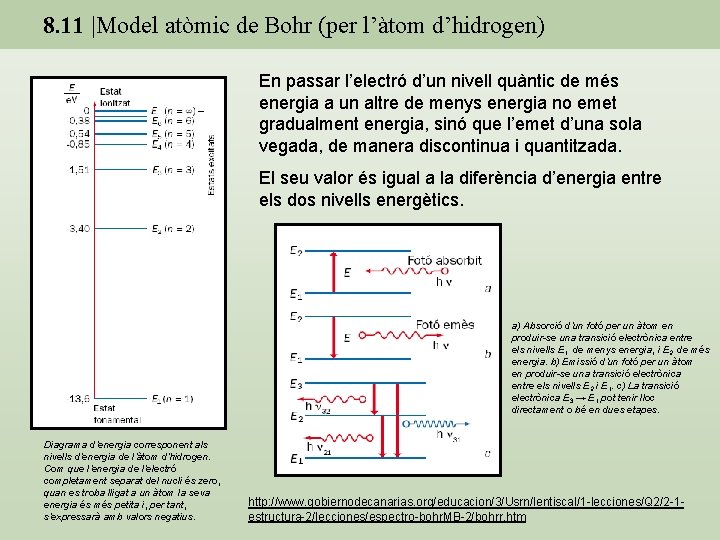
8. 11 |Model atòmic de Bohr (per l’àtom d’hidrogen) En passar l’electró d’un nivell quàntic de més energia a un altre de menys energia no emet gradualment energia, sinó que l’emet d’una sola vegada, de manera discontinua i quantitzada. El seu valor és igual a la diferència d’energia entre els dos nivells energètics. a) Absorció d’un fotó per un àtom en produir-se una transició electrònica entre els nivells E 1, de menys energia, i E 2, de més energia. b) Emissió d’un fotó per un àtom en produir-se una transició electrònica entre els nivells E 2 i E 1. c) La transició electrònica E 3 → E 1 pot tenir lloc directament o bé en dues etapes. Diagrama d’energia corresponent als nivells d’energia de l’àtom d’hidrogen. Com que l’energia de l’electró completament separat del nucli és zero, quan es troba lligat a un àtom la seva energia és més petita i, per tant, s’expressarà amb valors negatius. http: //www. gobiernodecanarias. org/educacion/3/Usrn/lentiscal/1 -lecciones/Q 2/2 -1 estructura-2/lecciones/espectro-bohr. MB-2/bohrr. htm

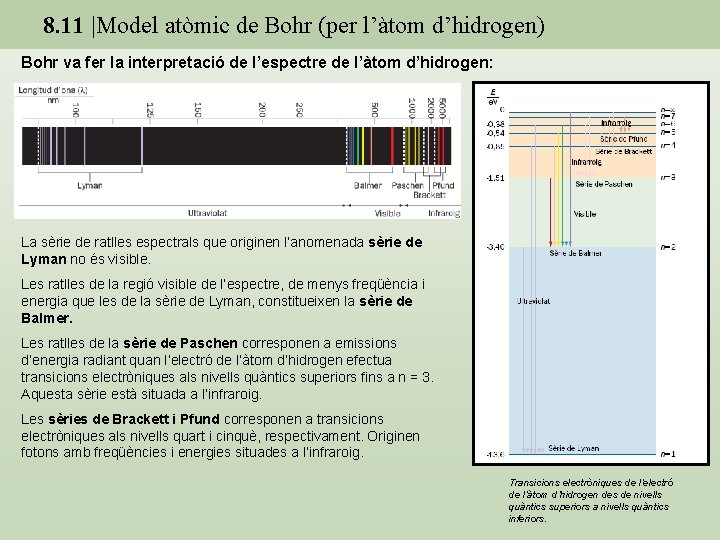
8. 11 |Model atòmic de Bohr (per l’àtom d’hidrogen) Bohr va fer la interpretació de l’espectre de l’àtom d’hidrogen: La sèrie de ratlles espectrals que originen l’anomenada sèrie de Lyman no és visible. Les ratlles de la regió visible de l’espectre, de menys freqüència i energia que les de la sèrie de Lyman, constitueixen la sèrie de Balmer. Les ratlles de la sèrie de Paschen corresponen a emissions d’energia radiant quan l’electró de l’àtom d’hidrogen efectua transicions electròniques als nivells quàntics superiors fins a n = 3. Aquesta sèrie està situada a l’infraroig. Les sèries de Brackett i Pfund corresponen a transicions electròniques als nivells quart i cinquè, respectivament. Originen fotons amb freqüències i energies situades a l’infraroig. Transicions electròniques de l’electró de l’àtom d’hidrogen des de nivells quàntics superiors a nivells quàntics inferiors.

8. 12 |Ampliació de la teoria de Bohr per a àtoms polielectrònics La teoria de Bohr no explicava els espectres dels àtoms polielectrònics: -En els espectres d’aquests, moltes ratlles estaven desdoblades (estructura fina de l’espectre). Es va interpretar com que en cada nivell hi havia subnivells. El nombre de subnivells de cada nivell d’energia és igual al nombre n que indica el nivell principal. Els subnivells es van indicar amb les lletres s, p, d i f. - Posteriorment encara es van trobar nous desdoblaments que es van intentar explicar introduint més rectificacions per part de deixebles de Bohr. Però finalment aquest model va quedar superat. El desdoblament de la primera ratlla de la sèrie de Lyman (regió ultraviolada de l’espectre de l’àtom d’hidrogen) s’explica admetent dues possibles transicions electròniques de n = 2 a n = 1.

8. 13 |Model actual: model quàntic - L’electró es comporta com una partícula però també com una ona que obeeix a una equació quàntica, equació d’ona de Schrödinger. L’energia de l’electró s’obté en resoldre l’equació i només pot prendre uns certs valors, que coincideixen amb els que havia trobat Bohr per als nivells i subnivells. - No es pot saber amb total certesa la posició i la velocitat de l’electró (Principi d’incertesa de Heisenberg). -S’anomena orbital de l’electró la regió de l’espai on amb més probabilitat es troba l’electró, és a dir, on la densitat electrònica és màxima. Un orbital es representa per mitjà d’un núvol de punts. Orbital atòmic: és la regió de l’espai al voltant del nucli de l’àtom que ocupa cada electró amb una energia característica. -Els subnivells s tenen un sol orbital, els subnivells p tenen 3 orbitals, els subnivells d tenen 5 orbitals i els subnivells f tenen 7 orbitals. - En un orbital hi pot haver, com a màxim, la càrrega total de dos electrons. 18. a) Representació, mitjançant un núvol electrònic, de la posició d’un electró al voltant del nucli positiu. b) Secció transversal d’una superfície esfèrica que engloba un 90 o 99 % de la possibilitat de trobar-hi l’electró.

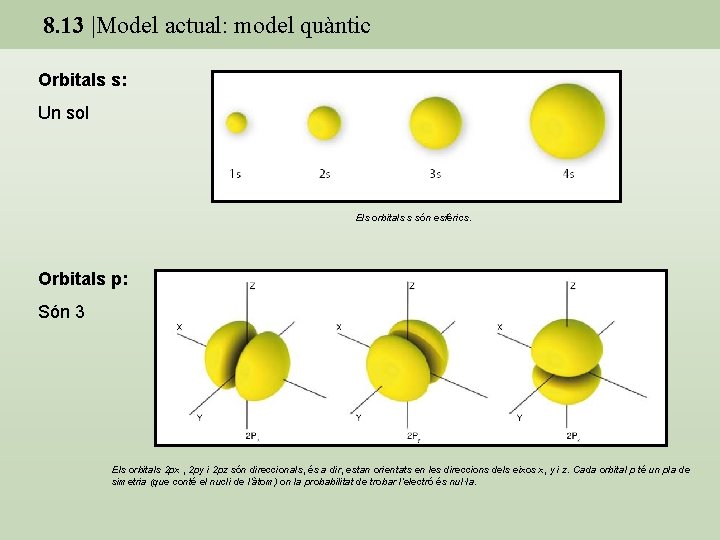
8. 13 |Model actual: model quàntic Orbitals s: Un sol Els orbitals s són esfèrics. Orbitals p: Són 3 Els orbitals 2 px , 2 py i 2 pz són direccionals, és a dir, estan orientats en les direccions dels eixos x, y i z. Cada orbital p té un pla de simetria (que conté el nucli de l’àtom) on la probabilitat de trobar l’electró és nul·la.

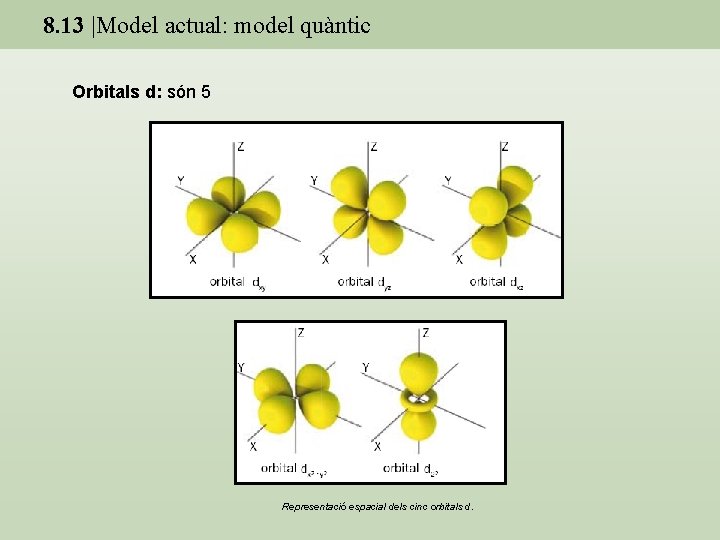
8. 13 |Model actual: model quàntic Orbitals d: són 5 Representació espacial dels cinc orbitals d.

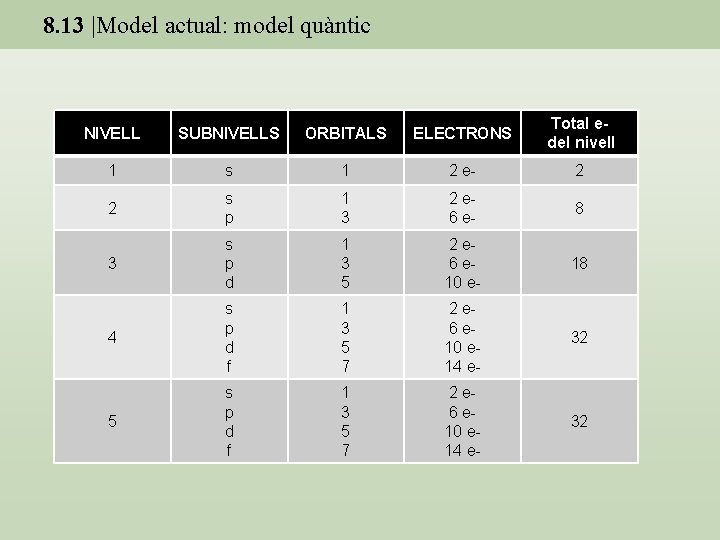
8. 13 |Model actual: model quàntic NIVELL SUBNIVELLS ORBITALS ELECTRONS Total edel nivell 1 s 1 2 e- 2 2 s p 1 3 2 e 6 e- 8 3 s p d 1 3 5 2 e 6 e 10 e- 18 4 s p d f 1 3 5 7 2 e 6 e 10 e 14 e- 32 5 s p d f 1 3 5 7 2 e 6 e 10 e 14 e- 32

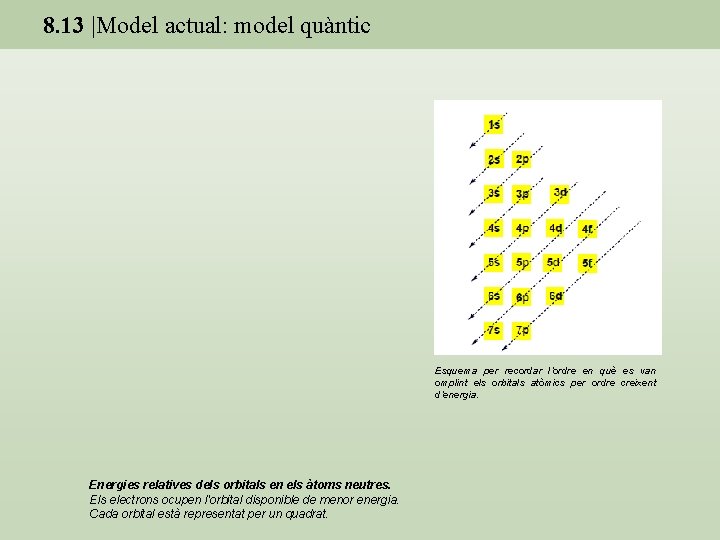
8. 13 |Model actual: model quàntic Esquema per recordar l’ordre en què es van omplint els orbitals atòmics per ordre creixent d’energia. Energies relatives dels orbitals en els àtoms neutres. Els electrons ocupen l'orbital disponible de menor energia. Cada orbital està representat per un quadrat.

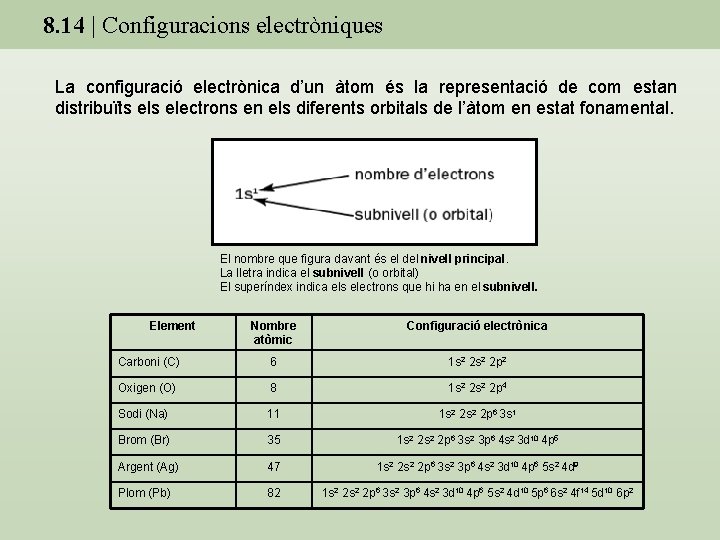
8. 14 | Configuracions electròniques La configuració electrònica d’un àtom és la representació de com estan distribuïts electrons en els diferents orbitals de l’àtom en estat fonamental. El nombre que figura davant és el del nivell principal. La lletra indica el subnivell (o orbital) El superíndex indica els electrons que hi ha en el subnivell. Element Nombre atòmic Configuració electrònica Carboni (C) 6 1 s 2 2 p 2 Oxigen (O) 8 1 s 2 2 p 4 Sodi (Na) 11 1 s 2 2 p 6 3 s 1 Brom (Br) 35 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 5 Argent (Ag) 47 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 9 Plom (Pb) 82 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 2

8. 14 | Configuracions electròniques Els electrons es col·loquen en els orbitals seguint unes regles: - Principi de la mínima energia: Els electrons omplen els orbitals de menor energia que es trobin disponibles. (cal recordar l’ordre energètic dels orbitals) - Principi d’exclusió de Pauling: En cada orbital només poden haver-hi dos electrons. Quan dos electrons ocupen el mateix orbital, aquests estan aparellats. -Regla de màxima multiplicitat de Hund: En omplir-se orbitals d’energia equivalent, els electrons es mantenen desaparellats o paral·lels, si és possible. http: //www. edu 365. cat/batxillerat/ciencies/taula/ (en català)

8. 15 |Taula periòdica
 Carcter
Carcter Carcter
Carcter Teoria corpuscular
Teoria corpuscular La materia es de naturaleza corpuscular
La materia es de naturaleza corpuscular Modelo corpuscular mezcla
Modelo corpuscular mezcla Características de los gases nobles
Características de los gases nobles Modelo corpuscular
Modelo corpuscular Teoria corpuscular
Teoria corpuscular Hematocrito en que tubo se toma
Hematocrito en que tubo se toma Cuerpo corpuscular
Cuerpo corpuscular Naturaleza corpuscular
Naturaleza corpuscular Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Exemple texte expressif
Exemple texte expressif Le train de la vie grand corps malade
Le train de la vie grand corps malade Les 10 volcans les plus dangereux du monde
Les 10 volcans les plus dangereux du monde Les promesses de dieu ne failliront jamais lyrics
Les promesses de dieu ne failliront jamais lyrics Variables invariables
Variables invariables