Rchlos chemickch reakci Pomal a rchle reakcie Pomal













- Slides: 16

Rýchlosť chemických reakcií Pomalé a rýchle reakcie

Pomalá či rýchla chemická reakcia ? ? ? Predstavu o rýchlosti chemickej reakcie získame pozorovaním jej priebehu ! – ako rýchlo vzniká produkt, ako rýchlo sa míňa reaktant, ako rýchlo sa reaktant mení na produkt, ako rýchlo sa mení sfarbenie reagujúcich látok Čo je to rýchlosť chemickej reakcie? Čas potrebný na zmenu reaktantov na produkty.

Hrdzavenie železa – dej pomalý či rýchly ? ? ? Pokus 1. skúmavka so železnými klinčekmi + destilovaná prevarená voda a vrstva oleja – zazátkovaná 2. skúmavka so železnými klinčekmi + voda z vodovodu – otvorená 3. Skúmavka so železnými klinčekmi + roztok kyseliny chlorovodíkovej 4. Skúmavka so železnými klinčekmi - otvorená + tuhý bezvodý chlorid vápenatý - zazátkovaná 5. Skúmavka so železnými klinčekmi – otvorená Po dvoch týždňoch: Intenzívne hrdzavenie železného klinca pozorujeme v prípade druhej a tretej skúmavky. Žiadne znaky korózie nenájdeme v skúmavke, kam sme pridávali bezvodý chlorid vápenatý, ani v prípade destilovanej vody nadvrstenej olejom. Po dlhšom čase by sa hrdzavenie malo objaviť aj v prípade piatej skúmavky. Hrdzavenie je pomalá chemická reakcia, ktorá môže byť podporená a urýchlená vhodnými podmienkami.

Poznáme aj iné pomalé chemické reakcie zo života?

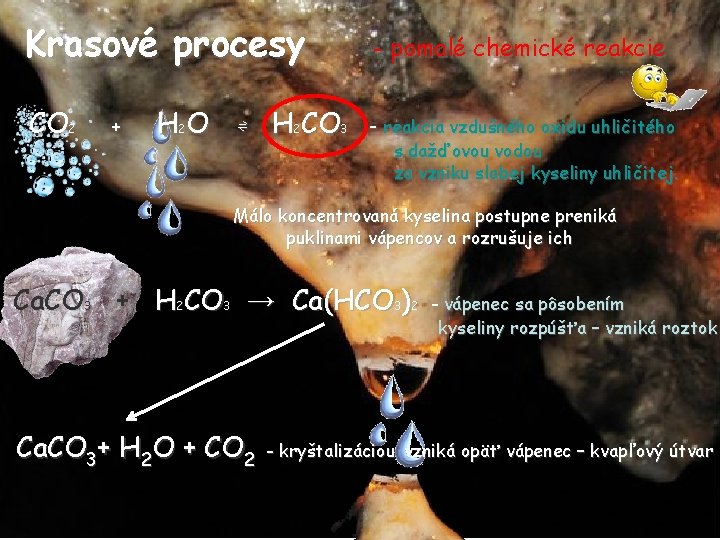
Krasové procesy - pomalé chemické reakcie CO 2 - reakcia vzdušného oxidu uhličitého + H 2 O ⇌ H 2 CO 3 s dažďovou vodou za vzniku slabej kyseliny uhličitej. Málo koncentrovaná kyselina postupne preniká puklinami vápencov a rozrušuje ich Ca. CO 3 + H 2 CO 3 → Ca(HCO 3)2 Ca. CO 3+ H 2 O + CO 2 - vápenec sa pôsobením kyseliny rozpúšťa – vzniká roztok - kryštalizáciou vzniká opäť vápenec – kvapľový útvar

Zvetrávanie - pomalá chemická reakcia - rozrušovanie pevných celkov na malé úlomky - pôsobením kyslých dažďov – chemické zvetrávanie

Kyslé dažde - pomalé chemické reakcie Nie len zvetrávanie budov, kultúrnych pamiatok, sôch. . . ale aj poškodenie rastlín, živočíchov, pôdy a vôd. . .

Rozklad plastov - pomalé chemické reakcie Plasty sú odolné voči korózii a rozkladu, voči vode a nehnijú !!! Rozklad plastovej fľaše trvá až 500 rokov !!! Rozklad polystyrénu – 1000 rokov !!! R E A I C C Y K LÁ

A čo tak rýchle chemické reakcie v našom živote?

Horenie - rýchla chemická reakcia Podmienky horenia: 1. Prítomnosť horľavej látky. 2. Dosiahnutie zápalnej teploty. 3. Prítomnosť vzdušného kyslíka

Kazenie potravín - rýchla chemická reakcia -strata nutričných hodnôt, chuti, vzhľadu a ďalších vlastností potravín. - rast plesní , prítomnosť baktérií - plesne však môžu byť na potravinách aj žiaduce

Chemické reakcie v ľudskom tele - dýchanie trávenie metabolizmus rast starnutie imunitné reakcie. . . -relatívne rýchle chemické reakcie

Je dôležité ovplyvňovať rýchlosť ÁNO chemických reakcií Spomalenie chemických reakcií: - umenšenie zvetrávania – konzervácia stavieb a sôch - zamedzenie hrdzavenia – nátery, ochranné kovové povlaky - zamedzenie kazenia potravín – vákuové balenia, konzervácia, ochladenie - spomalenie starnutia - výskum Urýchlenie chemických reakcií - výroba liekov, chemikálií -rozklad odpadového/nepotrebného materiálu – biologicky rozložiteľné látky

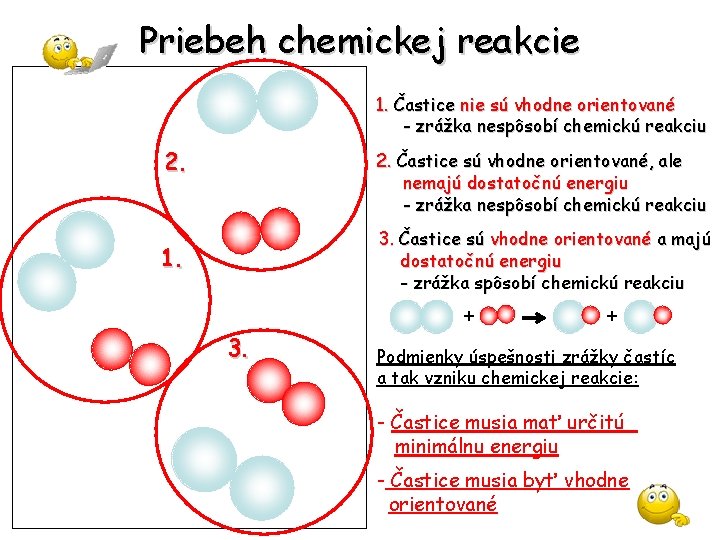
Priebeh chemickej reakcie 1. Častice nie sú vhodne orientované - zrážka nespôsobí chemickú reakciu 2. Častice sú vhodne orientované, ale nemajú dostatočnú energiu - zrážka nespôsobí chemickú reakciu 3. Častice sú vhodne orientované a majú dostatočnú energiu - zrážka spôsobí chemickú reakciu 1. + 3. + Podmienky úspešnosti zrážky častíc a tak vzniku chemickej reakcie: - Častice musia mať určitú minimálnu energiu - Častice musia byť vhodne orientované

Zopakujme si: 1. Reakcie na obrázkoch rozdeľ na pomalé a rýchle 2. Prečo je dôležité ovplyvňovať rýchlosť chemických reakcií ? 3. V ktorom prípade bola zrážka medzi časticami úspešná a prebehla chemická reakcia a prečo ? 1. 2. 3. 4.

+ + Ďakujem za pozornosť ; o) Vypracovala: Ing. Lucia Dovalová ZŠ Badín
























