PRIMEVA ANRS 135 Prvention de la transmission du
















- Slides: 19

PRIMEVA – ANRS 135 « Prévention de la transmission du VIH-1 de la mère à l’enfant sans utilisation d’analogue nucléosidique en pré-partum » Aspects pratiques sandrine DELMAS EPF - Enquête Périnatale Française INSERM U 822 (ex U 569) EPF-PRIMEVA - ANRS 135 mars 2007

Déroulement de l’essai Contexte particulier de l’essai Femme enceinte VIH-1+ et suivi de l’enfant 3 services cliniques impliqués: Ø Ø Ø Service de médecine spécialisé dans le VIH Maternité Service de pédiatrie + labos, pharmacie Une bonne coordination entre ces services est donc indispensable au bon déroulement de l’essai Choix du réseau EPF-PRIMEVA - ANRS 135 mars 2007

Liste des centres participants n 10 Sites parisiens Cochin - Port-Royal, Lariboisière, Necker, Pitié, R. Debré, Rothschild, Saint-Antoine, Saint-Louis, Tenon, Trousseau n 9 Sites en région parisienne Bondy, Clamart, Colombes, Centre Sud-Francilien (Evry-Corbeil), Créteil, Ivry, Le Kremlin-Bicêtre, Montreuil, Saint-Denis n 9 Sites en province Bordeaux, Lille-tourcoing, Lyon, Marseille, Montpellier, Nantes, Nice, Strasbourg, Toulouse. Soit 24 services de médecine spécialisé dans le VIH 25 maternités 21 services de pédiatrie EPF-PRIMEVA - ANRS 135 mars 2007

Pré-inclusion Un service référent Service ou de médecine spécialisé dans le VIH maternité déterminé à l’avance selon les habitudes de chaque centre (prescription des ARV) Responsable Ø Inclusion des patientes dans le centre Ø Bon déroulement de l’essai Ø Coordination entre les différents cliniciens Ø Recueil des données de l’essai EPF-PRIMEVA - ANRS 135 mars 2007

Recueil des données Mère: Cahier d’observation Ø Au niveau du service référent Ø partie spécifique à l’accouchement, transmise à la maternité dès l’inclusion Enfant: Ø au niveau du service de pédiatrie Complétés au fur et à mesure des consultations Archivés ensemble au niveau de la maternité en fin d’essai Inclusion dans PRIMEVA participation à EPF-ANRS EP 13 Le cahier PRIMEVA remplace le QM et celui de l’enfant EPF-PRIMEVA - ANRS 135 mars 2007

Critères d’inclusion Femme enceinte présentant les critères suivants entre 20 et 24 SA Ø infectée par le VIH-1, âge ≥ 18 ans Ø Grossesse prise en charge dans un site EPF avant 24 SA Ø Pas d’antécédent d’IP (sauf grossesse antérieure) Ø Pas d’indication clinique à un traitement ARV Ø Pas de symptôme clinique lié au VIH Ø CD 4 nadir ≥ 350 /mm 3 Ø CV ≥ 200 copies/ml et <30 000 copies/ml au bilan pré-inclusion Ø Consentement éclairé signé EPF-PRIMEVA - ANRS 135 mars 2007

Critères de non inclusion Ø Infection VIH-2 ou sous types non quantifiables par PCR standard (O, …) Ø Bilan de pré-inclusion non fait entre 20 et 24 SA Ø Contre indication norvir, lopinavir et/ou zidovudine, lamivudine Ø Si traitée par IP: présence de mutations de résistance sur a protéase du VIH-1 (1 mutation parmi V 32 I et I 47 A, I 50 V V 82 A/F/S/T, I 84 V, L 90 M ou > 3 mutations parmi L 10 F/I/R/V, K 20/M/R, L 24 I, L 33 F, M 46 I/L, F 53 L, I 54 M/L/T/V, L 63 P, A 71 L/V/T, ) Ø Diabète non équilibré Ø Risque de prématurité (grossesse gémellaire, MAP) Ø Pathologie maternelle ou fœtale grave évolutive EPF-PRIMEVA - ANRS 135 mars 2007

Consentement Etude générale Recueil du consentement avant la randomisation Sous-étude pharmacologique (20 patientes) Consentement spécifique l’original conservé par le site d’inclusion 1 exemplaire pour la patiente 1 exemplaire pour l’U 822 EPF-PRIMEVA - ANRS 135 mars 2007

Randomisation Au plus tard à 25 SA Dés réception des résultats biologiques de pré-inclusion Ä faxer à l’U 822: n n n Les feuillets de pré-inclusion La photocopie anonymisée des résultats biologiques La demande de randomisation Randomisation effectuée par l’U 822 Le résultat sera transmis par fax aux services cliniques (clinicien VIH, obstétricien, pédiatre), laboratoires et pharmacie EPF-PRIMEVA - ANRS 135 mars 2007

EPF-PRIMEVA - ANRS 135 mars 2007

Début du traitement à J 0 (26 SA) Schéma général suivi des mères Evaluation du critère principal à S 8 (34 SA) Kaletra + combivir Kaletra Accouchement : arrêt du traitement Fin de l’essai pour la mère: S 12 post-partum CV ≥ 200 copies/ml à 34 SA Modification du traitement CV < 200 copies/ml à 34 SA Maintien du traitement Contrôle de la CV à 36 SA CV ≥ 400 copies/ml: césarienne reco EPF-PRIMEVA - ANRS 135 mars 2007

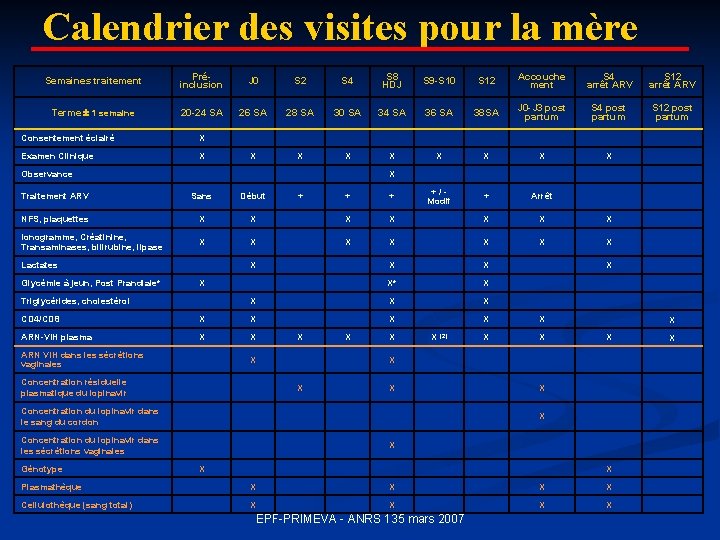
Calendrier des visites pour la mère Semaines traitement Préinclusion J 0 S 2 S 4 S 8 HDJ S 9 -S 10 S 12 Accouche ment S 4 arrêt ARV S 12 arrêt ARV Terme 1 semaine 20 -24 SA 26 SA 28 SA 30 SA 34 SA 36 SA 38 SA J 0 -J 3 post partum S 4 post partum S 12 post partum X X X X Consentement éclairé X Examen Clinique X Observance X Traitement ARV Sans Début NFS, plaquettes X X Ionogramme, Créatinine, Transaminases, bilirubine, lipase X X Lactates Glycémie à jeun, Post Prandiale* + + X X Arrêt X X X* X X X X X Triglycérides, cholestérol CD 4/CD 8 X X ARN-VIH plasma X X ARN VIH dans les sécrétions vaginales + / - Modif + + X X Concentration résiduelle plasmatique du lopinavir X X (2) Concentration du lopinavir dans le sang du cordon Concentration du lopinavir dans les sécrétions vaginales Génotype X X X X Plasmathèque X X Cellulothèque (sang total) X X EPF-PRIMEVA - ANRS 135 mars 2007 X

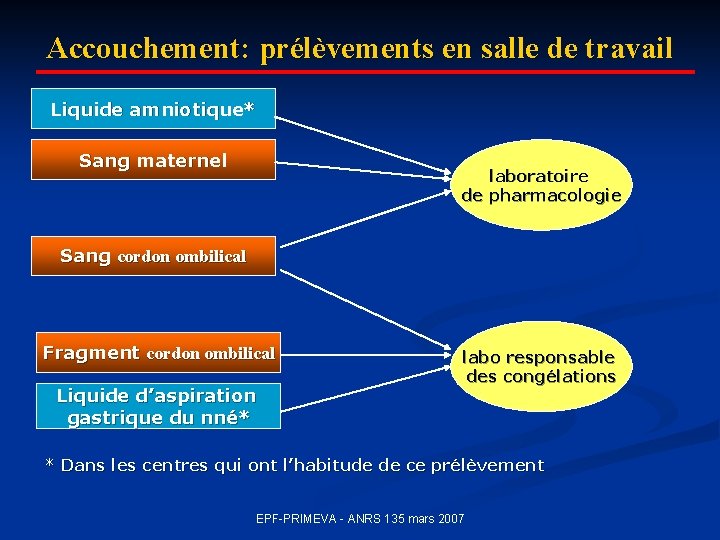
Accouchement: prélèvements en salle de travail Liquide amniotique* Sang maternel laboratoire de pharmacologie Sang cordon ombilical Fragment cordon ombilical Liquide d’aspiration gastrique du nné* labo responsable des congélations * Dans les centres qui ont l’habitude de ce prélèvement EPF-PRIMEVA - ANRS 135 mars 2007

Centralisation des congélations (prélèvements maternels) n Biothèque : Plasma + culot cellulaire J 0 / S 8 / Accouchement / S 4 post-partum n Plasma pour analyses pharmaco centralisées S 2 : génotypage des transporteurs S 8 : forme libre du lopinavir Sous-étude pharmacologique (20 p) n Sang de cordon ombilical n Sécrétions cervico-vaginale (J 0 / S 8) Fragment de cordon ombilical n EPF-PRIMEVA - ANRS 135 mars 2007 EFS de Lyon Labo de Viro de Necker

Déroulement de l’essai pour l’enfant n Suivi clinique et biologique selon les recommandations n Traitement prophylactique par zidovudine pendant 6 s n Suivi 24 mois EPF-PRIMEVA - ANRS 135 mars 2007

Consentement sous étude n Père reconnait son enfant avant ou à la naissance Signature du consentement père +mère n Père ne reconnait pas son enfant Signature de la mère uniquement EPF-PRIMEVA - ANRS 135 mars 2007

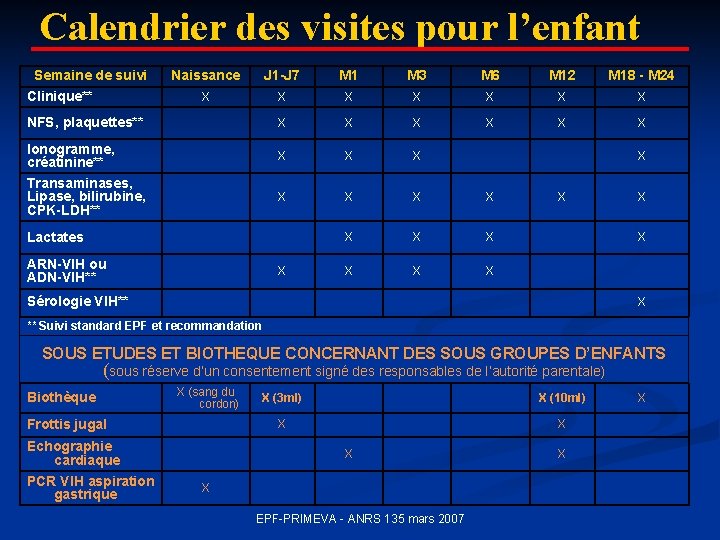
Calendrier des visites pour l’enfant Semaine de suivi Clinique** Naissance J 1 -J 7 M 1 M 3 M 6 M 12 M 18 - M 24 X X X X X X X NFS, plaquettes** Ionogramme, créatinine** Transaminases, Lipase, bilirubine, CPK-LDH** Lactates ARN-VIH ou ADN-VIH** X X X Sérologie VIH** X ** Suivi standard EPF et recommandation SOUS ETUDES ET BIOTHEQUE CONCERNANT DES SOUS GROUPES D’ENFANTS (sous réserve d’un consentement signé des responsables de l’autorité parentale) Biothèque X (sang du cordon) Frottis jugal Echographie cardiaque PCR VIH aspiration gastrique X (3 ml) X (10 ml) X X EPF-PRIMEVA - ANRS 135 mars 2007 X X

Centralisation des congélations (prélèvements des enfants) n Fraction de liquide gastrique Accouchement n Biothèque de l’enfant : sang total J 1 -J 7 (3 ml) / M 12 (10 ml) n Cellules épithéliales (frottis jugal) J 1 -J 7 / M 12 EPF-PRIMEVA - ANRS 135 mars 2007 EFS de Lyon Labo de Viro de Necker

Début de l’essai Début des inclusions fin avril 2007 visites de MEP prochainement EPF-PRIMEVA - ANRS 135 mars 2007


































