POLARIDADE DE LIGAES COVALENTES E DE MOLCULAS Prof







- Slides: 15

POLARIDADE DE LIGAÇÕES COVALENTES E DE MOLÉCULAS Prof. Me. Lucas Skywalker

Linus Pauling • Prêmio Nobel de Química em 1954 e da Paz em 1962. • Famoso por suas pesquisas sobre estruturas moleculares e pela luta contra as armas nucleares.

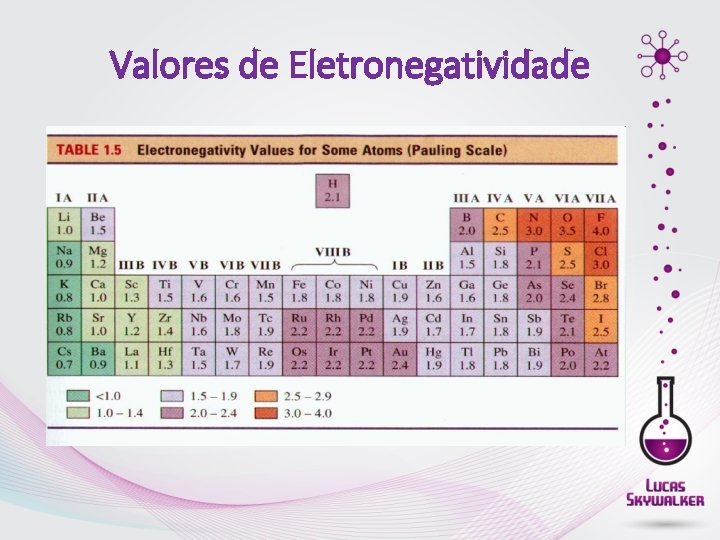
Eletronegatividade • É a tendência que o átomo de um determinado elemento apresenta para atrair elétrons, num contexto em que se acha ligado a outro átomo. F , O, N , Cl, Br, I, S, C, P, H, Metais. . . ELETRONEGATIVIDADE AUMENTA

Valores de Eletronegatividade

Ligação Polares e Apolares • Ligação covalente polar • δ+ δ- H ─ Cl ∆ = 3, 0 – 2, 1 = 0, 9 • Ligação covalente apolar • H ─ H ∆ = 2, 1 -2, 1 = 0

Ligação Iônica X Ligação Covalente ∆ Eletronegatividade 0 1, 6 3, 3 Ligações predominantemente covalentes iônicas EXEMPLOS • KCl ∆ = 3, 0 – 0, 8 = 2, 2 (IÔNICA) • Na. Cl ∆ = 3, 0 – 0, 9 = 2, 1 (IÔNICA) • Cl 2 ∆ = 3, 0 – 3, 0 = zero • Br. Cl ∆ = 3, 0 – 2, 8 = 0, 2 (COVALENTE POLAR) • HCl ∆ = 3, 0 – 2, 1 = 0, 9 (COVALENTE APOLAR) (COVALENTE POLAR)

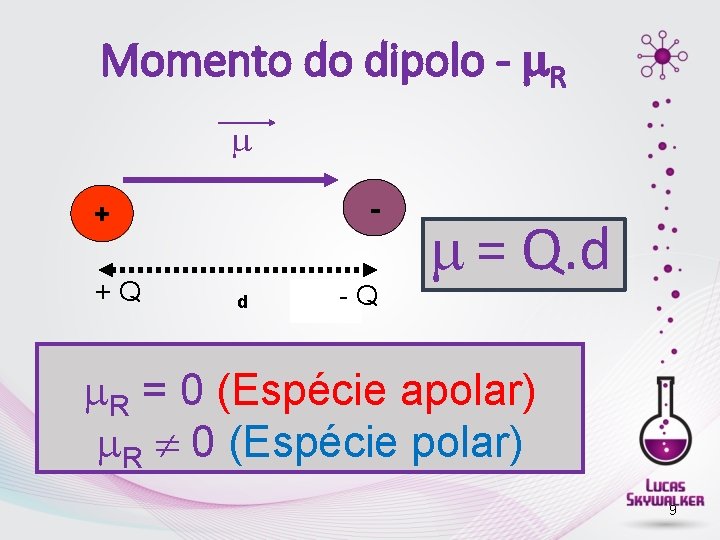
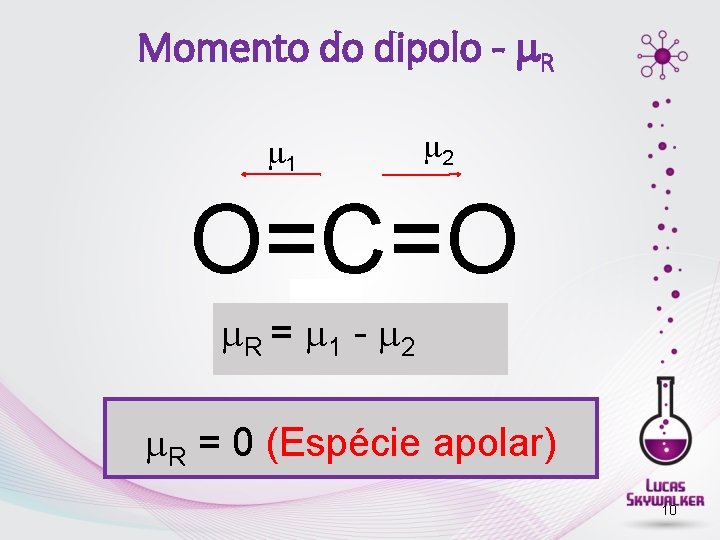
Polaridade de moléculas • A polaridade de uma molécula é verificada pelo valor do momento de dipolo µ • A polaridade de moléculas com mais de dois átomos é expressa por: µR (momento dipolo resultante). • H 2 H─H geometria linear → µR = 0 Apolar • HF H ─F geometria linear → µR ≠ 0 Polar • CO 2 O═C ═ O geometria linear → µR = 0 Apolar • HCN H ─ C≡N geometria linear → µR ≠ 0 Polar

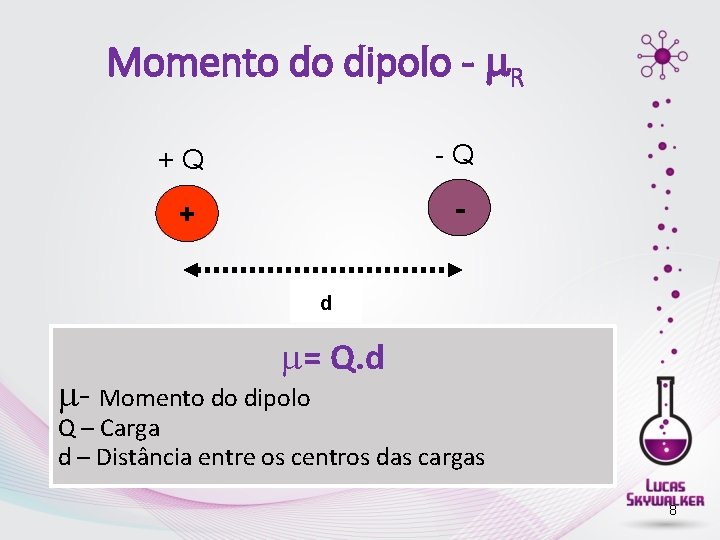
Momento do dipolo - R +Q -Q + d = Q. d - Momento do dipolo Q – Carga d – Distância entre os centros das cargas 8

Momento do dipolo - R - + +Q d -Q = Q. d R = 0 (Espécie apolar) R 0 (Espécie polar) 9

Momento do dipolo - R 1 2 O=C=O R = 1 - 2 R = 0 (Espécie apolar) 10

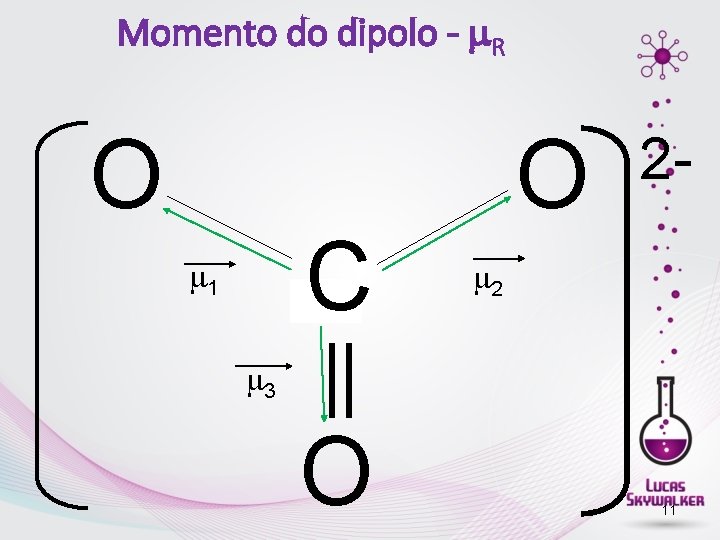
Momento do dipolo - R O C 1 O 2 - 2 3 O 11

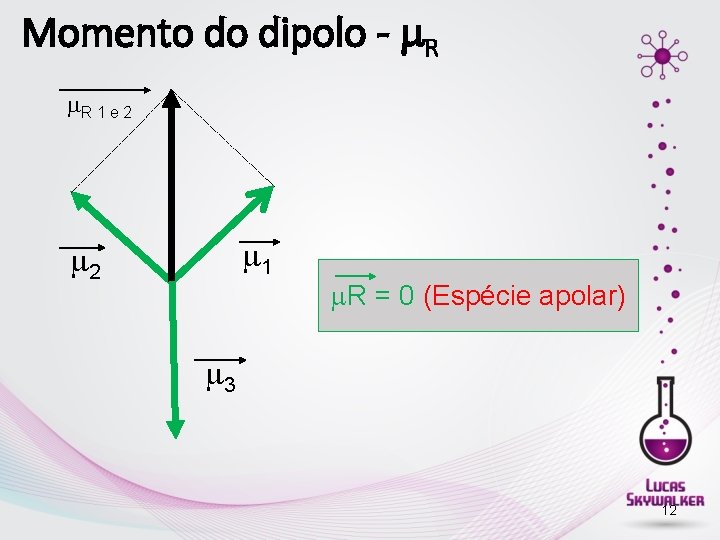
Momento do dipolo - R R 1 e 2 1 2 R = 0 (Espécie apolar) 3 12

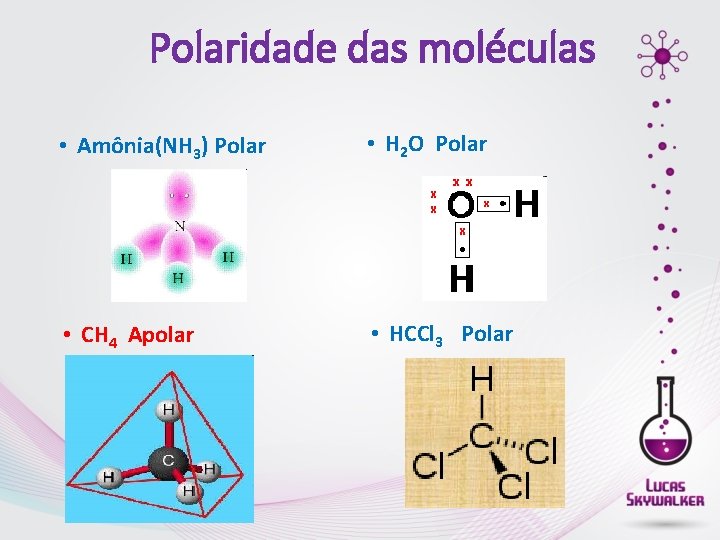
Polaridade das moléculas • Amônia(NH 3) Polar • H 2 O Polar • CH 4 Apolar • HCCl 3 Polar

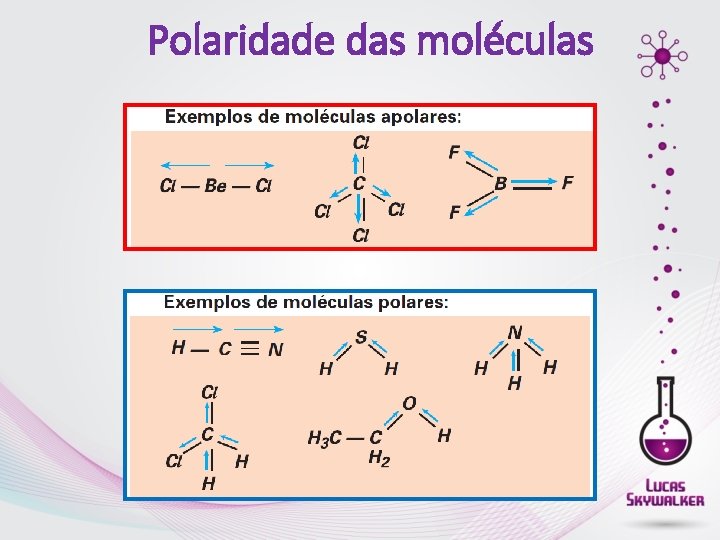
Polaridade das moléculas

“Que a FORÇA esteja com você”