Os Modelos atmicos O que O modelo atmico











- Slides: 13

Os Modelos atômicos

O que é ? �O modelo atômico nada mais é do que o modelo que se usa para representar um Átomo.

Pensamento Filosófico �Leucipo (450 a. C. ) Acreditava que a matéria podia ser dividida em partículas cada vez menores, até chegar-se a um limite. (470 a 380 a. C) Discípulo de Leucipo, acreditava que a matéria era descontínua, isto é, a matéria era formada por minúsculas partículas indivisíveis, as quais foram denominadas de átomo (que em grego significa "indivisível"). �Demócrito

Pensamento Científico � Dalton: Químico inglês, John Dalton, que viveu entre 1. 766 a 1. 825, afirmava que o átomo era a partícula elementar, a menor partícula que constituía a matéria. Em 1. 808, Dalton apresentou seu modelo atômico: o átomo como uma minúscula esfera maciça, indivisível, impenetrável e indestrutível. Para ele, todos os átomos de um mesmo elemento químico são iguais, até mesmo as suas massas. Hoje, nota-se um equívoco pelo fato da existência dos isótopos, os quais são átomos de um mesmo elemento químico mas que possuem entre si massas diferentes. Seu modelo atômico também é conhecido como "modelo da bola de bilhar".

Pensamento Científico � Thompson: O físico inglês J. J. Thompson demonstrou que os raios catódicos podiam ser interpretados como sendo um feixe de partículas carregadas de energia elétrica negativa, as quais foram chamadas de elétrons. Utilizando campos magnéticos e elétricos, Thompson conseguiu determinar a relação entre a carga e a massa do elétron. Com base em suas conclusões, Thompson colocou por terra o modelo do átomo indivisível e apresentou seu modelo, conhecido também como o "modelo de pudim com passas":

Modelo atômico de Dalton “bola de bilhar” Modelo atômico de Thompson “pudim de passas”

Pensamento Científico � Rutherford: Rutherford e seus colaboradores concluíram, através de experimentos, que o raio do átomo é 10. 000 vezes maior que o raio do núcleo. Comparando, se o núcleo de um átomo tivesse o tamanho de uma azeitona, o átomo teria o tamanho do estádio do Morumbi. Surgiu então em 1. 911, o modelo do átomo nucleado, conhecido como o modelo planetário do átomo: o átomo é constituído por um núcleo central positivo, muito pequeno em relação ao tamanho total do átomo porém com grande massa e ao seu redor, localizam-se os elétrons com carga negativa (compondo a "enorme" eletrosfera) e com pequena massa, que neutraliza o átomo.

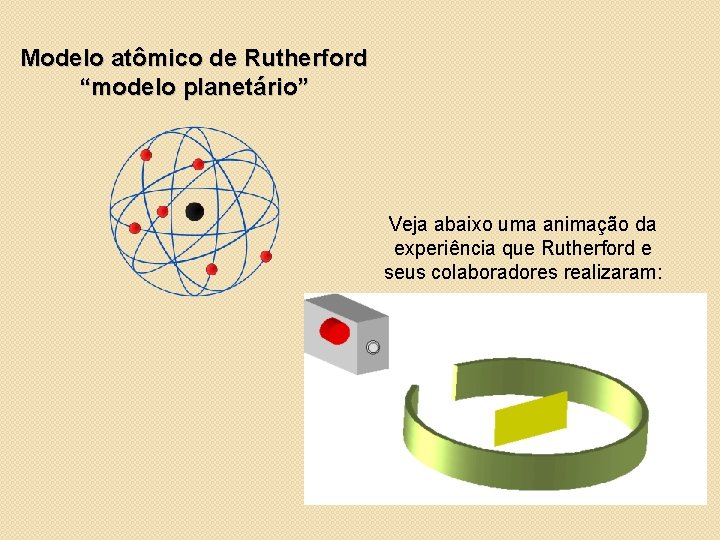
Modelo atômico de Rutherford “modelo planetário” Veja abaixo uma animação da experiência que Rutherford e seus colaboradores realizaram:

Pensamento Científico � Bohr: Bohr Niels Bohr dizia que no momento em que temos uma carga elétrica negativa composta pelos elétrons girando ao redor de um núcleo de carga positiva, este movimento gera uma perda de energia devido a emissão de radiação constante. Num dado momento, os elétrons vão se aproximar do núcleo num movimento em espiral e cair sobre si de duas formas: como onda e como partícula. � Sua teoria consistia que ao girar em torno de um núcleo central, os elétrons deveriam girar em órbitas específicas com níveis energizados. Realizando estudos nos elementos químicos com mais de dois elétrons, concluiu que se tratava de uma organização bem definida em orbitais. Descobriu ainda que as propriedades químicas dos elementos eram determinadas pelo orbital mais externo.

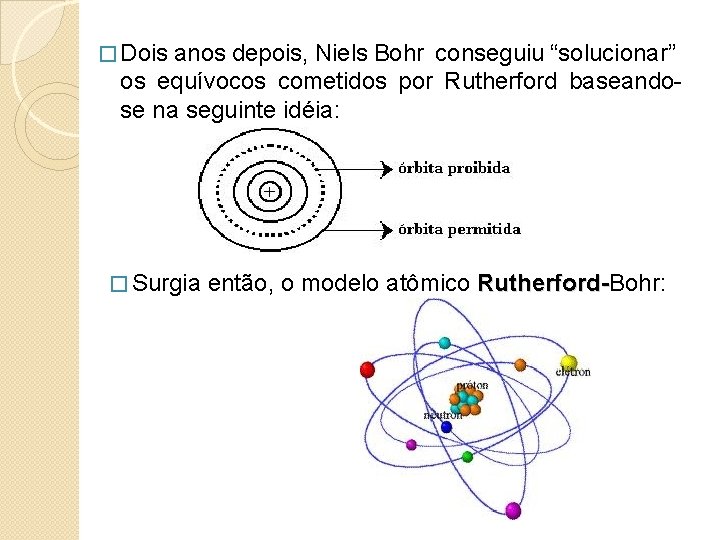
� Dois anos depois, Niels Bohr conseguiu “solucionar” os equívocos cometidos por Rutherford baseandose na seguinte idéia: � Surgia então, o modelo atômico Rutherford-Bohr: Rutherford-

� Se o elétron recebe energia ele pula para uma outra órbita mais afastada do núcleo. Pode ocorrer no elétron a perda de energia por irradiação, e sendo assim, o elétron cai para uma órbita mais próxima do núcleo. Todavia o elétron não pode ficar entre duas órbitas definidas, específicas, pois essa não seria uma órbita estável (órbita não específica). Conclui-se então que: quanto maior a energia do elétron, mais afastado ele está do núcleo. Em outras palavras: um elétron só pode estar em movimento ao redor do núcleo se estiver em órbitas específicas, definidas. � As órbitas permitidas constituem os níveis de energia do átomo (camadas K L M N. . . ).

Lei de Proust ou Lei das Proporções Definidas A lei de Proust pode ser enunciada da seguinte maneira: Quando duas ou mais substâncias se combinam para formar um composto, elas devem guardar entre si proporções certas e definidas. Ao fazer um bolo, Joana percebeu que com a quantidade de ingredientes para uma receita, este bolo não seria suficiente para que toda sua família pudesse saboreá-lo. Para fazer outro bolo que seja três vezes maior Joana precisa multiplicar a quantidade dos ingredientes três vezes. Da mesma maneira, se Joana quisesse fazer um bolo que seja a metade do primeiro, a medida de cada ingrediente deverá ser dividida por dois.

O raciocínio que fizemos para o caso de Joana é feito também pelos químicos ao realizar uma reação química. Isso porque quando duas substâncias reagem para formar um composto elas devem ser combinadas em quantidades proporcionais. Simplificadamente é isso que diz a Lei de Proust, ou Lei das proporções definidas. Exemplo: para obter sulfeto de ferro, devemos combinar o ferro e o enxofre na seguinte proporção: 7 partes de ferro para 4 partes de enxofre. Assim obtemos 11 partes de sulfeto de ferro. 7 g de ferro + 4 g de enxofre = 11 g de sulfeto de ferro Combinado 9 g de ferro com 4 g de enxofre, ainda assim conseguimos 11 g de sulfeto de ferro, mas sobram 2 g de ferro. 9 g de ferro + 4 g de enxofre = 11 g de sulfeto de ferro + 2 g de ferro (excesso)