NOMENCLATURA DE COMPUESTOS INORGNICOS Prof Sandra Gonzlez CHEM








- Slides: 14

NOMENCLATURA DE COMPUESTOS INORGÁNICOS Prof. Sandra González CHEM 203

COMPUESTOS INORGÁNICOS

Nomenclatura de compuestos binarios Este sistema de nomenclatura se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en la molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo H 2 O que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en la molécula.

PREFIJOS GRIEGOS Prefijos griegos Atomicidad mono- 1 di- 2 tri- 3 tetra- 4 penta- 5 hexa- 6 hepta- 7 octa- 8 nona- (o eneá) 9 deca- 10

PROCEDIMIENTO La forma de nombrar los compuestos es: prefijonombre genérico + prefijo-nombre específico ◦ Nombre genérico se refiere al tipo de compuesto. (Cloruros, hidruros, nitruros, óxidos, entre otros) ◦ Nombre específico se refiere a cuál, dentro de ese tipo de compuesto, se está nombrando Por ejemplo: HCl Nombre específico: Hidrógeno Nombre genérico: cloruro

PROCEDIMIENTO: PREFIJOS Prefijos griegos Antepuesto al nombre genérico, se escribe el profijo griego, de acuerdo al número de átomos presentes. Antepuesto al nombre específico, se escribe el profijo griego, de acuerdo al número de átomos presentes.

EJEMPLOS FÓRMULA DE COMPUESTO NOMBRE HCl* Monocloruro de hidrógeno H 2 S Monosulfuro de dihidrógeno CCl 4 Tetracloruro de carbono N 2 O 4 ** Tetróxido de dinitrógeno * Si solo hay un átomo del elemento de la izquierda, no se tiene que incluir el prefijo “mono” ** Si es un óxido, se le elimina la vocal final al prefijo que le antecede.

COMPUESTOS IÓNICOS Un compuesto iónico es aquel formado por un catión metálico y un anión (mono o poliatómico) no metal. ◦ Ejemplos: Na. Cl KMn. O 4 Na 2 CO 3 Fe(NO 3 )3 Ver Tabla 2. 3, Capítulo 1 del texto (pág. 61)

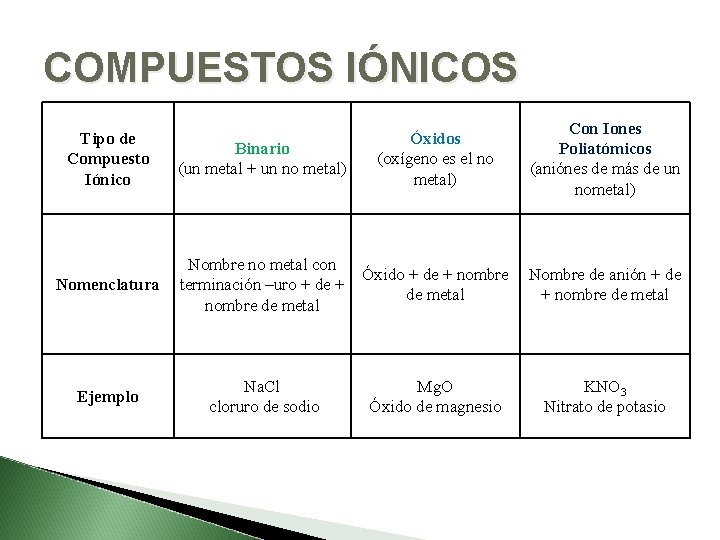
COMPUESTOS IÓNICOS Binario (un metal + un no metal) Óxidos (oxígeno es el no metal) Con Iones Poliatómicos (aniónes de más de un nometal) Nomenclatura Nombre no metal con terminación –uro + de + nombre de metal Óxido + de + nombre de metal Nombre de anión + de + nombre de metal Ejemplo Na. Cl cloruro de sodio Mg. O Óxido de magnesio KNO 3 Nitrato de potasio Tipo de Compuesto Iónico

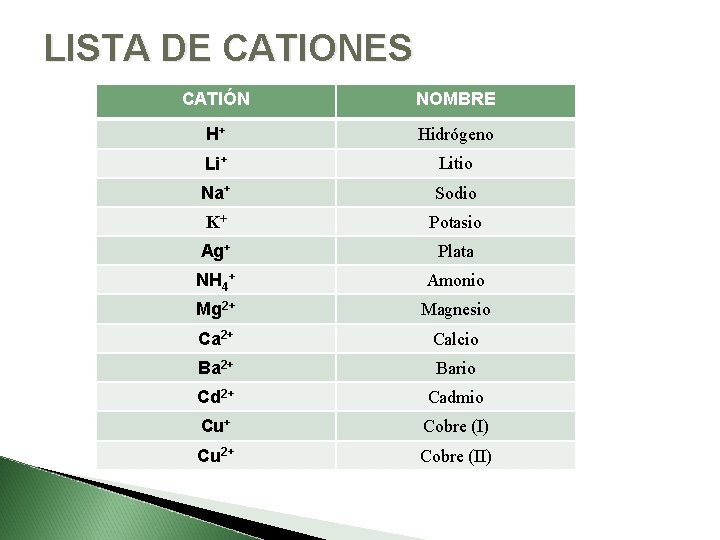
LISTA DE CATIONES CATIÓN NOMBRE H+ Hidrógeno Li+ Litio Na+ Sodio K+ Potasio Ag+ Plata NH 4+ Amonio Mg 2+ Magnesio Ca 2+ Calcio Ba 2+ Bario Cd 2+ Cadmio Cu+ Cobre (I) Cu 2+ Cobre (II)

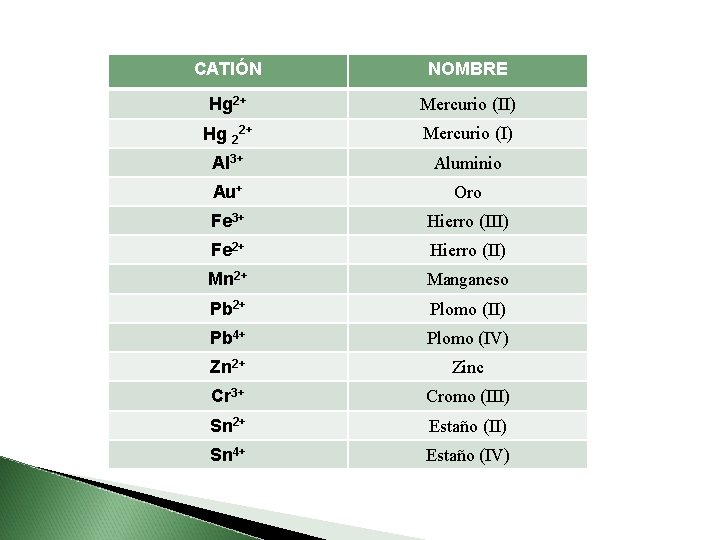
CATIÓN NOMBRE Hg 2+ Mercurio (II) Hg 22+ Mercurio (I) Al 3+ Aluminio Au+ Oro Fe 3+ Hierro (III) Fe 2+ Hierro (II) Mn 2+ Manganeso Pb 2+ Plomo (II) Pb 4+ Plomo (IV) Zn 2+ Zinc Cr 3+ Cromo (III) Sn 2+ Estaño (II) Sn 4+ Estaño (IV)

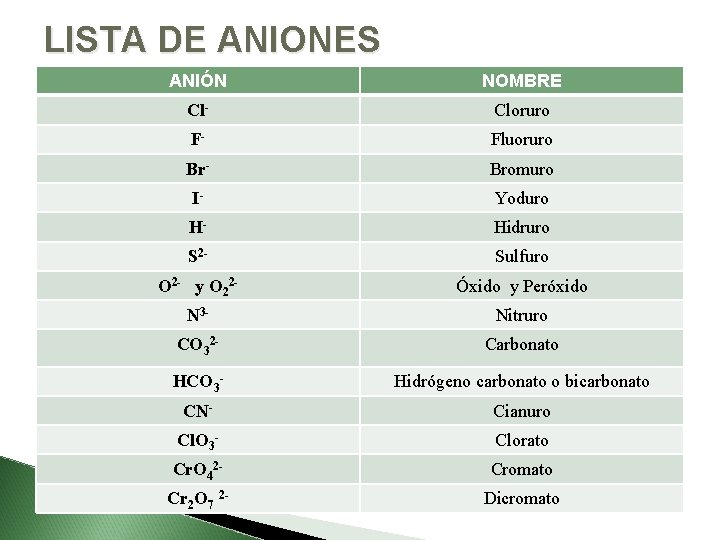
LISTA DE ANIONES ANIÓN NOMBRE Cl- Cloruro F- Fluoruro Br- Bromuro I- Yoduro H- Hidruro S 2 - Sulfuro O 2 - y O 22 - Óxido y Peróxido N 3 - Nitruro CO 32 - Carbonato HCO 3 - Hidrógeno carbonato o bicarbonato CN- Cianuro Cl. O 3 - Clorato Cr. O 42 - Cromato Cr 2 O 7 2 - Dicromato

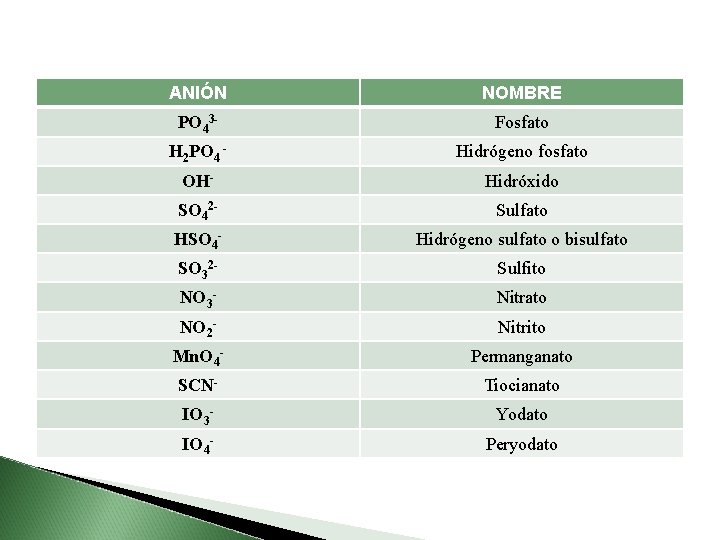
ANIÓN NOMBRE PO 43 - Fosfato H 2 PO 4 - Hidrógeno fosfato OH- Hidróxido SO 42 - Sulfato HSO 4 - Hidrógeno sulfato o bisulfato SO 32 - Sulfito NO 3 - Nitrato NO 2 - Nitrito Mn. O 4 - Permanganato SCN- Tiocianato IO 3 - Yodato IO 4 - Peryodato

PRÁCTICA