Molculas na Troposfera Parmetros de Ligao 1 Porque





- Slides: 16

Moléculas na Troposfera Parâmetros de Ligação 1

Porque será que os átomos estabelecem ligações entre si e formam moléculas? 2

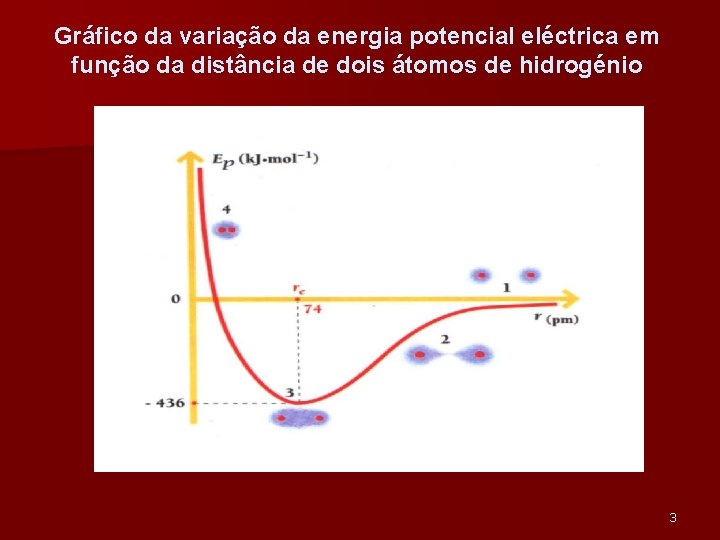
Gráfico da variação da energia potencial eléctrica em função da distância de dois átomos de hidrogénio 3

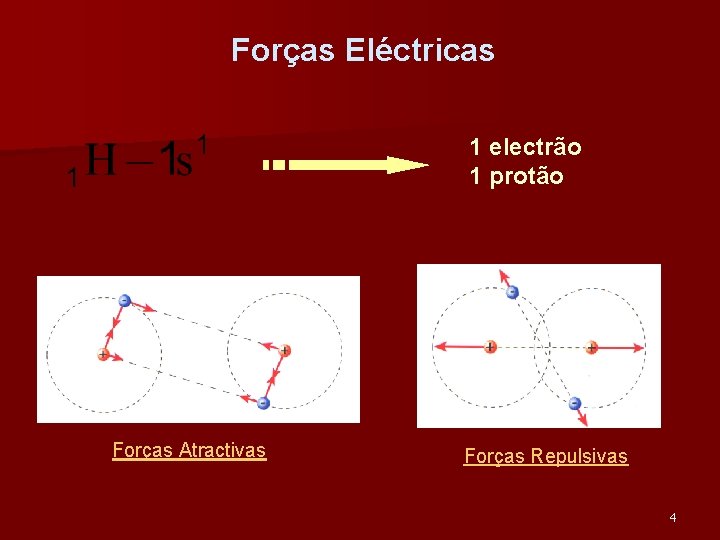
Forças Eléctricas 1 electrão 1 protão Forças Atractivas Forças Repulsivas 4

Forças eléctricas Forças atractivas Forças repulsivas entre cargas positivas e negativas (interacção núcleo-electrão), que tendem a aproximar os dois átomos; entre cargas do mesmo sinal (interacção electrão-electrão e núcleo-núcleo), que tendem a afastar os dois átomos; 5

Energia de ligação É a energia libertada quando se forma uma mole de moléculas a partir de átomos isolados e no estado gasoso. É um parâmetro importante, na informação que nos dá sobre a estabilidade da molécula. Quanto maior o valor da energia de ligação mais estável é essa ligação. 6

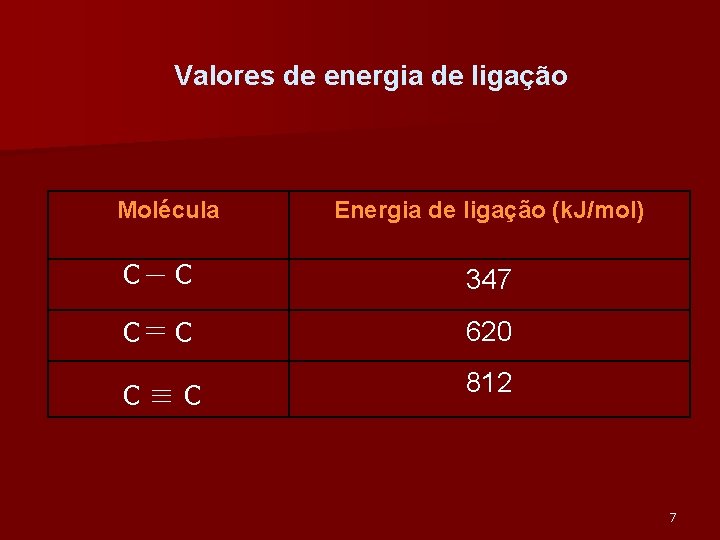
Valores de energia de ligação Molécula Energia de ligação (k. J/mol) C C 347 C C 620 C C 812 7

Comprimento de ligação É a distância média entre os núcleos de dois átomos ligados na posição de maior estabilidade. Este é um valor médio, pois a molécula não é uma entidade rígida, mas sim uma estrutura que é capaz de vibrar no espaço. 8

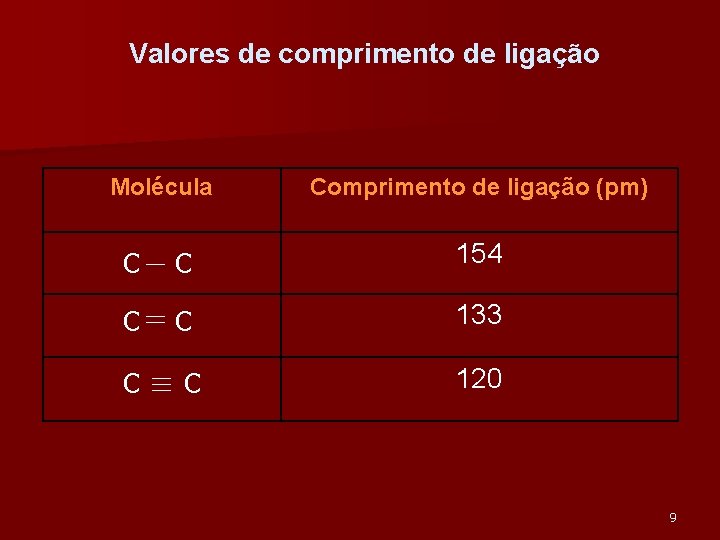
Valores de comprimento de ligação Molécula Comprimento de ligação (pm) C C 154 C C 133 C C 120 9

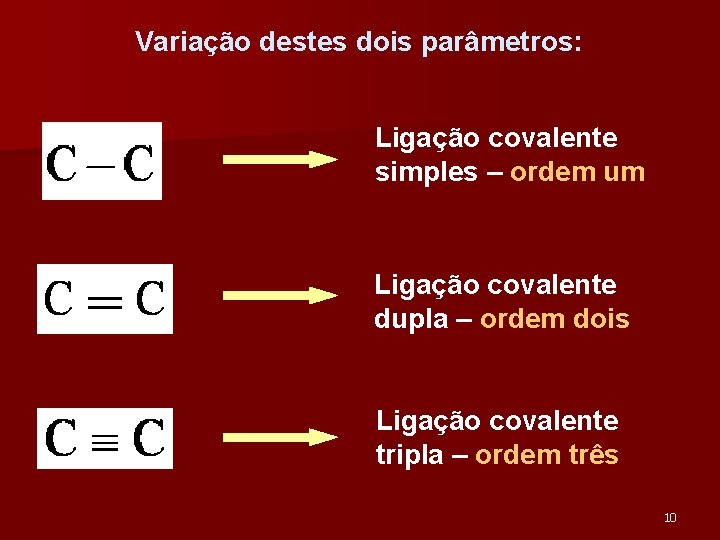
Variação destes dois parâmetros: Ligação covalente simples – ordem um Ligação covalente dupla – ordem dois Ligação covalente tripla – ordem três 10

Molécula Energia de ligação (k. J/mol) 347 Comprimento de ligação (pm) 154 C C 620 133 C C 812 120 Quando a ordem de ligação aumenta, a energia de ligação também aumenta, pois há mais electrões a serem partilhados. Quando a ordem de ligação aumenta, o comprimento de ligação diminui, pois como há mais electrões a serem partilhados, os átomos aproximam-se mais, tornando a ligação mais forte. 11

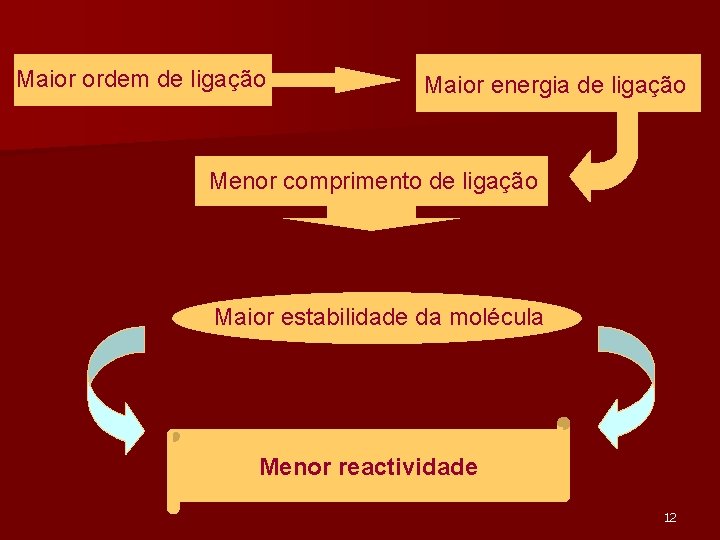
Maior ordem de ligação Maior energia de ligação Menor comprimento de ligação Maior estabilidade da molécula Menor reactividade 12

Geometria molecular É o arranjo espacial dos átomos que constituem a molécula de modo a minimizar as repulsões. ngulo de ligação Menor ângulo formado pelos dois segmentos de recta que passam pelo centro do núcleo de um átomo central e pelos centros dos núcleos de dois átomos a ele ligados. 13

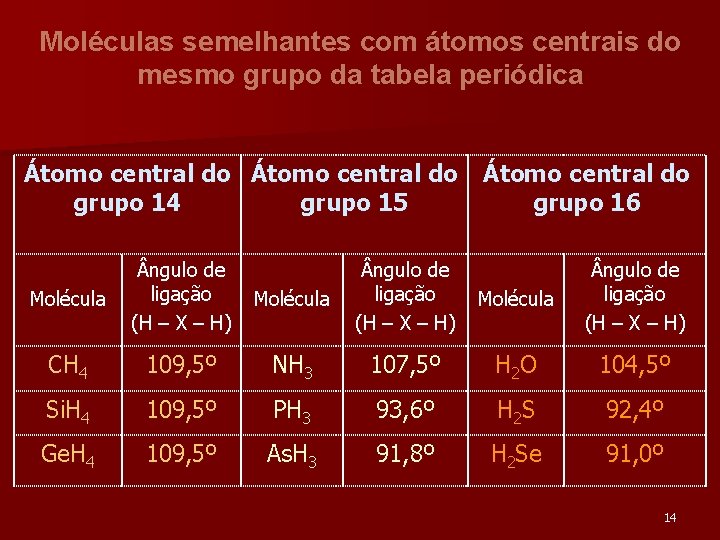
Moléculas semelhantes com átomos centrais do mesmo grupo da tabela periódica Átomo central do grupo 14 grupo 15 Molécula ngulo de ligação (H – X – H) CH 4 Átomo central do grupo 16 Molécula ngulo de ligação (H – X – H) 109, 5º NH 3 107, 5º H 2 O 104, 5º Si. H 4 109, 5º PH 3 93, 6º H 2 S 92, 4º Ge. H 4 109, 5º As. H 3 91, 8º H 2 Se 91, 0º 14

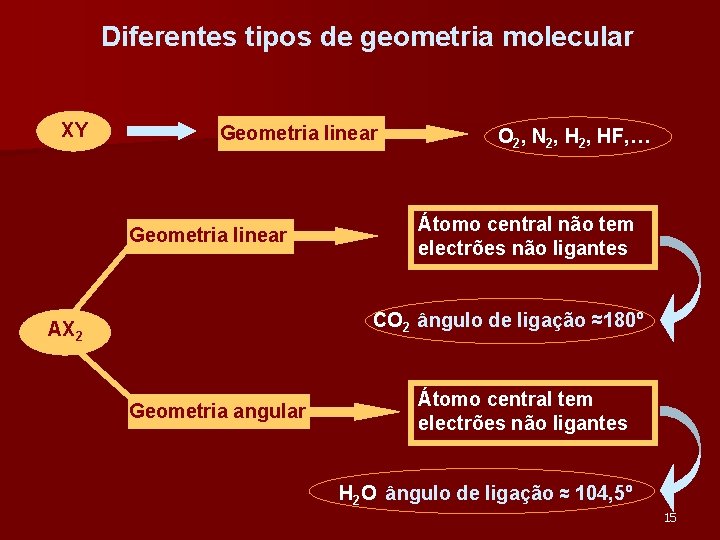
Diferentes tipos de geometria molecular XY Geometria linear O 2, N 2, HF, … Átomo central não tem electrões não ligantes CO 2 ângulo de ligação ≈180º AX 2 Geometria angular Átomo central tem electrões não ligantes H 2 O ângulo de ligação ≈ 104, 5º 15

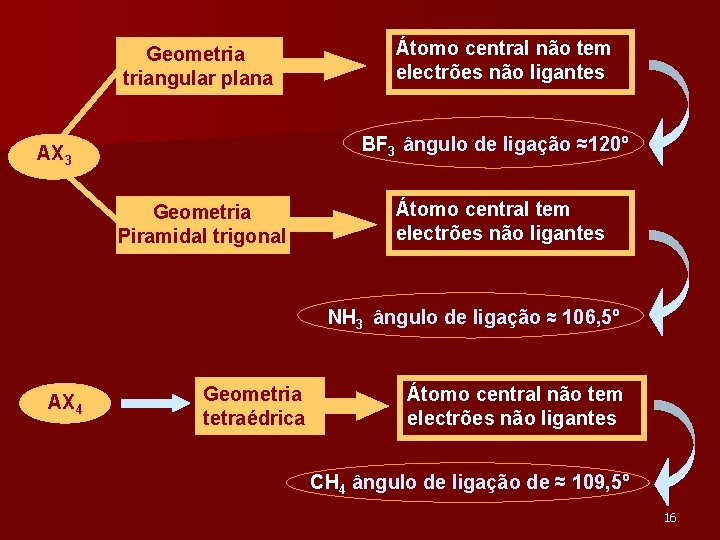
Geometriangular plana Átomo central não tem electrões não ligantes BF 3 ângulo de ligação ≈120º AX 3 Geometria Piramidal trigonal Átomo central tem electrões não ligantes NH 3 ângulo de ligação ≈ 106, 5º AX 4 Geometria tetraédrica Átomo central não tem electrões não ligantes CH 4 ângulo de ligação de ≈ 109, 5º 16