MISE AU POINT Solutions dtailles des questions 7







![On remplace dans l’équation, on tire l’expression de [HCO 3 -] : [HCO 3 On remplace dans l’équation, on tire l’expression de [HCO 3 -] : [HCO 3](https://slidetodoc.com/presentation_image/33226c7453549482a2fbbad4c537b2b1/image-9.jpg)


![Corrigé de la question 8 (suite) Le système est : [A-] + [AH] = Corrigé de la question 8 (suite) Le système est : [A-] + [AH] =](https://slidetodoc.com/presentation_image/33226c7453549482a2fbbad4c537b2b1/image-12.jpg)

![Question 10 (suite) Calculer [Na +]. un seul choix autorisé 1. 80 2. 72 Question 10 (suite) Calculer [Na +]. un seul choix autorisé 1. 80 2. 72](https://slidetodoc.com/presentation_image/33226c7453549482a2fbbad4c537b2b1/image-14.jpg)



- Slides: 17

MISE AU POINT Solutions détaillées des questions 7 à 10 du quizz_2_niveau_1

Énoncé question 7 On considère une solution maintenue sous une p. CO 2 fixe et contenant : - 1/ d’une part du bicarbonate de sodium, - 2/ d’autre part un tampon univalent de p. K 6, 8 et de concentration totale 60 mmol. l-1 (tampon ANa/AH). Interprétation de l’énoncé : voire diapos suivantes ↓

p. CO 2 et solubilité A l'équilibre, la pression partielle d'un gaz au-dessus d'un liquide détermine la concentration maximale (de saturation) que présentera ce gaz dans le liquide. Cette propriété est exprimée par la loi de Henry : la solubilité d'un gaz dans un liquide est proportionnelle à sa pression partielle au-dessus du liquide. La solubilité du gaz dissous diminue avec la température La constante d'équilibre (ou constante de Henry) s'écrit : Donc la loi de Henry relie la concentration du gaz dissous à sa pression partielle lorsqu’il est sous forme gazeuse au-dessus de la solution

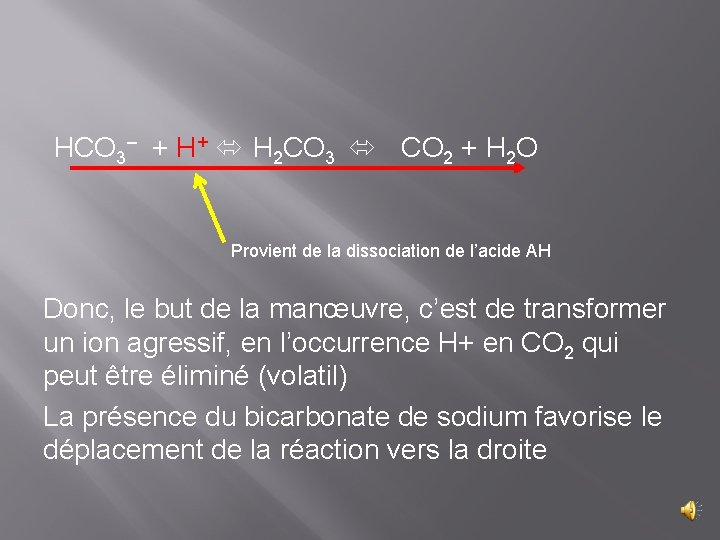
1/ Le bicarbonate de sodium (l'hydrogénocarbonate de sodium en nomenclature moderne), formule chimique Na. HCO 3 se dissocie en Na+ et HCO 3− : Na. HCO 3 Na+ + HCO 3− L’ion bicarbonate est amphotère, lorsqu’il capte un proton, il forme l’acide carbonique lequel produit du CO 2 dissous et de l’eau : (couple CO 2 dissous /HCO 3− ) HCO 3– + H+ H 2 CO 3 CO 2 + H 2 O La double flèche indique la réaction est une réaction d’équilibre, elle se fait dans les deux sens, ce qui explique la présence du CO 2 gazeux et donc d’une pression partielle de CO 2 au dessus de la solution (acide volatil)

HCO 3– + H+ H 2 CO 3 CO 2 + H 2 O Provient de la dissociation de l’acide AH Donc, le but de la manœuvre, c’est de transformer un ion agressif, en l’occurrence H+ en CO 2 qui peut être éliminé (volatil) La présence du bicarbonate de sodium favorise le déplacement de la réaction vers la droite

2/ Tampon ANa/AH de p. Ka = 6. 8 Ce tampon représente la composante fixe des acides car il ne se volatilise pas contrairement au CO 2. L’acide AH libère un proton : AH A- + H+ L’ion sodium Na+ s’associe à l’ion A- + Na+ ANa Donc on a l’acide fixe AH et sa base conjuguée est A-, La concentration totale de ce tampon est égale à 60 mmol/L, c’est-à-dire : [A-] + [AH] = 60 mmol/L

La question 7 La p. CO 2 est fixée à 40 mm Hg ; le p. H est égal à 7, 4. Calculer [HCO 3 -] un seul choix autorisé 1. 40 2. 38 3. 36 4. 34 5. 30 6. 24

Corrigé question 7 On utilise l’équation de Henderson-Hasselbach : 6, 1 représente le p. Ka du tampon bicarbonate a = 0. 03 coefficient de dissolution du CO 2 à 37°C p. CO 2 la pression partielle du CO 2 Données : p. CO 2 = 40 mm. Hg et p. H = 7, 4 Dans cette équation, si on maintient deux gradeurs constantes (p. H et p. CO 2), alors la troisième est aussi constante ([HCO 3 -])
![On remplace dans léquation on tire lexpression de HCO 3 HCO 3 On remplace dans l’équation, on tire l’expression de [HCO 3 -] : [HCO 3](https://slidetodoc.com/presentation_image/33226c7453549482a2fbbad4c537b2b1/image-9.jpg)
On remplace dans l’équation, on tire l’expression de [HCO 3 -] : [HCO 3 -] = 0. 03 x 40 x 10 (7. 4 – 6. 1) = 0. 03 x 40 x 101. 3 = 0. 03 x 40 x 19. 95 = 23. 94 ≈ 24 Donc : [HCO 3 -] ≈ 24 mmol/L proposition 6

Énoncé question 8 (suite) La p. CO 2 est toujours fixée à 40 mm Hg et le p. H égal à 7, 4. Calculer [A-] un seul choix autorisé 1. 54 2. 48 3. 42 4. 38 5. 32 6. 30

Corrigé de la question 8 Les deux tampons sont au même p. H = 7, 4 Donc si on applique l’équation de Henderson. Hasselbach au tampon fixe on a : (1) Par ailleurs, on sait que : [A-] + [AH] = 60 mmol/L (2) On a donc un système de deux équations à deux inconnues [A-] et [AH]
![Corrigé de la question 8 suite Le système est A AH Corrigé de la question 8 (suite) Le système est : [A-] + [AH] =](https://slidetodoc.com/presentation_image/33226c7453549482a2fbbad4c537b2b1/image-12.jpg)
Corrigé de la question 8 (suite) Le système est : [A-] + [AH] = 60 [A-] = [AH]. 10 (7, 4 – 6, 8) La résolution de ce système par la méthode de substitution donne à la fois : [AH] = [A-]. 10 -(7, 4 - 6, 8) = [A-]. 10 -0, 6 [A-] + [A-]. 10 -0, 6 = 60 [A-]. (1 + 10 -0, 6 ) = 60 [A-]. 0, 251 = 60 D’où [A-] = 48 mmol/L proposition 2

Question 9 (suite) La p. CO 2 est toujours fixée à 40 mm Hg et le p. H égal à 7, 4. Calculer [AH] un seul choix autorisé 1. 40 2. 24 [A-] + [AH] = 60 3. 20 Et on a [A-] = 48 mmol/L 4. 16 5. 12 6. 10
![Question 10 suite Calculer Na un seul choix autorisé 1 80 2 72 Question 10 (suite) Calculer [Na +]. un seul choix autorisé 1. 80 2. 72](https://slidetodoc.com/presentation_image/33226c7453549482a2fbbad4c537b2b1/image-14.jpg)
Question 10 (suite) Calculer [Na +]. un seul choix autorisé 1. 80 2. 72 3. 48 4. 24 5. 12 6. 10

Corrigé de la question 10 On applique le principe de l’électro-neutralité à la solution. Elle contient les ions suivants : HCO 3 -, A-, Na+, mais aussi H+ et OH- dont les concentrations peuvent être négligées lorsque le p. H n’est ni trop faible ni trop élevé ou si les solutions ne sont pas trop diluées. Donc : [HCO 3 -] + [A-] = [Na+] On remplace [HCO 3 -] = 24 mmol/L Et [A-] = 48 mmol/L 24 + 48 = 72 mmol/L = [Na+] proposition 2

POUR CEUX QUI N’ONT PAS PU ASSISTER… L’enregistrement sera déposé (si possible) sur la PF, Sinon, je vous enverrai le document

PROCHAINE ET DERNIÈRE SÉANCE LE 07/07/20 Le diagramme de Davenport et étude des déséquilibres acidobasiques
 Des des des
Des des des Objectives in making sandwich
Objectives in making sandwich Bar opening checklist
Bar opening checklist Mise en scene definition
Mise en scene definition Mise en place mesa
Mise en place mesa Elements of mise en scene
Elements of mise en scene Multidimensionelle
Multidimensionelle Mise en scene lighting
Mise en scene lighting Intranet mise lavoro agile
Intranet mise lavoro agile Need a service chapter 5
Need a service chapter 5 Proxemic patterns
Proxemic patterns Mise en scene staging
Mise en scene staging Parcours citoyen exemple
Parcours citoyen exemple Mise en scene
Mise en scene Gerli sirk
Gerli sirk Plan assemblage
Plan assemblage Carte pass carmillon sncf
Carte pass carmillon sncf Grand budapest hotel mise en scene
Grand budapest hotel mise en scene