Metody analytick chemie a chemick vyuvaj reakc s











- Slides: 13

Metody analytické chemie a) chemické - využívají reakcí s postřehnutelnými změnami - změna barvy, tvorba nebo rozpuštění sraženiny. . . b) fyzikální - využívají změn fyzikálních vlastností - index lomu, elektrická vodivost. . c) fyzikálně - chemické - kombinace předcházejících Podle množství analyzovaného vzorku rozeznáváme: druh analýzy množství analyzované látky v g makroanalýza nad 0, 1 semimikroanalýza 0, 01 -0, 1 mikroanalýza 0, 001 -0, 01 ultramikroanalýza pod 0, 001

Kvalitativní analytická chemie - zabývá se důkazem. Používá metody: Analýza na suché cestě - zkoumá vzhled látky, její zabarvení, homogenitu, tvrdost, tvar krystalů, rozpustnost a další fyzikální vlastnosti. Metody rozboru suchou cestou jsou mimo jiné: 1. Orientační zkoušky: vzhled vzorku: barva, zápach, chování na vzduchu 2. plamenná zkouška: využívá schopnosti některých prvků zabarvit nesvítivý plamen. Popis metody: platinový drátek ( lze nahradit jiným kovem ) zvlhčíme ve zředěné HCl, vyžíháme a naneseme vzorek analyzované látky. Drátek vložíme do spodní části oxidačního plamene a sledujeme zabarvení.


3. perličková zkouška: Využívá schopnosti látek reagovat za zvýšení teploty s kovy za vzniku barevných sloučenin. Tato schopnost se využívá při výrobě barevných skel. Boraxová perlička ( borax - Na 2 B 4 O 7. 10 H 2 O ) - na očko vyžíhaného platinového drátku zachytíme borax a roztavíme jej v nesvítivé části plamene. Vyžíhání provádíme tak dlouho, dokud se nevytvoří bezbarvá průhledná kulička. Na ni zachytíme nepatrné množství zkoumané látky a nejprve zahříváme v oxidačním, pak v redukčním plameni.

4. Barva roztoků • • • Fe 2+ - zelená Fe 3+ - rezavě hnědá Cu 2+ - modrá Ni 2+ - zelená Mn 2+ - světle růžová Mn 7+ - fialová Co 2+ - růžová až červená Cr 3+ - fialová Cr 6+ - žlutá (Cr 2 O 7)2 - - oranžová

Analytická chemie Kvalitativní analýza Podstata - důkaz přítomnosti složky ve vzorku. Provedení 1. Vzorek určený k analýze se rozpustí ve vhodném rozpouštědle. 2. Provedení srážecích reakcí. 3. Na základě vzniku charakteristicky zbarvených sraženin a jejich případné rozpustnosti v nadbytku srážecího činidla či jiného rozpouštědla se dokáže přítomnost složky ve vzorku. Zápis chemické reakce 1. Vyčíslená chemická rovnice , vyznačení sraženiny šipkou ↓ 2. Úplný iontový zápis 3. Částečný iontový zápis

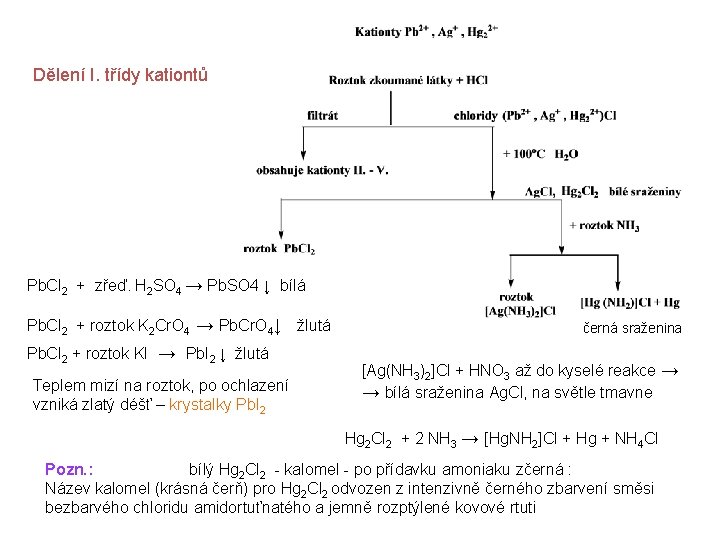
Dělení kationtů do analytických tříd I. Analytická třída ionty olovnaté, rtuťné, stříbrné, thalné Sráží se sulfanem v kyselém prostředí sulfidy nerozpustné v polysulfidu amonném (NH 4)2 Sx vytvářejí ve vodě nerozpustné chloridy Skupinové činidlo - HCl II a. Analytická třída ionty rtuťnaté, bismutité, měďnaté, kademnaté Sráží se sulfanem v kyselém prostředí sulfidy nerozpustné v polysulfidu amonném (NH 4)2 Sx vytvářejí ve vodě rozpustné sulfidy Skupinové činidlo – H 2 S II b. Analytická třída ionty arsenité, arseničné, antimonité, antimoničné, cínaté, ciničité Se sulfanem tvoří sraženinu rozpustnou v (NH 4)2 Sx za tvorby komplexů. Skupinové činidlo – H 2 S

III. Analytická třída ionty železnaté, železité, nikelnaté, manganaté, chromité, hlinité, zinečnaté, kobaltnaté Nesrážejí se HCl ani H 2 S v kyselém prostředí srážejí se za přítomnosti NH 4 Cl sulfidem amonným popřípadě sulfanem v zásaditém prostředí jako: sulfidy - Fe, Ni, ‚Co, Zn, Mn hydroxidy - Al, Cr Skupinové činidlo – (NH 4)2 S IV. Analytická třída ionty barnaté, strontnaté, vápenaté Srážejí se v přítomnosti NH 4 Cl uhličitanem amonným jako uhličitany Skupinové činidlo – (NH 4)2 CO 3 V. Analytická třída Skupinové činidlo není ionty hořečnaté, sodné, draselné, amonné

Dělení I. třídy kationtů Pb. Cl 2 + zřeď. H 2 SO 4 → Pb. SO 4 ↓ bílá Pb. Cl 2 + roztok K 2 Cr. O 4 → Pb. Cr. O 4↓ žlutá Pb. Cl 2 + roztok KI → Pb. I 2 ↓ žlutá Teplem mizí na roztok, po ochlazení vzniká zlatý déšť – krystalky Pb. I 2 černá sraženina [Ag(NH 3)2]Cl + HNO 3 až do kyselé reakce → → bílá sraženina Ag. Cl, na světle tmavne Hg 2 Cl 2 + 2 NH 3 → [Hg. NH 2]Cl + Hg + NH 4 Cl Pozn. : bílý Hg 2 Cl 2 - kalomel - po přídavku amoniaku zčerná : Název kalomel (krásná čerň) pro Hg 2 Cl 2 odvozen z intenzivně černého zbarvení směsi bezbarvého chloridu amidortuťnatého a jemně rozptýlené kovové rtuti

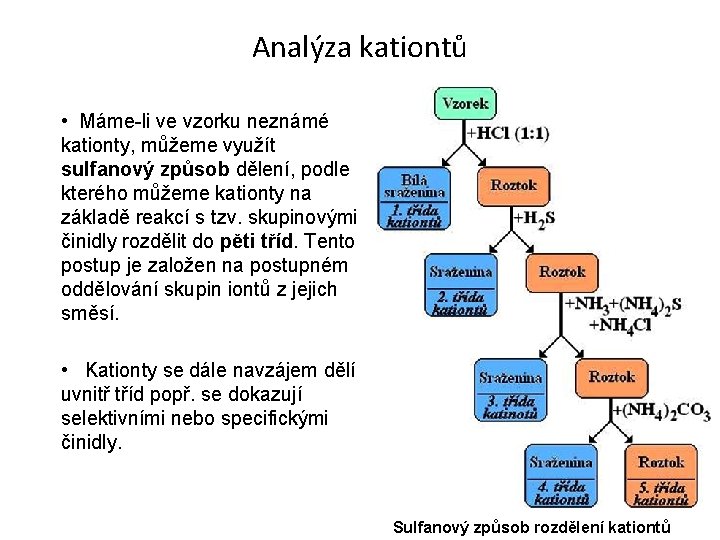
Analýza kationtů • Máme-li ve vzorku neznámé kationty, můžeme využít sulfanový způsob dělení, podle kterého můžeme kationty na základě reakcí s tzv. skupinovými činidly rozdělit do pěti tříd. Tento postup je založen na postupném oddělování skupin iontů z jejich směsí. • Kationty se dále navzájem dělí uvnitř tříd popř. se dokazují selektivními nebo specifickými činidly. Sulfanový způsob rozdělení kationtů

Procvičování Do kolika tříd dělíme kationty podle sulfanového dělícího postupu? Dělíme do pěti tříd. Jaké skupinové činidlo sráží kationty I. třídy? Kyselina chlorovodíková (HCl). Do které analytické třídy patří následující kationty: Ag+, Hg 22+, Pb 2+ Která třída kationtů se nesráží s žádným činidlem sulfanového postupu? V. třída kationtů.

Procvičování Vyberte správné tvrzení: Lithium barví plamen červeně. Plamenné zkoušky se nejlépe provádí na špejli. Měď vytváří žlutý plamen. Podle zbarvení plamene můžeme hlavně rozlišit alkalické kovy alkalických zemin. Mangan i bor zbarvují plamen zeleně. Pro plamenné zkoušky se nejlépe hodí sulfidy příslušných kovů.

Přiřaďte správně: Sodík Baryum Lithium Měď
 Reakc
Reakc Adriana chemick
Adriana chemick Kyselina manganistá vzorec
Kyselina manganistá vzorec Adriana chemick
Adriana chemick Hydroxidy vzorce
Hydroxidy vzorce Adriana chemick
Adriana chemick Koncovky oxidačných čísel
Koncovky oxidačných čísel Metody radzenia sobie ze stresem w pracy nauczyciela
Metody radzenia sobie ze stresem w pracy nauczyciela Metody doboru pracowników
Metody doboru pracowników Sformuowałem
Sformuowałem Vuky
Vuky Inaczej metoda francuska b
Inaczej metoda francuska b Metody i zasady pomiarów okablowania strukturalnego
Metody i zasady pomiarów okablowania strukturalnego Siedmiopunktowy plan rodgera
Siedmiopunktowy plan rodgera