METALLID Martin Saar GAG 2008 Vajalikud alateemad metallide





















- Slides: 24

METALLID Martin Saar GAG 2008

Vajalikud alateemad • metallide võrdlev iseloomustus – (aatomi ehitus, keemiline aktiivsus, A- ja B-rühmade metallide erinevused elektronide arv väliskihil, oa muutuvus. . . ); – metallid redutseerijana; – metallide keemilised omadused (reageerimine mittemetallidega, veega, lahjendatud hapetega, soolalahustega); • • metallid praktikas; metallide saamine maagist; elektrolüüsi põhimõte ja kasutusalad; keemiline vooluallikas (tööpõhimõte, reaktsioonivõrrandeid nõudmata);

1. Metallidest üldiselt • Metallid on. . . – koondunud perioodilisussüsteemis alla vasakule – nad hõlmavad esimesed A-rühmad ja B-rühmad. – välisel elektronkihil vähe elektrone (1 -3) – aatomiraadius suhteliselt suur – elektronegatiivsus võrdlemisi madal – Keemilistes reaktsioonides vaid redutseerijad – oa ühendites on positiivne

1. Metallidest üldiselt • Metallilised omadused tugevnevad: – Rühmas ülevalt alla • Suureneb elektronkihtide arv ja aatomi raadius • Nõrgeneb side tuuma ja väliskihi elektronide vahel – Perioodis paremalt vasakule • Väheneb tuumalaeng, elektronkihtide arv jääb samaks • Nõrgeneb tuuma mõju väliskihi elektronidele, aatomi raadius suureneb, väliskihi elektronid kaugenevad tuumast.

2. FÜÜSIKALISED OMADUSED Üldised omadused: – Elektri- ja soojusjuhtivus – Plastilisus – Metalne läige Erinevad füüsikalised omadused: – Tihedus – Sulamistemperatuur (tahked, va Hg) – Värvus (hallikad või valged, va Au, Cu) – Magnetiseeritavus (on Fe, Co, Ni)

3. KEEMILISED OMADUSED • Metallid lihtainena käituvad keemilistes reaktsioonides vaid – redutseerijana, – nad loovutavad elektrone, – ise oksüdeerudes. Keemilist aktiivsust iseloomustab pingerida: – kõige aktiivsemad metallid (parimad redutseerijad) on vasakul ja vähemaktiivsemad paremal, – Li K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn. Pb H 2 Cu Ag Hg Au – sellest tuleb võrrandeid kirjutades lähtuda.

3. KEEMILISED OMADUSED METALL + MITTEMETALL Ühinemisreaktsioon • metall + hapnik oksiid – 2 Mg + O 2 2 Mg. O • metall + halogeen halogeniid (sool) – 2 Li + Br 2 2 Li. Br • metall + väävel sulfiid (sool) – 2 Na + S Na 2 S • Saaduses on: – metall positiivse OAga, – mittemetall negatiivsega (tavaliselt minimaalsega)

3. KEEMILISED OMADUSED METALL + HAPE SOOL + VESINIK Asendusreaktsioon • Lahjendatud hapetega (va HNO 3) reageerivad metallid, mis on pingereas vesinikust vasakul – Ca + 2 HCl Ca. Cl 2 +H 2 – 3 Ca + 2 H 3 PO 4 Ca 3(PO 4)2 + 3 H 2 – Cu + HCl ei toimu • Raua reageerimisel lahjendatud hapetega tekib raud(II)sool, – sest lahjendatud hape pole liiga tugev oksüdeerija! – Fe + H 2 SO 4 Fe. SO 4 + H 2 – Raud passiveerub kontsentreeritud väävelhappe toimel.

3. KEEMILISED OMADUSED METALL + VESI • Aktiivsed metallid (K-Mg) ehk IA ja IIA al Ca/Mg-st – metall + vesi leelis + vesinik – Ca + 2 H 2 O Ca(OH)2 +H 2 – 2 K + 2 H 2 O 2 KOH +H 2 • Keskmise aktiivsusega metallid (Al-Fe), nt Zn, Fe – metall + veeaur oksiid + vesinik – 3 Fe + 4 H 2 O Fe 3 O 4 + 4 H 2 – Zn + H 2 O Zn. O + H 2 • Väheaktiivsed metallid (Ni-Au) vee ega veeauruga ei reageeri

3. KEEMILISED OMADUSED METALL + SOOLALAHUS • Aktiivsem metall tõrjub vähemaktiivse tema soolalahusest välja – metall + sool uus metall + uus sool – Zn + Cu. Cl 2 Zn. Cl 2 + Cu – Pb + 2 Ag. NO 3 Pb(NO 3)2 + 2 Ag • Leelis- ja leelismuldmetallide korral – toimub enne metalli reaktsioon veega, – selle käigus tekib leelis, – mis reageerib edasi ise soolalahusega. Nt Na + Cu. SO 4 – 2 Na + 2 H 2 O 2 Na. OH + H 2 – 2 Na. OH + Cu. SO 4 Cu(OH)2 + Na 2 SO 4 Summaarselt: 2 Na + 2 H 2 O + Cu. SO 4 Cu(OH)2↓ + Na 2 SO 4+ H 2

4. METALLIDE SAAMINE • Enamik metalle esineb looduses ühenditena, ehedalt ehk lihtainena on vaid väheaktiivseid metalle. • Maak – kivim (mineraal), kus on metalli looduslikke ühendeid märkimisväärses koguses • Tootmise protsess: – Maagi rikastamine (nt kullaliiva pesemine, tavaliselt maak ka purustatakse) – Redutseerimine: • • • vesinikuga: Cu. O + H 2 Cu + H 2 O koksiga: Fe 2 O 3 + 3 C 2 Fe + 3 CO koksi põlemisel tekkiva CO-ga: Fe 2 O 3 + 3 CO 2 Fe + 3 CO 2 alumiiniumiga: (aluminotermia): Fe 2 O 3 + 2 Al 2 Fe + Al 2 O 3 või elektrivooluga – vt elektrolüüs

5. SULAMID • Sulamid on kahe või enama metalli või metalli ja mittemetalli kokkusulatamisel saadud materjalid. • Nende omadused: – Tavaliselt madalam sulamistemperatuur kui koostisosadel (nt jootetina) – Tavaliselt kõvemad ja vastupidavamad kui koostismetallid (duralumiinium) • Olulisi sulameid: – malm, teras, duralumiinium, pronks, messing. . .

6. SJ ELEKTROKEEMIASSE • Mõned mõtted enne õppima asumist: – Elektroodid on põhimõtteliselt laenguga plaadikesed/pulgakesed – Anoodil toimub alati oksüdeerumine ehk elektronide loovutamine – Katoodil toimub alati redutseerumine ehk elektronide liitmine • Et katoodi ja anoodi määrab ära neil toimuv protsess, siis on nende laengud galvaanielemendis ja elektrolüüsi korral erinevad. Sellest ei tohiks end häirida lasta: nimetus sõltub toimuvast protsessist, st oksüdeerumisest või redutseerumisest.

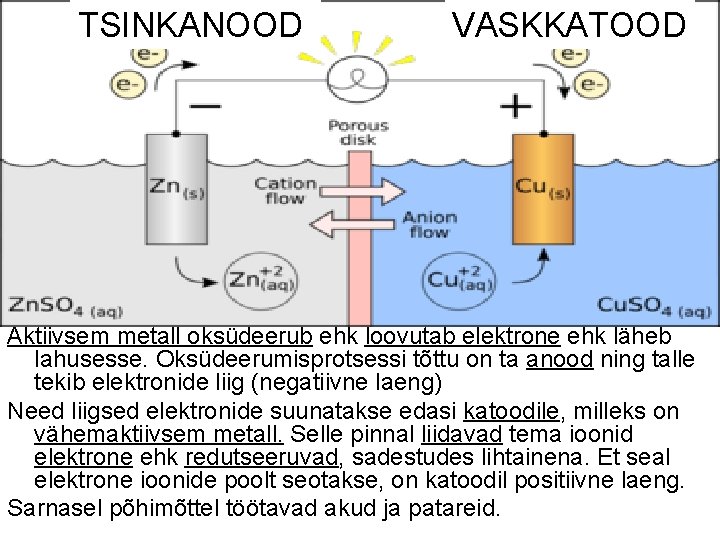
6. GALVAANIELEMENT • Keemilises vooluallikas muundub keemiline energia elektrienergiaks: – Eraldame oksüdeerumise ja redutseerumise protsessi erinevatesse ruumiosadesse – Suuname elektronid, mis redutseerija loovutab. . . – Elektronide liitjale ehk oksüdeerijale juhet pidi. . . – Tekib vool keemiline vooluallikas ehk galvaanielement

TSINKANOOD VASKKATOOD Aktiivsem metall oksüdeerub ehk loovutab elektrone ehk läheb lahusesse. Oksüdeerumisprotsessi tõttu on ta anood ning talle tekib elektronide liig (negatiivne laeng) Need liigsed elektronide suunatakse edasi katoodile, milleks on vähemaktiivsem metall. Selle pinnal liidavad tema ioonid elektrone ehk redutseeruvad, sadestudes lihtainena. Et seal elektrone ioonide poolt seotakse, on katoodil positiivne laeng. Sarnasel põhimõttel töötavad akud ja patareid.

7. KORROSIOON • Korrosioon on metallide hävimine ümbritseva keskkonna toimel. – Metall on redutseerija rollis: • loovutab elektrone ja oksüdeerub oksüdeerija toimel. • Eristatakse: – Keemiline korrosioon • otsene reaktsioon oksüdeerijaga; • kuivades gaasides kõrgel temperatuuril (nt rauatagi Fe 3 O 4 teke raua pinnal kuivas õhuhapnikus kõrgel temperatuuril) – Elektrokeemiline korrosioon • toimub metalli pinnal olevad elektrolüüdikihis; • neutraalses keskkonnas on oksüdeerija õhuhapnik O 2 + 2 H 2 O + 4 e- 4 OH– • happelises keskkonnas on oksüdeerija vesinikioon H+ 2 H+ + 2 e- H 2

7. KORROSIOON • Korrosiooni soodustab: – oksüdeeruva metalli kokkupuude vähemaktiivsema metalliga või lisandiga: – siis jaotuvad oksüdeerumis- ja redutseerumisprotsessid nii: • aktiivsem metall taas oksüdeerub ehk loovutab elektrone ehk on taas anoodiks (nagu galvaanielemendis) • vähemaktiivsem metall on taas katoodiks, selle pinnal aga ei redutseeru ehk liida elektrone mitte vastavad ioonid, vaid redutseerub nüüd O 2 või H+.

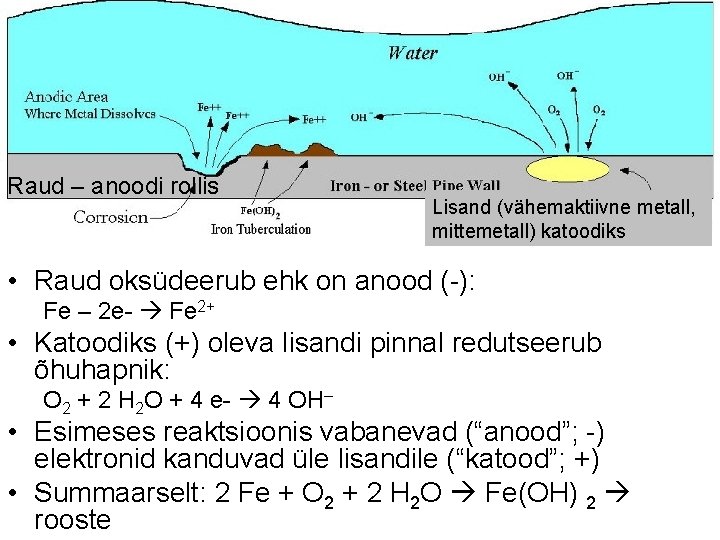
Raud – anoodi rollis Lisand (vähemaktiivne metall, mittemetall) katoodiks • Raud oksüdeerub ehk on anood (-): Fe – 2 e- Fe 2+ • Katoodiks (+) oleva lisandi pinnal redutseerub õhuhapnik: O 2 + 2 H 2 O + 4 e- 4 OH– • Esimeses reaktsioonis vabanevad (“anood”; -) elektronid kanduvad üle lisandile (“katood”; +) • Summaarselt: 2 Fe + O 2 + 2 H 2 O Fe(OH) 2 rooste

7. KORROSIOON Korrosioonikaitse võimalused – Metalli isolatsioon: • värvimine, lakkimine, õlitamine, • vastupidavama metalli kihiga katmine – Elektrokeemiline kaitse – protektorkaitse: • metalli külge pannakse aktiivsema metalli tükk, • mis hakkab anoodina oksüdeeruma põhimetalli asemel – Korrosiooniinhibiitori kasutamine • keemiline aeglustaja, negatiivne katalüsaator

Kokkuvõttev mõte • Elektrokeemilises korrosioonis ja töötavas galvaanielemendis on: – kontaktis kaks erineva aktiivsusega metalli (või korrosioonis metall ja mittemetall) – aktiivsem metall oksüdeerub, annab ära elektrone, läheb üle lahusesse (ühendiks) ning on anood. Tal kujuneb elektronide liig ja seetõttu laeng “–”. – Vähemaktiivne metall (või mittemetalne lisand) on aga katood. • Galvaanielemendis toimus tema pinnal vastavate ioonide poolt elektronide liitmine ehk redutseerumine (laeng on katoodil “+”, sest elektronide “puudujääk” selle liitmise tõttu) • Elektrokeemilises korrosioonis liitis tema pinnal elektrone ehk redutseerus oksüdeerijana käituv hapnik või H+.

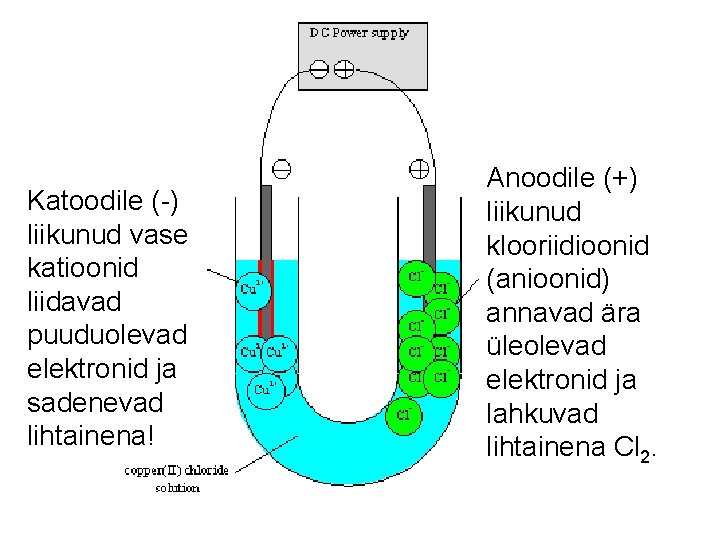
8. ELEKTROLÜÜS • Elektrolüüs on – redoksreaktsioon, – mis toimub elektrolüüdi lahuses või sulas elektrolüüdis – elektroodide pinnal elektrivoolu toimel, kus elektrienergia muundub keemiliseks energiaks! • Võtame näiteks vask(II)kloriidi Cu. Cl 2 vesilahuse – Katioonid (+) liiguvad sedakorda elektronide liiaga katoodile (-): • Seal nad liidavad puuduolevad elektronid ehk redutseeruvad (nagu katoodil ikka!) • Cu 2+ + 2 e- Cu↓ – Anioonid (-) liiguvad elektronide defitsiidiga anoodile (+): • Seal nad loovutavad liigsed elektronid ehk oksüdeeruvad (nagu anoodil ikka!) • 2 Cl– - 2 e- Cl 2↑

Katoodile (-) liikunud vase katioonid liidavad puuduolevad elektronid ja sadenevad lihtainena! Anoodile (+) liikunud klooriidioonid (anioonid) annavad ära üleolevad elektronid ja lahkuvad lihtainena Cl 2.

8. ELEKTROLÜÜS • Aktiivsete metallide katioonide korral redutseerub katoodil hoopis vesi: – 2 H 2 O + 2 e- 2 OH- + H 2 • Hapnikhapete anioonide korral oksüdeerub anoodil vesi: – 2 H 2 O – 4 e- 4 H+ + O 2 • Seega leiab nt Na 2 SO 4 elektrolüüsil aset tegelikult vaid vee elektrolüüs: – 2 H 2 O 2 H 2 + O 2

8. ELEKTROLÜÜS • Elektrolüüsi kasutatakse: – aktiivsete metallide tootmiseks • Na saadakse sula Na. Cl elektrolüüsil • Al saadakse sulatatud Al 2 O 3 elektrolüüsil – toormetallide puhastamine – keemiatööstuse toorainete saamiseks • Na. Cl vesilahuse elektrolüüsil saadakse vesinikku, kloori ja naatriumhüdroksiidi: • Katoodil: 2 H 2 O + 2 e- 2 OH- + H 2 • Anoodil: 2 Cl– - 2 e- Cl 2 Tervikuna: 2 Na. Cl + 2 H 2 O 2 Na. OH + H 2 + Cl 2
 Peegeldumisvõime
Peegeldumisvõime Metallide aktiivsusrida
Metallide aktiivsusrida Reaktsioonivõrrandi tasakaalustamine
Reaktsioonivõrrandi tasakaalustamine Martin saar õpetaja
Martin saar õpetaja 2008 2008
2008 2008 Iron gag
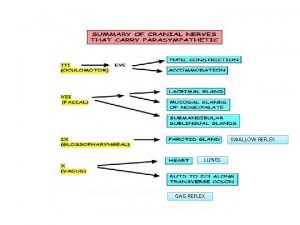
Iron gag Gag swallow reflexes
Gag swallow reflexes Expulsion de los judios de españa
Expulsion de los judios de españa Site:slidetodoc.com
Site:slidetodoc.com Gags tipograficos
Gags tipograficos Mouth gag airway
Mouth gag airway Ethical norms
Ethical norms Sensory innervation of nose
Sensory innervation of nose Lyman beecher apush
Lyman beecher apush Grading of reflexes
Grading of reflexes Geenitriiv näide
Geenitriiv näide Heteropolisacaridos gag
Heteropolisacaridos gag Triem
Triem Universaalindikaator
Universaalindikaator Metallide aktiivsuse rida
Metallide aktiivsuse rida Metallide pingerida
Metallide pingerida Metallide elektrijuhtivus
Metallide elektrijuhtivus Site:slidetodoc.com
Site:slidetodoc.com Saar läänemeres
Saar läänemeres Aare saar
Aare saar