Licenciatura em Cincias da Arte e do Patrimnio
































- Slides: 42

Licenciatura em Ciências da Arte e do Património Química e Física dos Materiais I Tópico 1 Conceitos básicos: átomos, moléculas e iões. Estados da matéria. Noções elementares de nomenclatura Departamento de Química e Bioquímica 1

Estudio de Jan van Eyck 2

3

Química Ciência que estuda a estrutura, as propriedades e as transformações da matéria Exemplos de actividades desenvolvidas pelos químicos: -Purificação de pigmentos de origem mineral - Obtenção de solventes (ex. destilação) - Obtenção de resinas naturais - Extracção de óleos a partir de sementes - Obtenção de pasta de papel a partir da madeira - Extracção de corantes (a partir de moluscos, insectos ou plantas) - Análise da composição (ex. restauro de argamassas históricas) e prevenção da degradação de materiais (ex. corrosão de metais) 4

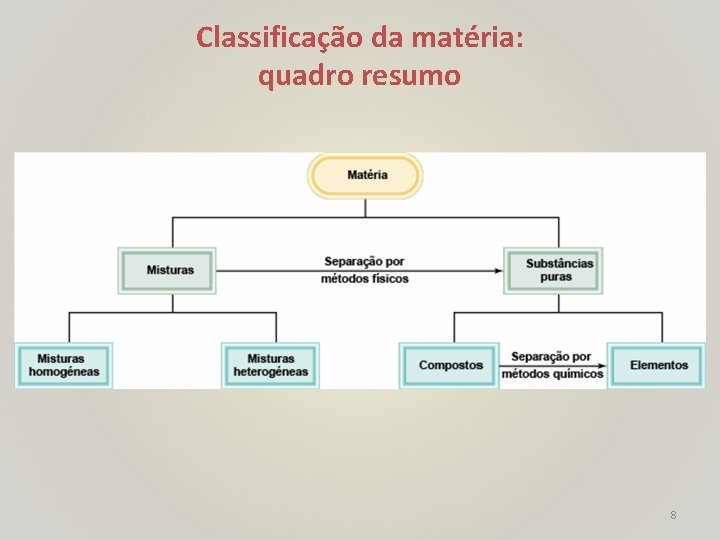
Classificação da Matéria • Matéria: tudo o que ocupa espaço e tem massa. • Substância: forma de matéria composição definida (constante) e propriedades características(ex. : água, ouro, amónia, acetona). • Mistura: combinação de duas ou mais substâncias em que estas conservam a sua identidade. Pode ser homogénea (composição uniforme, ex. gasolina, bronze) ou heterogénea (granito, estrato pictórico). • Elemento: substância que não pode ser separada em substâncias mais simples por processos químicos (ex. Al, Ca, por processos químicos Pb). • Composto: substância composta por átomos de dois ou mais elementos quimicamente unidos em proporções fixas 5

Propriedades físicas da matéria podem ser observadas e medidas sem alterar a composição ou a identidade da substância (ex. fusão, dureza, resistência à tensão, dissolução de um verniz). Propriedades químicas da matéria envolvem reacções químicas e a correspondente transformação da matéria (ex. corrosão de metais; alteração da cor de vernizes e resinas devido a reacções do tipo ácido-base). 6

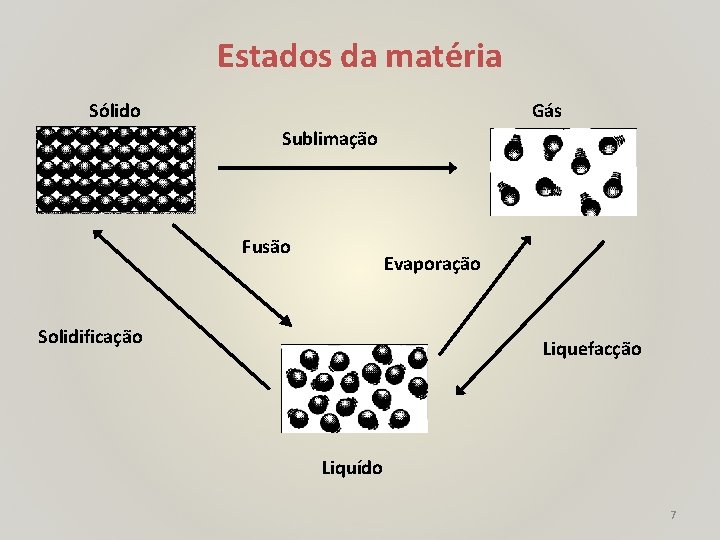
Estados da matéria Sólido Gás Sublimação Fusão Evaporação Solidificação Liquefacção Liquído 7

Classificação da matéria: quadro resumo 8

Elemento químico Um elemento químico é uma substância que não pode ser separada em substâncias mais simples por processos químicos. Até agora foram identificados 113 elementos • 82 elementos ocorrem naturalmente na Terra ex. : ouro, alumínio, chumbo, oxigénio, carbono • 31 elementos foram criados por cientistas ex. : tecnécio, amerício, seaborgio 9

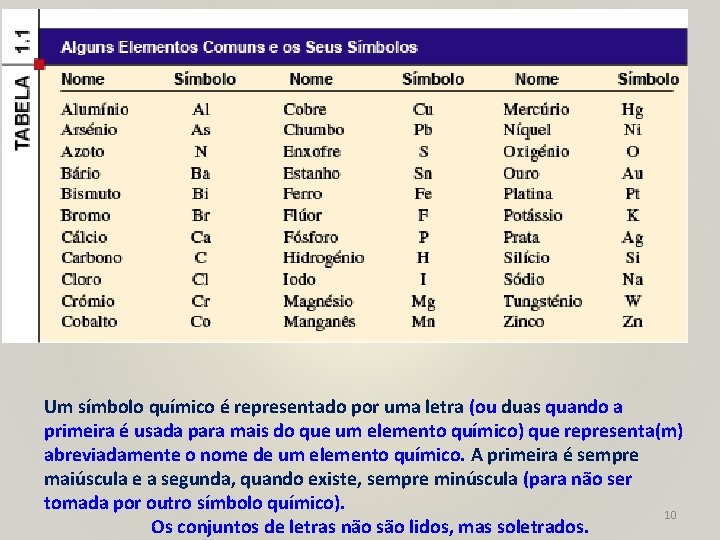
Um símbolo químico é representado por uma letra (ou duas quando a primeira é usada para mais do que um elemento químico) que representa(m) abreviadamente o nome de um elemento químico. A primeira é sempre maiúscula e a segunda, quando existe, sempre minúscula (para não ser tomada por outro símbolo químico). 10 Os conjuntos de letras não são lidos, mas soletrados.

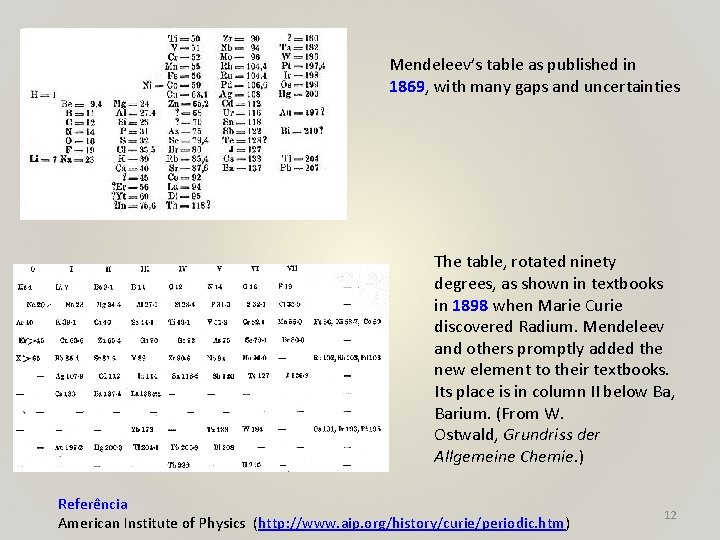
Dimitri Mendeleev descobriu a lei da periodicidade dos elementos (1889) e criuou a primeira Tabela Periódica dos elementos "The law of periodicity first allowed us to perceive undiscovered elements at a distance which formerly was inaccessible to chemical vision. " (extracto da conferência dada por Dimitri Mendeleev na Chemical Society, em Londres, vinte anos depois da sua descoberta das leis da periodicidade dos elementos em 1889) 11

Mendeleev’s table as published in 1869, with many gaps and uncertainties The table, rotated ninety degrees, as shown in textbooks in 1898 when Marie Curie discovered Radium. Mendeleev and others promptly added the new element to their textbooks. Its place is in column II below Ba, Barium. (From W. Ostwald, Grundriss der Allgemeine Chemie. ) Referência American Institute of Physics (http: //www. aip. org/history/curie/periodic. htm) 12

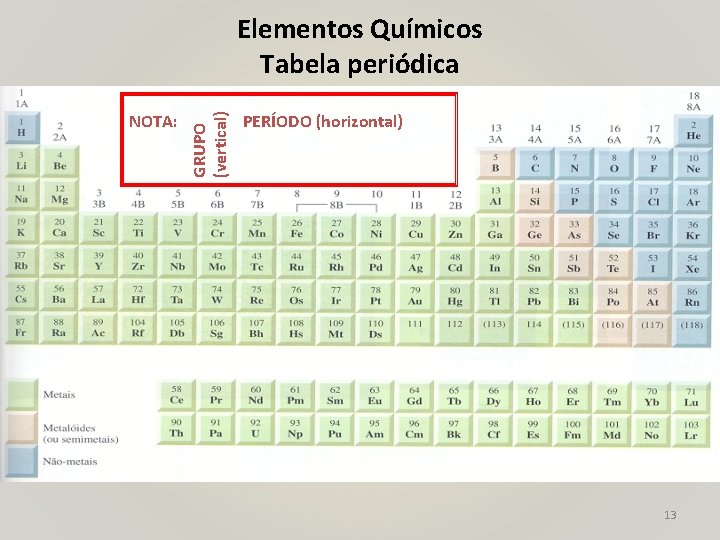
NOTA: GRUPO (vertical) Elementos Químicos Tabela periódica PERÍODO (horizontal) 13

14

15

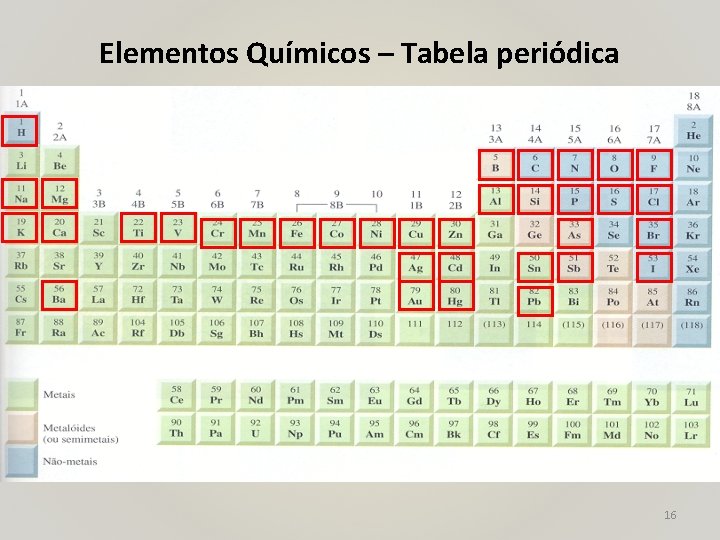
Elementos Químicos – Tabela periódica 16

Um composto é uma substância composta de átomos de dois ou mais elementos quimicamente unidos em proporções fixas. Os compostos apenas podem ser separados nos seus componentes puros (elementos) por processos químicos. Água (H 2 O) Amoníaco (NH 3) Glucose (C 6 H 12 O 6) 17

Teoria Atómica de Dalton (1808) 1. Os elementos são constituídos por partículas extremamente pequenas chamadas átomos. Todos os átomos de um dado elemento são idênticos, tendo a mesma dimensão, massa e propriedades químicas. Os átomos de um elemento são diferentes dos átomos de todos os outros elementos. 2. Os compostos são constituídos por átomos de mais de um elemento. Em qualquer composto, a razão entre os números de átomos de quaisquer dois elementos presentes é um número inteiro ou uma fracção simples. 3. Uma reacção química envolve apenas a separação, combinação ou rearranjo dos átomos; não resulta na sua criação ou destruição. 18

Átomos - formado por protões, neutrões e electrões número de massa número de atómico A Z X número atómico: número de protões (igual ao número de electrões) O número atómico representa-se pela letra maiúscula Z e coloca-se do lado esquerdo do símbolo químico, em índice inferior e corresponde ao número de protões nucleares do átomo. É característico de um dado elemento, identificando-o, caracterizando-o e permitindo distingui-lo de outro qualquer. Dado que, num átomo, o número de cargas positivas (dado pelo número atómico) é igual ao de cargas negativas, o valor do número atómico informa, indirectamente, que o número de cargas negativas, electrões) é igual. 19

Átomos - formado por protões, neutrões e electrões número de massa número de atómico A Z X número de massa: número de protões + número de neutrões O número de massa representa-se pela letra maiúscula A e coloca-se do lado esquerdo do símbolo químico, em índice superior e corresponde à soma do número de protões com o número de neutrões que um átomo possui no núcleo. Pode variar dentro do mesmo elemento devido à variação do número de neutrões no caso dos isótopos. 20

Átomos - formado por protões, neutrões e electrões Isótopos Dentro do mesmo elemento o número de neutrões que um átomo possui no núcleo pode variar. Quando tal acontece está-se na presença de isótopos. Exemplo: isótopos do átomo de carbono: 12 6 C 14 C 6 21

Trabalhando a definição de isótopo Quantos protões, neutrões e electrões existem em 14 6 C 6 protões, 8 (14 – 6) neutrões, 6 electrões Quantos protões, neutrões e electrões existem em 11 6 C 6 protões, 5 (11 – 6) neutrões, 6 electrões 22

Trabalhando a definição de massa atómica média Massa atómica média (6, 941) Metais Metalóides A massa atómica é a quantidade de matéria existente num átomo, fazendo-se corresponder este valor à massa do núcleo Exprime-se em unidades de massa atómica (u, ou d) ou sem unidade, tratando-se da massa atómica relativa, quando resulta da comparação entre a massa absoluta do átomo e a massa tomada como padrão de comparação (1/12 da massa do carbono 12) Não-metais 23

Trabalhando a definição de massa atómica média Não confundir “número de massa” com “massa atómica” Exemplo 7 Li (7, 016 u) O Lítio é: 7, 42% 6 Li (6, 015 u) e 92, 58% Li Li Massa atómica média do lítio: 7, 42 × 6, 015 u + 92, 58 × 7, 016 u = 6, 941 u 100 24

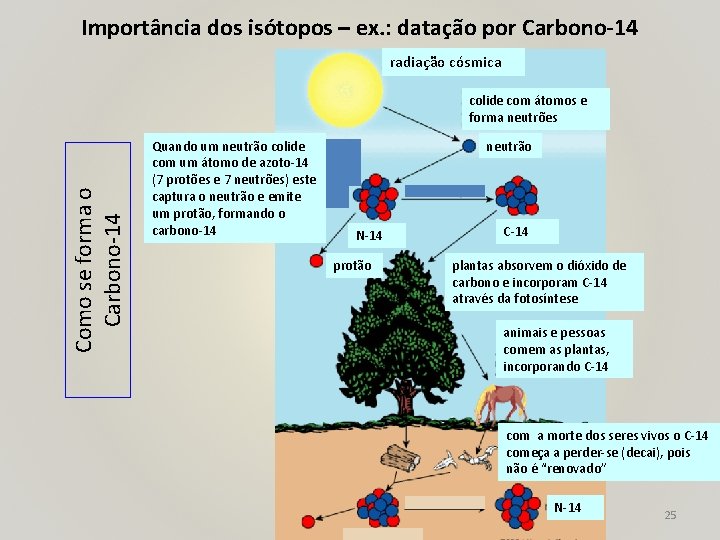
Importância dos isótopos – ex. : datação por Carbono-14 radiação cósmica Como se forma o Carbono-14 colide com átomos e forma neutrões Quando um neutrão colide com um átomo de azoto-14 (7 protões e 7 neutrões) este captura o neutrão e emite um protão, formando o carbono-14 neutrão N-14 protão C-14 plantas absorvem o dióxido de carbono e incorporam C-14 através da fotosíntese animais e pessoas comem as plantas, incorporando C-14 com a morte dos seres vivos o C-14 começa a perder-se (decai), pois não é “renovado” N-14 25

Moléculas - agregados de pelo menos dois átomos ligados de uma forma precisa por forças químicas (ligação química) H 2 (diatómica) H 2 O (poliatómica) 26

Iões São formados a partir de átomos ou grupos de átomos e são espécies que têm uma carga negativa ou positiva Exemplo Átomo de Na: 11 protões e 11 electrões Ião Na+: 11 protões e 10 electrões 27

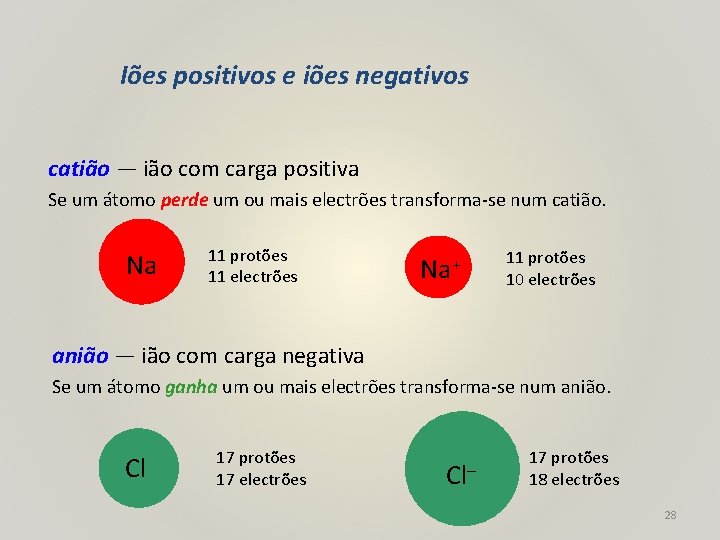
Iões positivos e iões negativos catião — ião com carga positiva Se um átomo perde um ou mais electrões transforma-se num catião. Na 11 protões 11 electrões Na+ 11 protões 10 electrões anião — ião com carga negativa Se um átomo ganha um ou mais electrões transforma-se num anião. Cl 17 protões 17 electrões Cl– 17 protões 18 electrões 28

Iões mono ou poliatómicos Um ião monoatómico provém apenas de um átomo Na+, Cl–, Ca 2+, O 2 -, Al 3+, N 3– Um ião poliatómico contém mais do que um átomo OH–, CN–, NH 4+, NO 3– 29

Trabalhando a definição de ião Quantos protões e electrões existem em 27 3+ Al 13 13 protões, 10 (13 – 3) electrões Quantos protões e electrões existem em 2– 78 Se 34 34 protões, 36 (34 + 2) electrões 30

Alguma nomenclatura de compostos inorgânicos Compostos iónicos (binários) Nome do anião seguido do nome do catião Em sais derivados de ácidos cujo nome termina em ídrico o anião termina em eto Sais provenientes do ácido clorídrico (notar que o sal é neutro): Na. Cl cloreto de sódio NH 4 Cl cloreto de amónio 31

Alguma nomenclatura de compostos inorgânicos (continuação) Nome do anião seguido do nome do catião Sais derivados de ácidos cujo nome termina em ico o anião termina em ato Ca. CO 3: carbonato de cálcio (ex: componente de argamassas de cal) provém do ácido carbónico H 2 CO 3 Cu 2 SO 4: sulfato de cobre provém do ácido sulfúrico H 2 SO 4 32

Alguma nomenclatura de compostos inorgânicos (continuação) Compostos iónicos em que o metal pode formar mais do que um catião Sais: Óxidos Fe. Cl 2 cloreto de ferro(II) Mn 2+ Mn. O óxido de manganês(II) Fe. Cl 3 cloreto de ferro(III) Mn 3+ Mn 2 O 3 óxido de manganês(III) Mn 4+ Mn. O 2 óxido de manganês(IV) 33

Alguma nomenclatura de compostos inorgânicos (continuação) Compostos moleculares (unidades moleculares discretas) É comum o uso de prefixos (di-, tri-, tetra-, etc. ) NH 3: amoníaco H 2 O: água NO: monóxido de azoto NO 2: dióxido de azoto N 2 O 4: tetróxido de diazoto 34

Alguma nomenclatura de compostos inorgânicos (continuação) Base: substância que cede iões hidróxido (OH-) Fórmula geral: M(OH)m Na. OH hidróxido de sódio Ca(OH)2 hidróxido de cálcio (cal apagada) Fe(OH)2 hidróxido de ferro(II) Hidrato : composto com um número específico de moléculas de água ligadas a si Ba. Cl 2 · 2 H 2 O dihidrato de cloreto de bário Cu. S 04 · 5 H 20 pentahidrato de sulfato de cobre (nome comum: sulfato de cobre pentahidratado) 35

Informação In “A matéria de que é feita a cor Os pigmentos utilizados em pintura e a sua identificação e caracterização“ A. J. Cruz «http: //ciarte. no. sapo. pt/biblio/textos /quadro 2#quadro 2» 36

Informação Cais de Barcelona Henrique Pousão (1859 -1884) In “HENRIQUE POUSÃO’S OIL PAINTINGS: PIGMENT STUDY BY INFRARED AND RAMAN MICROSCOPY” Tese de Doutoramento, Universidade de Lisboa, 2011 Alguns dos pigmentos encontrados no estudo realizado: Branco de Chumbo 2 Pb. CO 3·Pb(OH)2 Amarelo de Cádmio Cd. S Vermelhão Hg. S Verde Esmeralda Cu(CH 3 COO)2· 3 Cu(As. O 2)2 Azul da Prússia Fe 4[Fe(CN)6]3 37

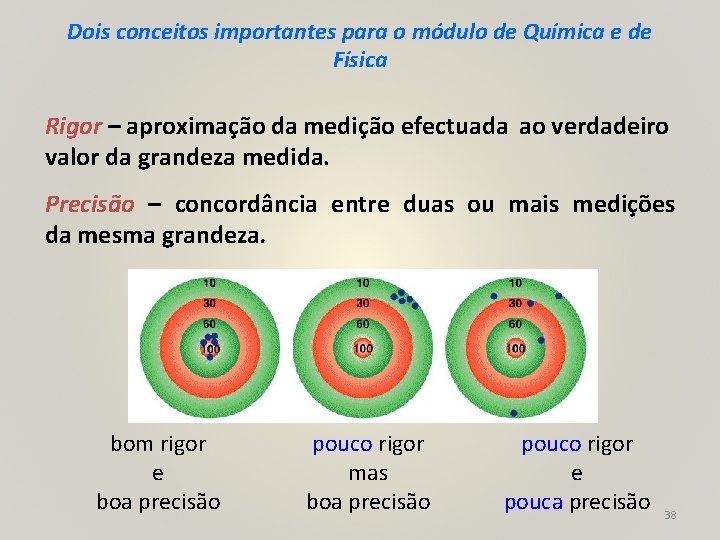
Dois conceitos importantes para o módulo de Química e de Física Rigor – aproximação da medição efectuada ao verdadeiro valor da grandeza medida. Precisão – concordância entre duas ou mais medições da mesma grandeza. bom rigor e boa precisão pouco rigor mas boa precisão pouco rigor e pouca precisão 38

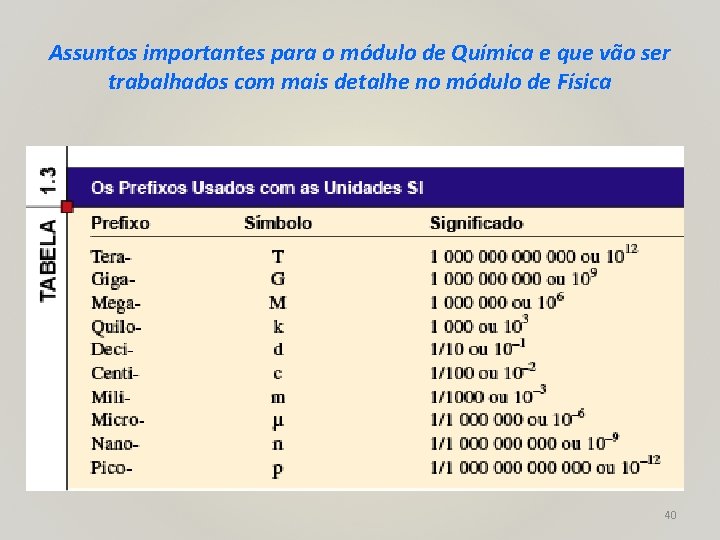
Assuntos importantes para o módulo de Química e que vão ser trabalhados com mais detalhe no módulo de Física 39

Assuntos importantes para o módulo de Química e que vão ser trabalhados com mais detalhe no módulo de Física 40

Assuntos importantes para o módulo de Química e que vão ser trabalhados com mais detalhe no módulo de Física Notação Científica 568, 762 0, 00000772 vírgula para a esquerda vírgula para a direita n>0 n<0 568, 762 = 5, 68762 × 102 0, 00000772 = 7, 72 × 10 -6 Adição ou Subtracção 1. Escreva cada quantidade com o mesmo expoente n 2. Combine N 1 e N 2 3. O expoente, n, mantém-se o mesmo 4, 31 × 104 + 3, 9 × 103 = 4, 31 × 104 + 0, 39 × 104 = 4, 70 × 104 41

Assuntos importantes para o módulo de Química e que vão ser trabalhados com mais detalhe no módulo de Física Notação Científica (continuação) Multiplicação 1. Multiplique N 1 e N 2 2. Some os expoentes n 1 e n 2 (4, 0 × 10– 5) × (7, 0 x 103) = (4, 0 × 7, 0) × (10– 5+3) = 28 × 10– 2 = 2, 8 × 10– 1 Divisão 1. Divida N 1 e N 2 2. Subtraia os expoentes n 1 e n 2 8, 5 × 104 ÷ 5, 0 × 109 = (8, 5 ÷ 5, 0) × 104– 9 = 1, 7 × 10– 5 42
 Patrimnio
Patrimnio Consonante y asonante
Consonante y asonante Matronium
Matronium Qué es encabalgamiento
Qué es encabalgamiento Acuerdo 286 licenciatura
Acuerdo 286 licenciatura Licenciatura en lenguas uaem texcoco
Licenciatura en lenguas uaem texcoco Licenciatura en seguridad y defensa
Licenciatura en seguridad y defensa Ceneval acuerdo 286 carreras
Ceneval acuerdo 286 carreras Examen oral ceneval acuerdo 286
Examen oral ceneval acuerdo 286 Facultad de ecologia marina uagro
Facultad de ecologia marina uagro Residencia licenciatura en obstetricia
Residencia licenciatura en obstetricia Plan de estudios 2012 licenciatura en educación preescolar
Plan de estudios 2012 licenciatura en educación preescolar Plan de estudios 1999 preescolar
Plan de estudios 1999 preescolar Acuerdo 286 licenciatura
Acuerdo 286 licenciatura Licenciatura antropologia
Licenciatura antropologia Certificado de licenciatura
Certificado de licenciatura Obras da semana de arte moderna de 1922
Obras da semana de arte moderna de 1922 Fidias paños mojados
Fidias paños mojados Arte egizia riassunto ppt
Arte egizia riassunto ppt Funciones del arte
Funciones del arte Características del arte neoclásico
Características del arte neoclásico Elemento de textura
Elemento de textura Semana da arte moderna objetivo
Semana da arte moderna objetivo Estribillo figura retorica
Estribillo figura retorica Festa dies veneris tota
Festa dies veneris tota Pintura erromanikoa
Pintura erromanikoa Coerente com a proposta parnasiana
Coerente com a proposta parnasiana Legado cultural
Legado cultural Lis de veracruz
Lis de veracruz Arte romano arquitectura
Arte romano arquitectura Lussuria nell'arte
Lussuria nell'arte Ritmo por simetría
Ritmo por simetría Que nadie sepa mi sufrir autor
Que nadie sepa mi sufrir autor Liceul de arta marin sorescu craiova
Liceul de arta marin sorescu craiova Video rojo
Video rojo As grandes mudanças que se verificam na arte nautica
As grandes mudanças que se verificam na arte nautica Aprendizajes esperados de arte
Aprendizajes esperados de arte Art
Art Barroco
Barroco Ritmo uniforme arte
Ritmo uniforme arte Políptico barberini
Políptico barberini Semelhanças entre comédia e farsa
Semelhanças entre comédia e farsa Romanticismo arte caratteri generali
Romanticismo arte caratteri generali