Les modles de latome Qui a eu lide













- Slides: 21

Les modèles de l’atome

Qui a eu l’idée de l’existence de l’atome? 1) Les grecs (V° siècle avant J. -C. ) Démocrite pensait que la matière était composée de minuscules et invisibles particules : Les atomos signifie : «qu’on ne peut diviser » ou « insécable » . Sa théorie n’était basée que sur des hypothèses. Rien n’avait été prouvé expérimentalement.

ARISTOTE (V° siècle avant J. -C. ) 2) Les grecs (V° siècle avant J. -C. ) Aristote affirme que la matière est constituée de 4 éléments : Le feu L’air La terre L’eau L’idée d’atome passe au second plan. . . pendant presque 20 siècles Aristote !

Qui a eu l’idée de l’atome ? 3) Dalton (1766 - 1844). – Dalton (scientifique anglais) émet les hypothèses suivantes: » la matière est constituée d ’atomes identiques. » Les éléments chimiques se différencient par des atomes de masse différentes Rien n’est encore prouvé par l’expérience.

Le temps des expériences 4 - Les travaux de Thomson Il imagine alors en 1904 le modèle de l’atome suivant : Les électrons baignent dans un matériau chargé positivement comme "des raisins dans un cake" En 1902 Thomson montre la présence de particules chargées négativement dans l ’atome qu’il appelle électrons

Le temps des expériences 5 - Les travaux de Rutherford En 1911 Rutherford démontre que l ’atome contient : – un noyau au centre. – des électrons qui gravitent autour du noyau. – du vide entre les électrons et le noyau Il imagine alors un nouveau modèle de l’atome appelé aussi modèle planétaire : le noyau chargé positivement représente le Soleil et les électrons décrivent des orbites autour du noyau comme les planètes autour du Soleil.

Modèle de l’atome pour la classe de seconde. Le modèle de Thomson (1904) Le modèle de Rutherford (1911)

D’autres modèles de l ’atome plus récent (hors programme) Le modèle de Bohr 1913 Semblable au modèle de Rutherford, le modèle de Bohr est complété par le fait que les électrons ne peuvent décrire que des orbites bien déterminées. Le modèle quantique 1925 Le noyau composé de particules chargées positivement (les protons) et de particules électriquement neutres (les neutrons découverts en 1932) "baigne" dans un nuage d‘électrons. .

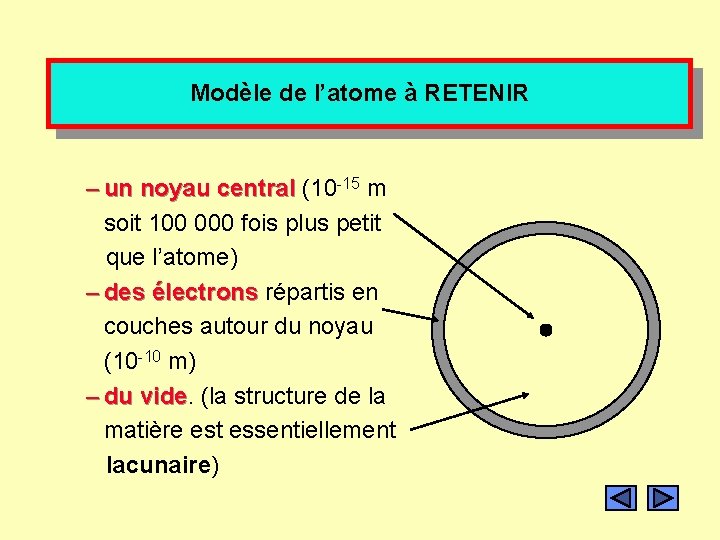
Modèle de l’atome à RETENIR – un noyau central (10 -15 m soit 100 000 fois plus petit que l’atome) – des électrons répartis en couches autour du noyau (10 -10 m) – du vide (la structure de la matière est essentiellement lacunaire)

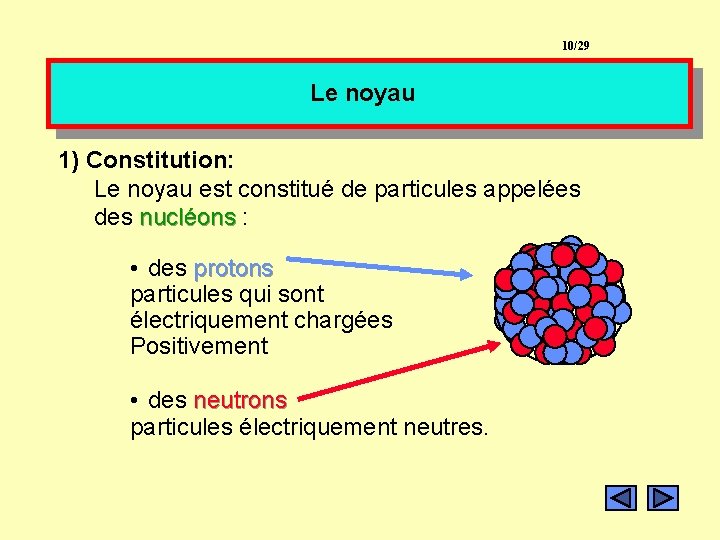
10/29 Le noyau 1) Constitution: Le noyau est constitué de particules appelées des nucléons : • des protons particules qui sont électriquement chargées Positivement • des neutrons particules électriquement neutres.

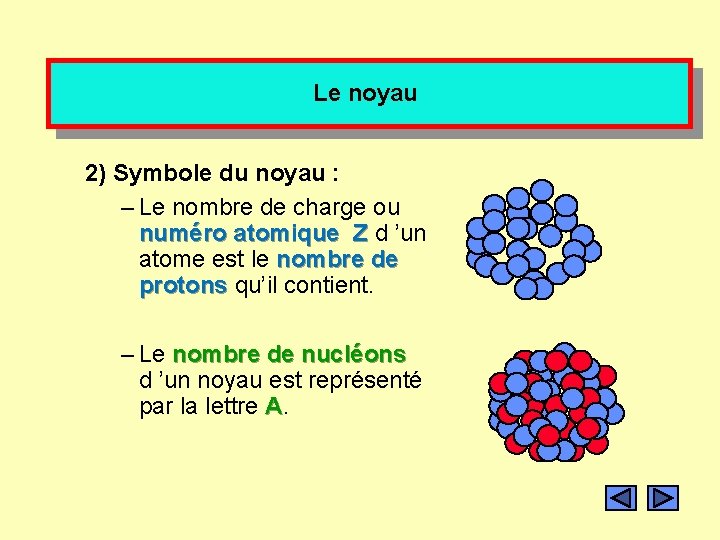
Le noyau 2) Symbole du noyau : – Le nombre de charge ou numéro atomique Z d ’un atome est le nombre de protons qu’il contient. – Le nombre de nucléons d ’un noyau est représenté par la lettre A.

12/29 • Le nombre de neutrons N dans un noyau vaut donc N=A-Z Le noyau d ’un atome de symbole chimique X est représenté par : A Z X

Le nuage électronique autour du noyau. Qu’est ce qu’un électron? • L ’électron est une particule chargée d ’électricité négative. Sa masse est extrêmement petite: me- = 9, 1. 10 -31 kg • Sa charge électrique est la plus petite charge possible qu’une particule peut posséder. On parle de la charge élémentaire notée e e = 1, 6. 10 -19 C (C pour coulomb: unité de la charge électrique).

Qu’est ce que l’élément cuivre ? Les différentes expériences ont montré qu’il était possible de passer du métal cuivre Cu aux ions cuivre (II) Cu 2+et inversement. Au cours de différentes réaction chimique, l’élément cuivre se conserve. On donne le nom d’élément chimique à l ’ensemble des entités chimiques (atomes, ions) ayant le même numéro atomique Z

15/29 II. L’élément chimique 1 - Définition de l’élément chimique On donne le nom d’élément chimique à l ’ensemble des entités chimiques (atomes, isotopes, ions) ayant le même numéro atomique Z Un élément chimique est caractérisé par son numéro atomique Z

16/29 II. L’élément chimique 2 - Les isotopes • Dans un échantillon de cuivre, tous les atomes de cuivre ne sont pas identiques. Ils ont tous le même nombre de protons, mais certains atomes ont 63 nucléons et d ’autres 65. Ces atomes sont dit isotopes. On appelle isotope des atomes qui ont le même numéro atomique Z, mais des nombres de nucléons A différents. 3 - Notation 65 29 Cu 63 29 Cu Même Z

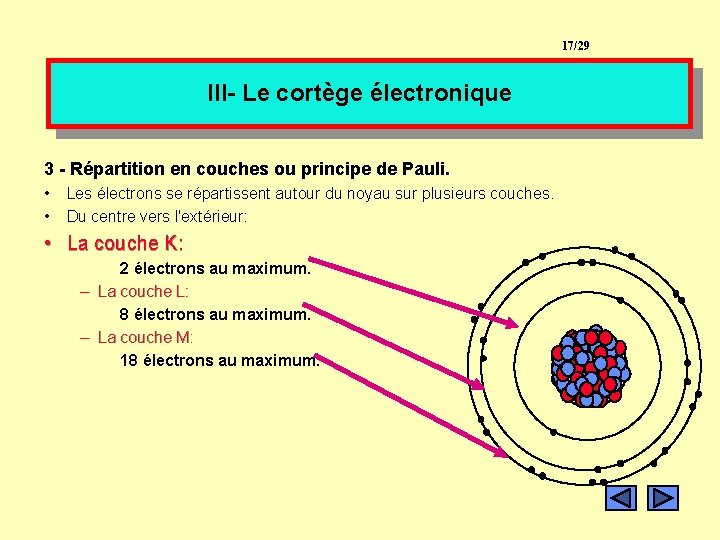
17/29 III- Le cortège électronique 3 - Répartition en couches ou principe de Pauli. • • Les électrons se répartissent autour du noyau sur plusieurs couches. Du centre vers l'extérieur: • La couche K: 2 électrons au maximum. – La couche L: 8 électrons au maximum. – La couche M: 18 électrons au maximum.

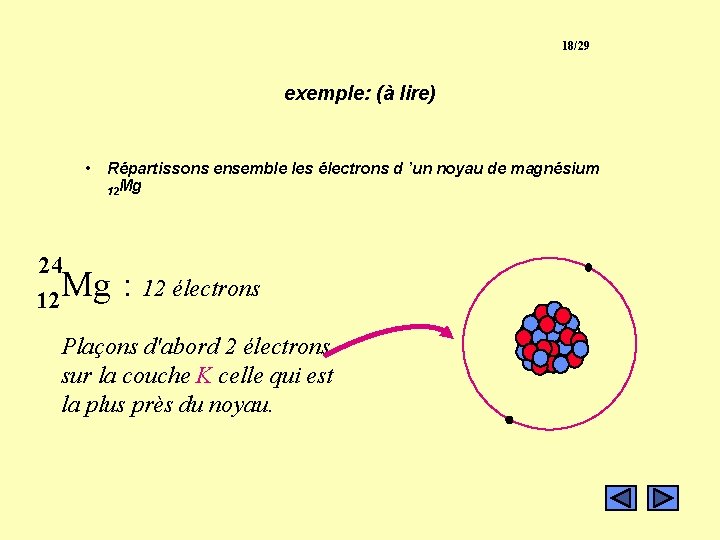
18/29 exemple: (à lire) • Répartissons ensemble les électrons d ’un noyau de magnésium 12 Mg 24 Mg 12 : 12 électrons Plaçons d'abord 2 électrons sur la couche K celle qui est la plus près du noyau.

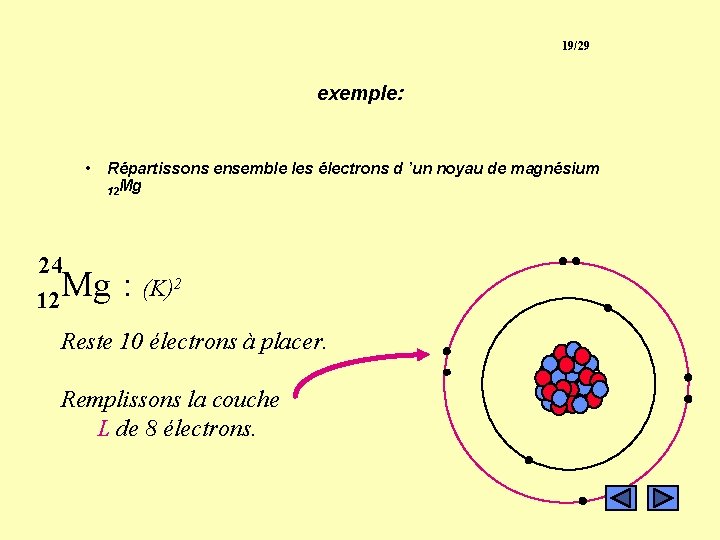
19/29 exemple: • Répartissons ensemble les électrons d ’un noyau de magnésium 12 Mg 24 Mg 12 : (K)2 Reste 10 électrons à placer. Remplissons la couche L de 8 électrons.

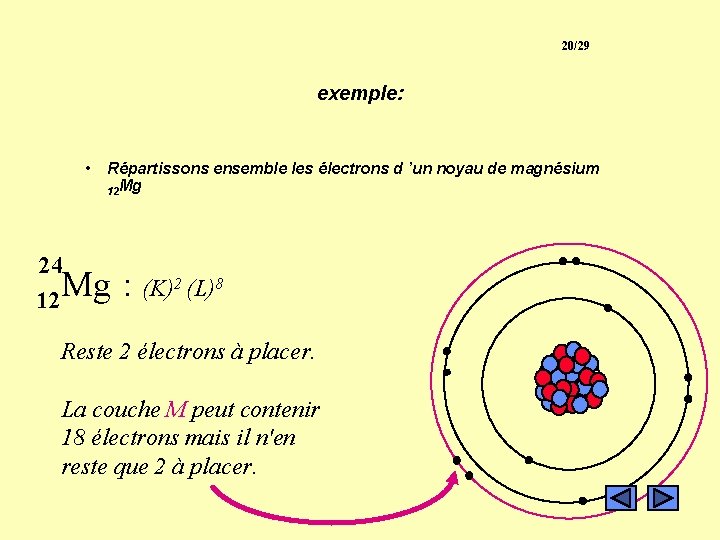
20/29 exemple: • Répartissons ensemble les électrons d ’un noyau de magnésium 12 Mg 24 Mg 12 : (K)2 (L)8 Reste 2 électrons à placer. La couche M peut contenir 18 électrons mais il n'en reste que 2 à placer.

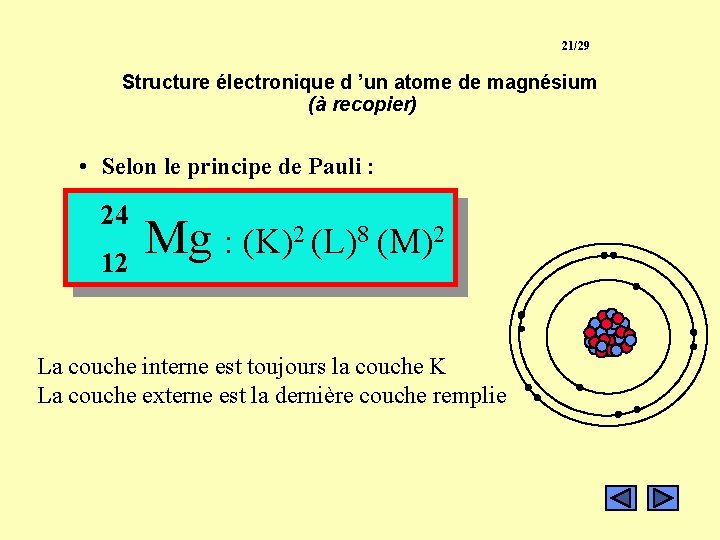
21/29 Structure électronique d ’un atome de magnésium (à recopier) • Selon le principe de Pauli : 24 12 Mg : (K)2 (L)8 (M)2 La couche interne est toujours la couche K La couche externe est la dernière couche remplie