La struttura dellatomo LESPERIMENTO DI RUTHERFORD Nel 1911













- Slides: 17

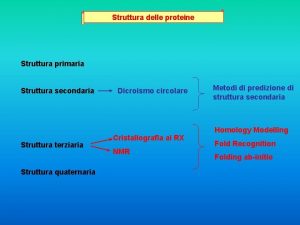
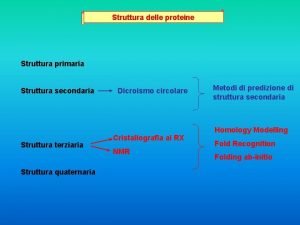
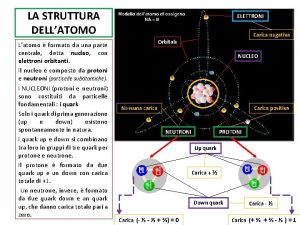
La struttura dell’atomo


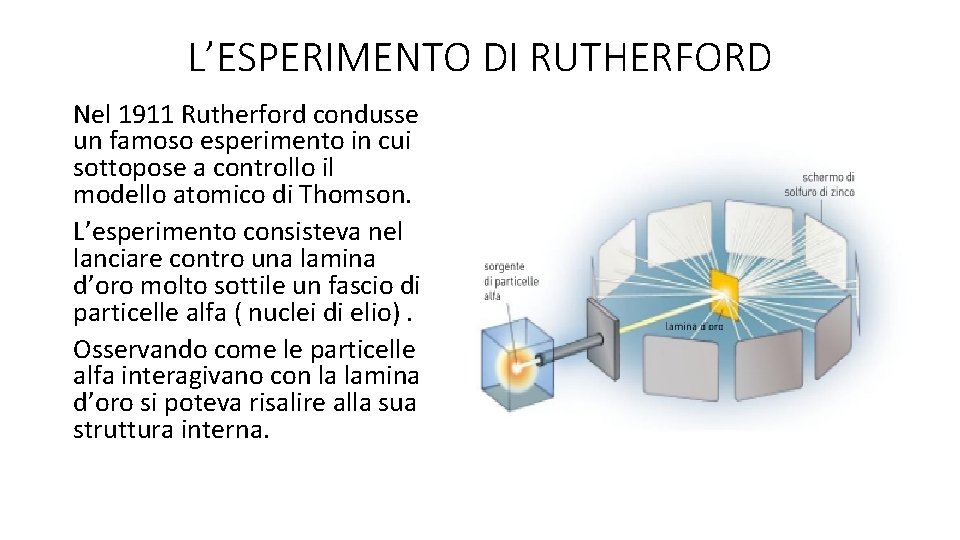
L’ESPERIMENTO DI RUTHERFORD Nel 1911 Rutherford condusse un famoso esperimento in cui sottopose a controllo il modello atomico di Thomson. L’esperimento consisteva nel lanciare contro una lamina d’oro molto sottile un fascio di particelle alfa ( nuclei di elio). Osservando come le particelle alfa interagivano con la lamina d’oro si poteva risalire alla sua struttura interna.

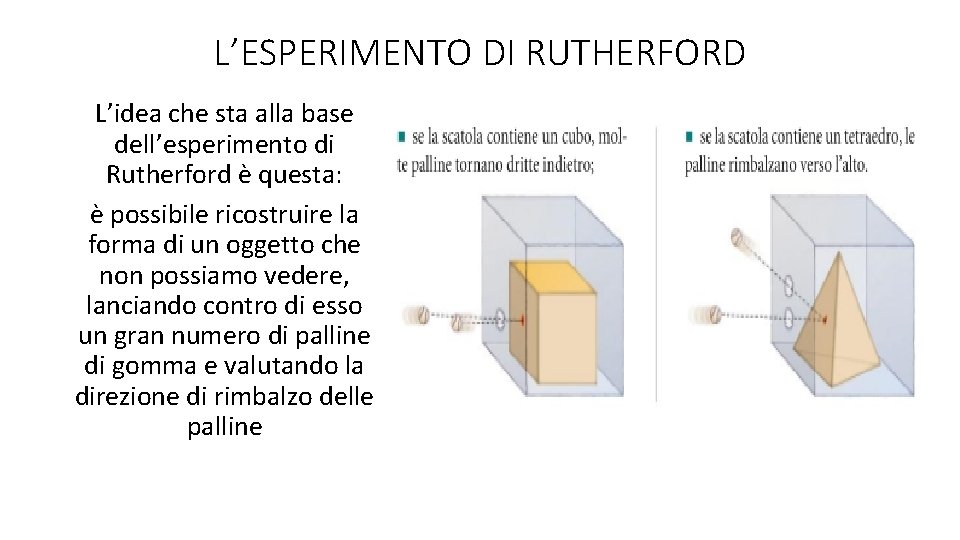
L’ESPERIMENTO DI RUTHERFORD L’idea che sta alla base dell’esperimento di Rutherford è questa: è possibile ricostruire la forma di un oggetto che non possiamo vedere, lanciando contro di esso un gran numero di palline di gomma e valutando la direzione di rimbalzo delle palline

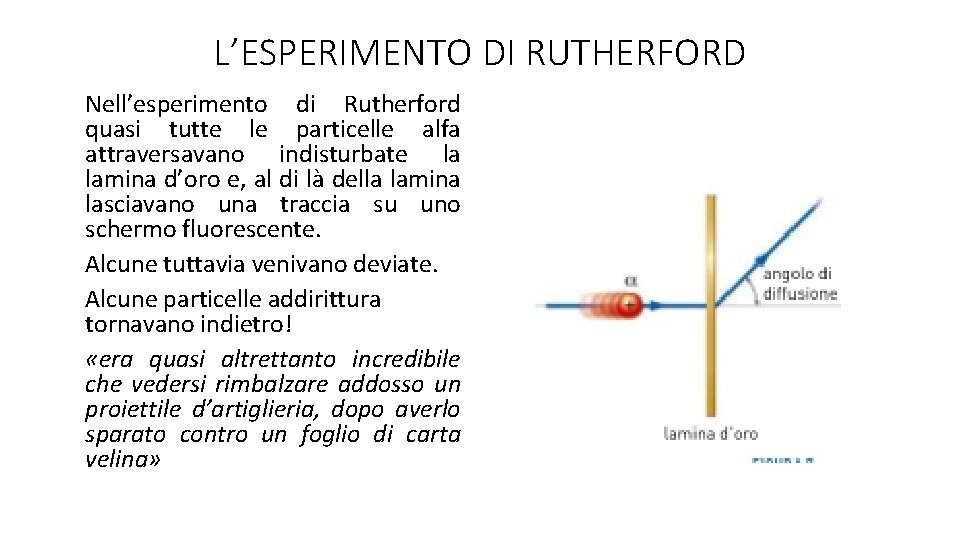
L’ESPERIMENTO DI RUTHERFORD Nell’esperimento di Rutherford quasi tutte le particelle alfa attraversavano indisturbate la lamina d’oro e, al di là della lamina lasciavano una traccia su uno schermo fluorescente. Alcune tuttavia venivano deviate. Alcune particelle addirittura tornavano indietro! «era quasi altrettanto incredibile che vedersi rimbalzare addosso un proiettile d’artiglieria, dopo averlo sparato contro un foglio di carta velina»

L’ESPERIMENTO DI RUTHERFORD Cosa fa deviare alcune particelle alfa? Non possono essere gli elettroni che sono troppo leggeri rispetto alle particelle alfa ( massa particella alfa = 10000 massa elettrone) Sicuramente è l’urto con una carica positiva ( repulsione coulombiana) che quindi non potrà essere diffusa, ma dovrà essere concentrata!! Il modello a panettone di Thomson è sbagliato Perché tante particelle alfa attraversano la lamina indisturbate? Perché la materia al suo interno è per la maggior parte costituita da vuoto!!! L’atomo è una struttura prevalentemente vuota.



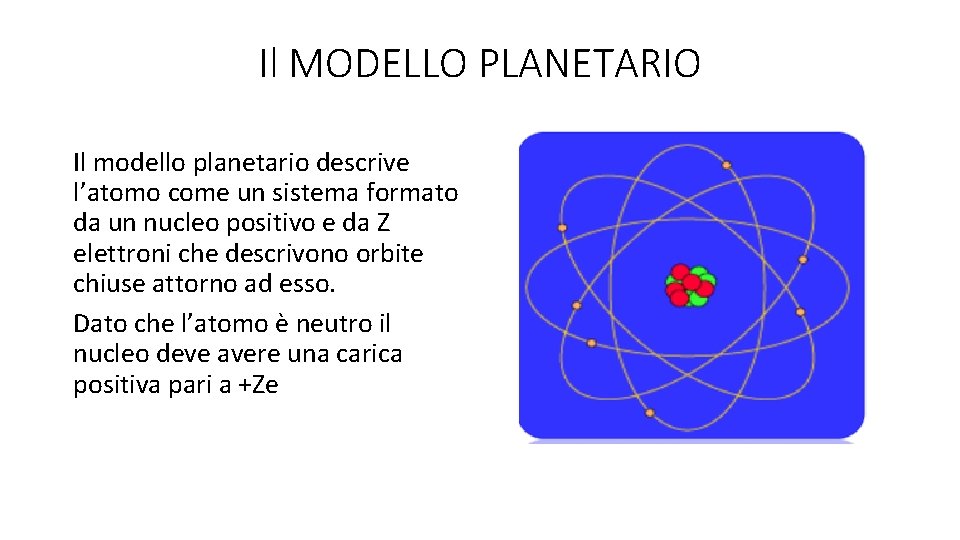
Il MODELLO PLANETARIO Il modello planetario descrive l’atomo come un sistema formato da un nucleo positivo e da Z elettroni che descrivono orbite chiuse attorno ad esso. Dato che l’atomo è neutro il nucleo deve avere una carica positiva pari a +Ze

PROBLEMI DEL MODELLO PLANETARIO Nel 1912 il fisico danese Niels Bohr, che stava studiando a Manchester sotto la guida di Rutherford, capì che il modello planetario non poteva essere corretto. Perché? Perché quando un elettrone percorre un’orbita circolare ha un’accelerazione centripeta e tutti i corpi carichi che accelerano emettono onde elettromagnetiche. Perciò l’elettrone dovrebbe emettere onde elettromagnetiche trasportano energia. L’elettrone perciò perderebbe continuamente energia e a causa di ciò non potrebbe seguitare a ruotare alla stessa distanza dal nucleo. Inevitabilmente in pochissimo tempo ( un decimo di microsecondo) cadrebbe, spiraleggiando, sul nucleo!!!

L’atomo di Bohr




L’ATOMO DI BOHR In sintesi: ØQuando l’elettrone percorre l’orbita non emette radiazioni ØIl raggio dell’orbita, la velocità v dell’elettrone, la sua energia totale non possono assumere valori qualunque, ma sono grandezze quantizzate ØAnche l’energia che un elettrone o assorbe o emette per compiere una transizione è una grandezza quantizzata ( ricorda: un atomo emette un fotone quando passa da un’orbita permessa di energia maggiore ad un’orbita permessa di energia minore, ovvero da un’orbita più esterna ad una più interna)


 Modelos atomicos
Modelos atomicos Ireland 1911
Ireland 1911 Bohr féle atommodell
Bohr féle atommodell The second moroccan crisis of 1911 resulted in
The second moroccan crisis of 1911 resulted in Ireland 1911
Ireland 1911 Moroccan crisis 1911
Moroccan crisis 1911 Niagara falls frozen 1911
Niagara falls frozen 1911 1911 1988
1911 1988 Revelation 19
Revelation 19 Fila heritage 1911
Fila heritage 1911 The second moroccan crisis (1911)
The second moroccan crisis (1911) Noddings philosophy of education
Noddings philosophy of education Cosa mangiavano nel neolitico
Cosa mangiavano nel neolitico Persone ammesse nel recinto di gioco 2021
Persone ammesse nel recinto di gioco 2021 Una barca nel bosco significato
Una barca nel bosco significato I simboli delle religioni del mondo
I simboli delle religioni del mondo Alice bob eve
Alice bob eve Dante alighieri nasce a firenze nel 1265
Dante alighieri nasce a firenze nel 1265