Kompleksometrija PREDMET ANALITIKA KEMIJA KURIKULUM KEMIJSKI TEHNIAR TRAJANJE













- Slides: 17

Kompleksometrija PREDMET: ANALITIČKA KEMIJA KURIKULUM: KEMIJSKI TEHNIČAR TRAJANJE: 2 SATA AUTOR: ĐURĐEVKA PECIKOZIĆ

Dragi učenici i drage učenice, kako bismo vam olakšali učenje za vas smo pripremili materijale za samostalni rad. U ovoj prezentaciji su sadržaji koji se odnose na nastavni predmet: analitička kemija Prezentacija sadrži i zadatake za samostalni rad. Na kraju prezentacije nalaze se pitanja za ponavljanje gradiva. Vaši nastavnici će vam također pružati podršku u učenju na daljinu. Želimo vam sretno i ugodno učenje.

Uvod: 1. Koji metalni ioni najčešće grade kompleksne 2. 3. 4. 5. spojeve? Od kojih se dijelova sastoji kompleksni spoj? Što nam govori koordinacijski broj i o čemu ovisi? Kojom vezom se povezuje centralni ion i ligand? Što mslite za što se rabiti kompleksometrijska titracija?

Kompleksometrija Ø Volumetrijska metoda koja se temelji na reakcijama nastajanja kompleksnih spojeva. Uvjeti određivanja: � � nastajanje dobro topljivog, ali slabo disociranog kelatnog kompleksa jasno uočljiva završna točka titracije reakcija stvaranja kompleksa se odvija u jednom stupnju pri stvaranju kompleksa nema sporednih reakcija.

Ø Navedene uvjete ispunjavaju reakcije metalnih jona s posebnim organskim ligandima, pri čemu nastaju ciklički kompleksi kelati, lat. chelaerakova klješta). Ø Za analitičku praksu najznačajniji ligandi su tzv. KOMPLEKSONI, koje je u analitičku praksu uveo Švarcenbah 1945. godine. Ø Kompleksoni su amino-polikarboksilne kiseline i njihove soli.

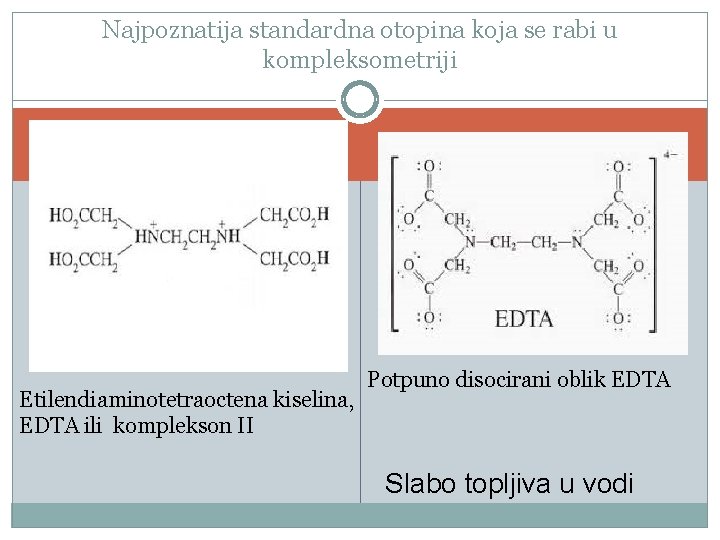
Najpoznatija standardna otopina koja se rabi u kompleksometriji Etilendiaminotetraoctena kiselina, EDTA ili komplekson II Potpuno disocirani oblik EDTA Slabo topljiva u vodi

EDTA – heksadentalni ligand, H 4 Y Ima šest potencijalnih mjesta za vezivanje metalnog iona, četiri karboksilne skupine i dvije aminoskupine U vodenoj otopini ionizira u četiri stupnja: H 4 Y +H 2 O H 3 O+ +H 3 Y- +H 2 O H 3 O+ +H 2 Y 2 - +H 2 O H 3 O+ + HY 3 - + H 2 O H 3 O+ + Y 4 -

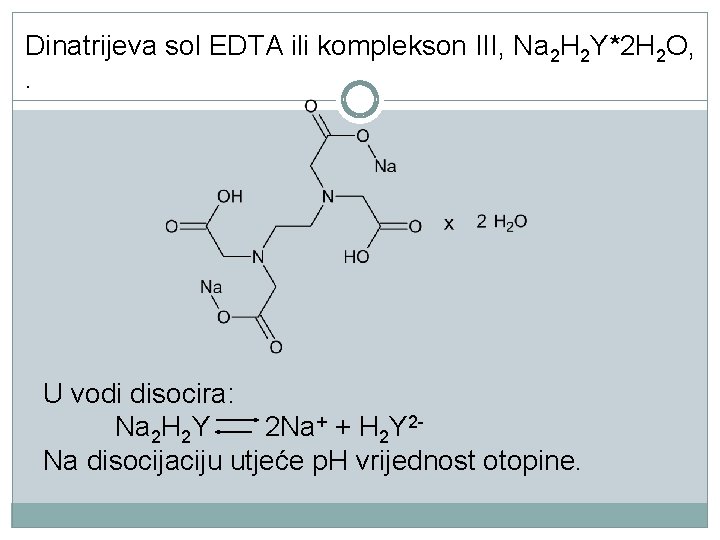
Zbog slabe topljivosti EDTA za titraciju rabi se dinatrijeva sol EDTA ili komplekson III, Na 2 H 2 Y*2 H 2 O: bijela kruta tvar postojana na zraku dobro topljiv u vodu ima svojstvo primarne standardne tvar Ponekad je potrebno standardizirati otopinu kompleksona III. Za standardizaciju se rabi neutralna otopina Ca. Cl 2 koja se dobije otapanjem kalcijeva karbonata u klorovodičnoj kiselini ili otopljeni cink u klorovodičnoj ili sumpornoj kiselini.

Dinatrijeva sol EDTA ili komplekson III, Na 2 H 2 Y*2 H 2 O, . U vodi disocira: Na 2 H 2 Y 2 Na+ + H 2 Y 2 Na disocijaciju utjeće p. H vrijednost otopine.

Zadatak za učenike/ce! Kada je potrebno uraditi standardizaciju otopine kompleksona III za standardizaciju se rabi neutralna otopina Ca. Cl 2 koja se dobije otapanjem kalcijeva karbonata u klorovodičnoj kiselini ili otopljeni cink p. a u klorovodičnoj ili sumpornoj kiselini. Napiši jednadžbe reakcije kalcijeva karbonata s klorovodičnom kiselinom, cinka s klorovodičnom kiselinom i cinka sa sumpornom kiselinom.

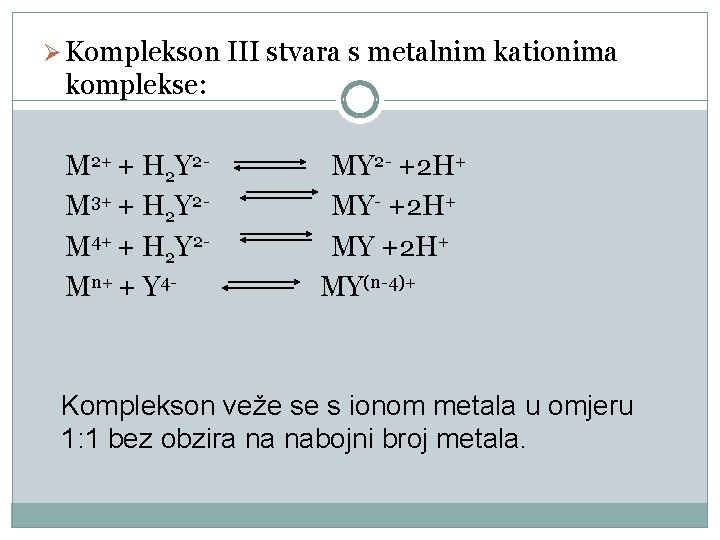
Ø Komplekson III stvara s metalnim kationima komplekse: M 2+ + H 2 Y 2 M 3+ + H 2 Y 2 M 4+ + H 2 Y 2 Mn+ + Y 4 - MY 2 - +2 H+ MY(n-4)+ Komplekson veže se s ionom metala u omjeru 1: 1 bez obzira na nabojni broj metala.

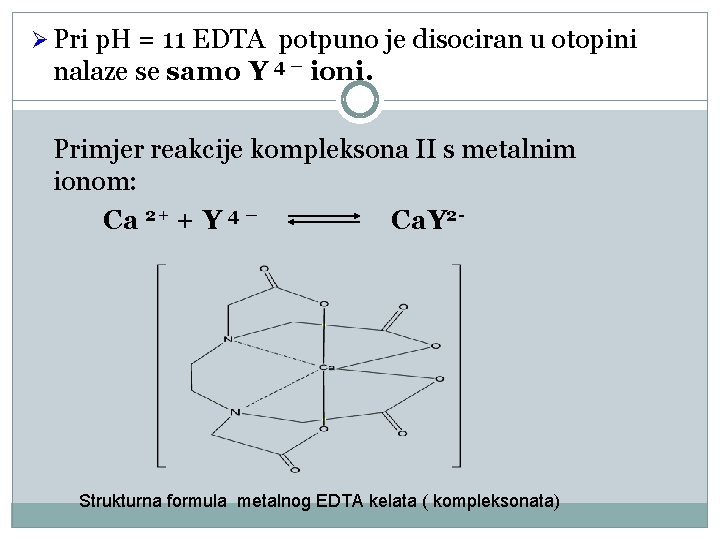
Ø Pri p. H = 11 EDTA potpuno je disociran u otopini nalaze se samo Y 4 – ioni. Primjer reakcije kompleksona II s metalnim ionom: Ca 2+ + Y 4 – Ca. Y 2 - Strukturna formula metalnog EDTA kelata ( kompleksonata)

Zadatak za učenike/ce! Jednadžbama reakcije prikažite reakciju Mn 2+, Cu 2+, Zn 2+ i Mg 2+ s kompleksonom!

Indikatori u kompleksometriji Točka završetka titracije određuje se vizualno pomoću metalnokromnih indikatora. Metalokromni indikatori su organske spojevi koji s metalnim ionima tvore nestabilniji kompleks od kompleksa metala s kompleksonom. MIn + komplekson boja 1. kompleksonat +HIn boja 2.

Indikatori koji se najčešće rabe su: Eriokromcrno T- crna azo-boja p. H= 8 -12 modra boja p. H= 10 s ionima metala crvena boja ( boja vina) Za određivanje iona: Zn 2+, Cd 2+, Mn 2+, Mg 2+ Mureksid je amonijeva sol organske purpune kiseline p. H= 9 purpuno crvena boja p. H= 11 plavoljubičasta boja Za određivanje iona: Ca 2+ ( kompleks crvene boje), Cu 2+, Co 2+, Ni 2+ Indikatori rabe se u suhom razrjeđenju

Pitanja za ponavljanje: 1. Na čemu se temelji kompleksometrija? 2. Što su komplekson II i komplekson III po kemijskom sastavu? 3. Navedi indikatore koji se rabe u kompleksometriji? 4. Objasni zašto se u kompleksometriji dodaje puferska otopina! 5. U kom omjeru se komplekson veže s ionima metala? Prikaži reakcijama! 6. Objasni kako metalokromni indikatori reagiraju s metalnim ionima? 7. Kako se pripravljaju primarne, a kako sekundarne standardne otopine?

Hvala na suradnji!
 Kompleksometrija
Kompleksometrija Ruang lingkup pkn di sd
Ruang lingkup pkn di sd Hr analitika
Hr analitika Llu bibliotēka
Llu bibliotēka Hemijski sastav morske vode
Hemijski sastav morske vode Vapenna voda
Vapenna voda Kategorizacija mesa goveda
Kategorizacija mesa goveda Laboratorijski pribor
Laboratorijski pribor Sastav zraka
Sastav zraka Izparilnica
Izparilnica Zrak sastav
Zrak sastav Contoh soalan falsafah pendidikan di malaysia
Contoh soalan falsafah pendidikan di malaysia Objektif kurikulum pkbp
Objektif kurikulum pkbp Perbedaan kurikulum sd dan mi
Perbedaan kurikulum sd dan mi Antika trajanje
Antika trajanje Američki romantizam
Američki romantizam Humanizam i renesansa
Humanizam i renesansa Pravopisz
Pravopisz