KIMIKA ERREAKZIO KIMIKOEN OINARRIZKO LEGEAK LEGE PONDERALAK n











- Slides: 12

KIMIKA ERREAKZIO KIMIKOEN OINARRIZKO LEGEAK

LEGE PONDERALAK n Masaren iraupenaren legea n Proportzio finkoen legea n Proportzio anizkoitzen legea

MASAREN IRAUPENAREN LEGEA LAVOISIER (1743 -1794) n Errakzio kimiko guztietan erreakzionatzen duten erreaktiboen masa eta erreakzioaren ondorioz sortzen diren produktuen masa berdinak izan behar dira. n Adibidez, ondoko erreakzioetan: n n n hidrogenoa(g) + oxigenoa(g) ura(l) 10 g hidrogenok 80 g hidrogenorekin erreakzionatzen dute 90 g ur emateko ( 90 g erreaktibok erreakzionatuz 90 g produktu ematen dute) karbonoa(s) + oxigenoa(g) karbono dioxidoa(g) 12 g karbonok 32 g oxigenorekin erreakzionatuz 44 g karbono dioxiodao lortzen dira. nitrogenoa(g) + hidrogeno(g) amoniakoa(g) 28 g nitrogenok 6 g hidrogenoz erreakzionatuz 34 g amoniako lortzen dira ü Ikusten denez erreakzio gertatu aurretiko erreaktiboen masa eta lortutako produktuaren masak berdinak dira

PROPORTZIO DEFINITUEN LEGEA (1806) PROUST (1754 -1826) n Bi elementu edo gehiago konbinatzen direnean konposatu jakin bat sortzeko, elementuen masen arteko proportzioa berdina da beti. n Adibidez, ondok erreakzioetan : n hidrogenoa(g) + oxigenoa(g) ura(l) 10 g hidrogenok 80 g hidrogenorekin erreakzionatzen dute 90 g ur emateko Beraz, erreakzio honetan hidrogenoak eta oxigenoak ondoko proportzioan erreakzionatzen dute beti : oxigeno masa/ hidrogeno masa = 80/10 = 8/1 n karbonoa(s) + oxigenoa(g) karbono dioxidoa(g) 12 g karbonok 32 g oxigenorekin erreakzionatuz 44 g karbono dioxido lortzen dira. Beraz, proportzioa ondokoa litzateke : oxigeno masa / karbono masa = 32/12 = 2, 66/1 n nitrogenoa(g) + hidrogeno(g) amoniakoa(g) 28 g nitrogenok 6 g hidrogenoz erreakzionatuz 34 g amoniako lortzen dira. Beraz, proportzioa ondokoa dugu: nitrogeno masa / karbono masa = 28/6 = 4, 66/1 ü Erreaktibo kantitateak aldatuko bagenitu ere erreakzio hauetan erreaktiboen masen arteko proportzioa berbera litzeteke beti.

PROPORTZIO ANIZKOITZEN LEGEA (1803) DALTON (1776 -1844) n Bi elementu, A eta B, konbinatzen direnean bi konposatu desberdin emateko, A elementuaren kantitate berarekin konbinatzen diren B-ren kantitatea desberdinak(erreakzio bakoitzeko proportzioaren arberakoak) zenbaki osozko erlazio sinplea gordetzen dute. n Adibidez, demagun odoko erreakzioak : n Karbonoa eta oxigenoa elkarrekin konbinatzen dira karbono dioxiodoa eta karbono monoxidoa emanez. Karbono kantitate finkoa badugu, esate baterako, 6 g; oxigeno kantitae hauek beharko dira, hurrenez hurren, aipatutako konposatuak lortzeko : 16 eta 8 g. Beraz, karbono kantitate berarekin(6 g) konbinatzen diren oxigeno kantitateak(16 eta 8 g) zenbaki osozko erlazioa gordetzen dute : oxigeno 1/oxigeno 2 = 16 g /8 g = 2/1 Beste modu batera : 1. erreakzioa : karbono(s) + oxigeno (g) karbono dioxiodoa(g) Konbinaketa proportzioa : oxigeno 1/karbono 1 = 16/6 = 2, 66/1 2. erreakzioa : karbono(s) + oxigenoa(g) karbono monoxidoa(g) Konbinaketa proportzioa : oxigeno 2/karbono 2 = 8/6 = 1, 33/1 Beraz, karbono 1 g-rekin konbinatu diren oxigeno kantitateak 2/1 eko erlazio sinplea gordetzen dute : oxigeno 1/oxigeno 2 = 16 g /8 g = 2/1

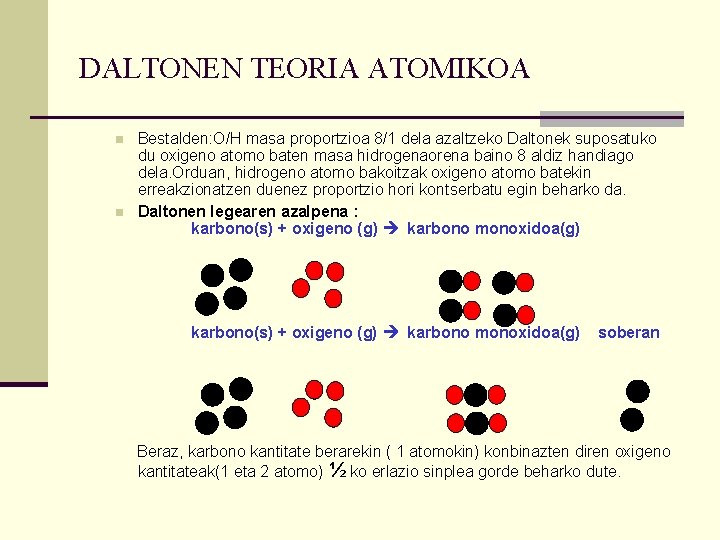
DALTONEN TEORIA ATOMIKOA n John Dalton izan zen teoria atomikoaren sortzailea. 1803 argitaratu zuen A New System of Chemical Phlososophy liburuan. Teoria honen bitartez Dalton gai izango da auureko lege esperimentalak (lege ponderalak) azaltzeko. n Daltonen teoria atomikoa ondoko hipotesi hauetan oinarritzen da: n n n Elementuak banaezinak eta zati ezinak diren atomoz osaturik daude. Elementu baten atomo guztiak masa eta propietate berdinak dituzte. Elementu desberdinen atomoak masa eta propietate desberdinak dituzte. Konposatuak elementuen atomoak konbinatuz sortzen dira. Atomo horiek zenbakizko erlazio sinpleen bitartez konbinatzen dira. Legeen azalpena teoria atomioaren bitartez : n Lavoisier eta Proust-en legearen azalpena : hidrogenoa(g) + oxigenoa(g) n ura(l) soberan Beraz, hasieran eta azkenean atomo berberak daudenez masak iraun egin beharko du.

DALTONEN TEORIA ATOMIKOA n n Bestalden: O/H masa proportzioa 8/1 dela azaltzeko Daltonek suposatuko du oxigeno atomo baten masa hidrogenaorena baino 8 aldiz handiago dela. Orduan, hidrogeno atomo bakoitzak oxigeno atomo batekin erreakzionatzen duenez proportzio hori kontserbatu egin beharko da. Daltonen legearen azalpena : karbono(s) + oxigeno (g) karbono monoxidoa(g) soberan Beraz, karbono kantitate berarekin ( 1 atomokin) konbinazten diren oxigeno kantitateak(1 eta 2 atomo) ½ ko erlazio sinplea gorde beharko dute.

LEGE BOLUMETRIKOAK n Gay-Lussac-en legea. n Avogadroren hipotesiak eta legea.

KONBINAZIO BOLUMENEN LEGEA GAY-LUSSAC (1778 -1850) n (1808) Gay-lussac-ek hainbat gasekin n Adibideak : eginiko hainbat erreakzio aztertu n 1. adibidea : ondoren, erreaktibo eta produktuek 10 L hidrogenok 10 L klororekin betetzen duten erlazio bat erreakzionatzen dute 10 L hidrogeno kloruro ondorioztatu zuen : emateko. n Tenperatura eta presio 20 L hidrogeno 20 L klororekin konstantean, erreakzio kimikoan erreakzionatzen dute 20 L hidrogeno kloruro parte hartzen duten gasen emateko bolumenak zenbaki sinple eta 30 L hidrogeno 30 L oxigekokin osozko erlazioa gordetzen dute. erreakzionatzen dute 30 L hidrogeno kloruro emateko n Gay-Lussac-en ondorioa : 1 bol hidrogeno 1 bol klororekin erreakzionatzen dute 2 bol ur-lurrin emateko Hau da : hidrogeno(g) + kloro(g) hidrogeno kloruro(g)) 1 v + 1 v 2 v

KONBINAZIO BOLUMENEN LEGEA GAY-LUSSAC (1778 -1850) n 2. adibidea: 10 L hidrogeno 5 L oxigekokin erreakzionatzen dute 10 L ur-lurrin emateko. 20 L hidrogeno 10 L oxigekokin erreakzionatzen dute 20 ur-lurrin emateko 30 L hidrogeno 15 L oxigekokin erreakzionatzen dute 30 ur-lurrin emateko n Gay-Lussac-en ondorioa : 2 bol hidrogeno 1 bol oxigekokin erreakzionatzen dute 2 bol ur-lurrin emateko Hau da : hidrogeno(g) + oxigeno(g) ura(g) 2 v + 1 v 2 v (1808) n 3. adibidea : 10 L nitrogeno 30 L hidrogekokin erreakzionatzen dute 20 L amoniako emateko. 20 L hidrogeno 60 L oxigekokin erreakzionatzen dute 40 amoniako emateko 30 L hidrogeno 15 L oxigekokin erreakzionatzen dute 30 amaoniako emateko n Gay-Lussac-en ondorioa : 1 bol nitrogeno 3 bol hidrogekokin erreakzionatzen dute 2 bol amoniako emateko Hau da : nitrogeno(g) + hidrogeno(g) amoniako(g) 1 v + 3 v 2 v

AVOGADROREN HIPOTESIAK eta LEGEA 1. 2. n Presio eta tenperatura berean neurturiko edozin gasen bolumen berdinetan partikula kopuru berdina dago. Gas elementalen partikulak ez dira atomoak, atomo agregatuak baizik; hau da, molekulak. Bi hipotesi hauen sintesiak Avogadroren legera eramaten gaitu : “Presio eta tenperatura berean, edozein gasen bolumen berdinetan molekula kopuru berdina dago” n Adibideak : hidrogeno(g) + kloro(g) 1 v + 1 v hidrogeno kloruro(g) 2 v (Suposatu dugu daukagun gasen 1 v bolumenean 3 molekula daudela; beraz, 2 v bolumenean 6 molekula egongo dira)

AVOGADROREN HIPOTESIAK eta LEGEA n Adibideak : hidrogeno(g) 2 v nitrogeno(g) 1 v + + oxigeno(g) 1 v + + hidrogeno(g) amoniako(g) 3 v 2 v ura(g) 2 v (Kontutan izanik Avogadroren legea asmatu zein litzatekeen uraren eta amoniakoaren formula)
 Lege ponderalak
Lege ponderalak Rettsdogmatisk metode
Rettsdogmatisk metode Nullum crimen sine lege nulla poena sine lege
Nullum crimen sine lege nulla poena sine lege Nullum crimen sine lege nulla poena sine lege
Nullum crimen sine lege nulla poena sine lege Kimika gradua
Kimika gradua Erreakzio kimikoak doitu
Erreakzio kimikoak doitu Akzio erreakzio legea
Akzio erreakzio legea Erreakzio kimiko motak
Erreakzio kimiko motak Heziberri 2020 pdf euskaraz
Heziberri 2020 pdf euskaraz Konpetentziak heziberri 2020
Konpetentziak heziberri 2020 Oinarrizko konpetentziak heziberri
Oinarrizko konpetentziak heziberri Legea lui arhimede in gaze
Legea lui arhimede in gaze Pertsiarren testu iruzkina
Pertsiarren testu iruzkina