Kako se dele organska jedinjenja Alkani prema hemijskom





- Slides: 12


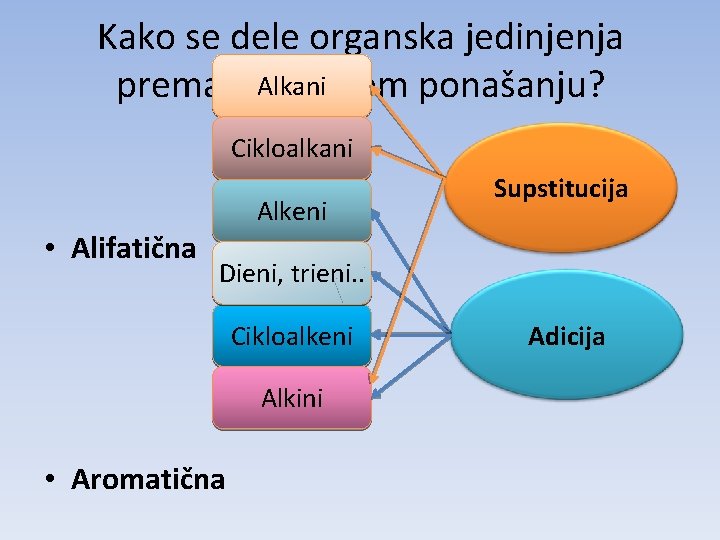
Kako se dele organska jedinjenja Alkani prema hemijskom ponašanju? Cikloalkani Alkeni • Alifatična Supstitucija Dieni, trieni. . Cikloalkeni Alkini • Aromatična Adicija

Aromatični ugljovodonici - Areni Predstavnik arena: Benzen Otkrio ga je engleski naučnik M. Faraday 1825. godine. Izvršio pirolizu kitovog ulja i dobio: -bezbojnu tečnost -intenzivnog mirisa -t. k. 80 o. C -t. t. 5, 5 o. C -empirijske formule CH -molekulske formule C 6 H 6 Michael Faraday (1791 -1867)

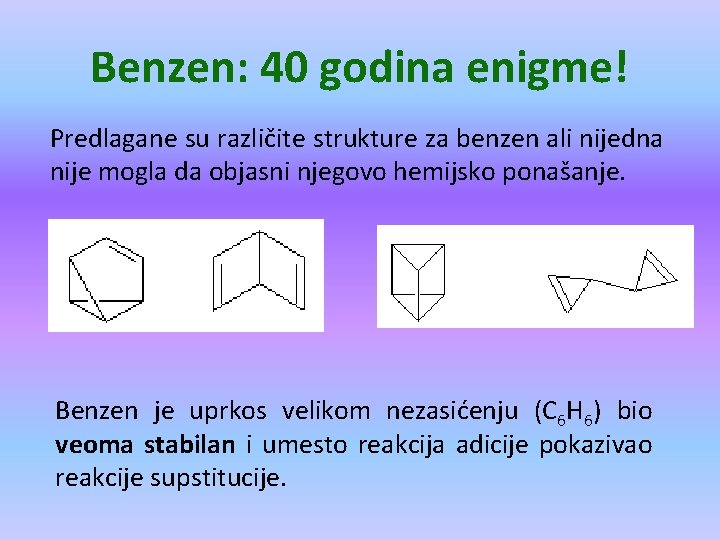
Benzen: 40 godina enigme! Predlagane su različite strukture za benzen ali nijedna nije mogla da objasni njegovo hemijsko ponašanje. Benzen je uprkos velikom nezasićenju (C 6 H 6) bio veoma stabilan i umesto reakcija adicije pokazivao reakcije supstitucije.

1865. godine Kekule je predložio strukturu benzena: Ova struktura zadovoljavala je sledeće eksperimentalne činjenice: 1. Svi H atomi u benzenu su ekvivalentni. 2. Postoji samo jedan monosupstituisani proizvod (C 6 H 5 X).

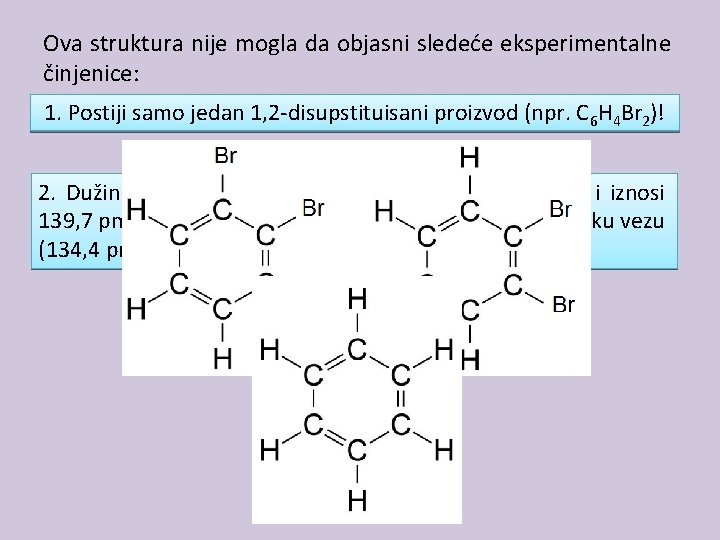
Ova struktura nije mogla da objasni sledeće eksperimentalne činjenice: 1. Postiji samo jedan 1, 2 -disupstituisani proizvod (npr. C 6 H 4 Br 2)! 2. Dužina svih ugljenik-ugljenik veza u benzenu je ista i iznosi 139, 7 pm (između vrednosti za prostu (154 pm) i dvostruku vezu (134, 4 pm))!

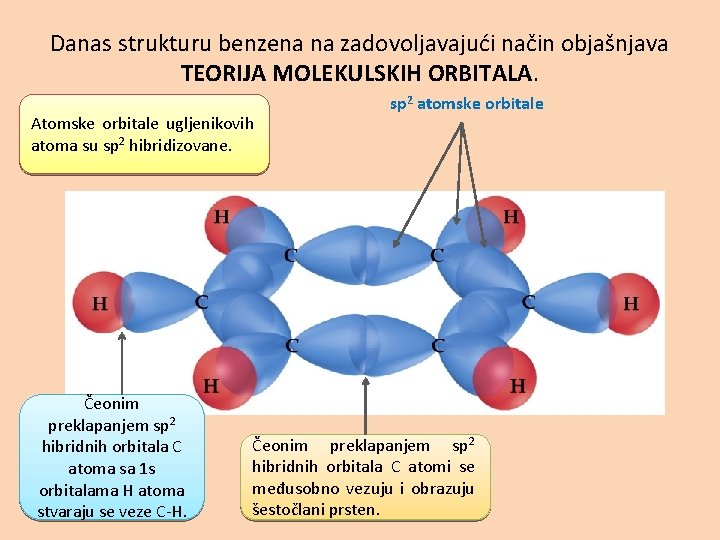
Danas strukturu benzena na zadovoljavajući način objašnjava TEORIJA MOLEKULSKIH ORBITALA. Atomske orbitale ugljenikovih atoma su sp 2 hibridizovane. Čeonim preklapanjem sp 2 hibridnih orbitala C atoma sa 1 s orbitalama H atoma stvaraju se veze C-H. sp 2 atomske orbitale Čeonim preklapanjem sp 2 hibridnih orbitala C atomi se međusobno vezuju i obrazuju šestočlani prsten.

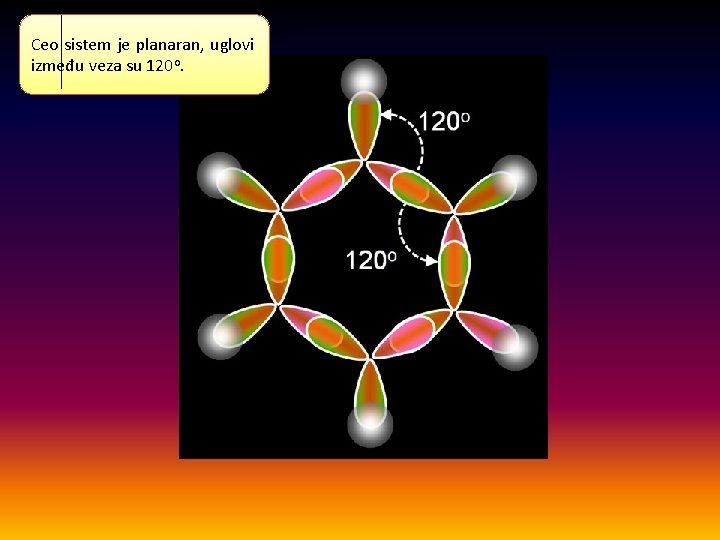
Ceo sistem je planaran, uglovi između veza su 120 o.

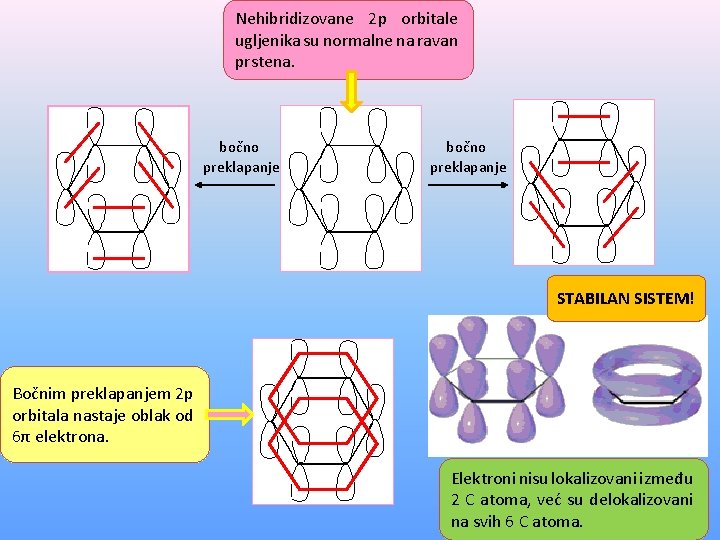
Nehibridizovane 2 p orbitale ugljenika su normalne na ravan prstena. bočno preklapanje STABILAN SISTEM! Bočnim preklapanjem 2 p orbitala nastaje oblak od 6π elektrona. Elektroni nisu lokalizovani između 2 C atoma, već su delokalizovani na svih 6 C atoma.

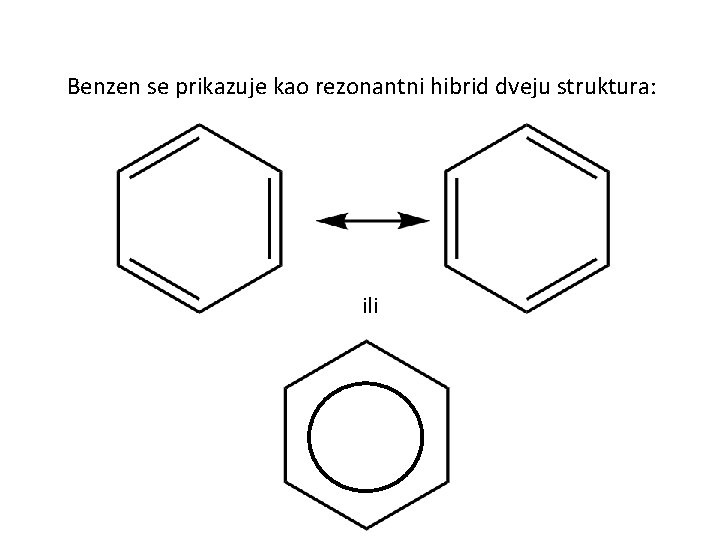
Benzen se prikazuje kao rezonantni hibrid dveju struktura: ili