Jak se tvo nzvy kyselin Definice a rozdlen














- Slides: 15

Jak se tvoří názvy kyselin

Definice a rozdělení kyselin Kyseliny jsou většinou tříprvkové sloučeniny nekovu, kyslíku a vodíku. Jen málo kyselin je dvouprvkových, složených z nekovu a vodíku. Rozdělení kyselin: a/ Kyslíkaté (nekov, O, H) b/ Bezkyslíkaté (nekov, H) Úkol 1: Vyber ze sloučenin kyseliny: Fe(OH)3, HCl, Na. OH, K 2 O, SCl 4, Pb. S, Al. Cl 3, H 2 O, HCl. O 3, Ca(OH)2, HIO 4, H 3 PO 4

Kontrola úkolu 1 HCl, HCl. O 3, HIO 4, H 3 PO 4

Názvosloví bezkyslíkatých kyselin Název kyseliny se skládá z podstatného jména kyselina a přídavného jména odvozeného od názvu nekovu s příponou -ovodíková. Ve vzorci píšeme vodík jako první. Oxidační číslo nekovu je záporné, vodíku +I. Součet oxidačních čísel v molekule je roven 0. Úkol 2: Odvoď název kyseliny HI a vzorec kyseliny fluorovodíkové:

Kontrola úkolu 2 Kyselina jodovodíková, HF

Názvosloví kyslíkatých kyselin Název tvoří podstatné jméno kyselina a přídavné jméno odvozené od nekovu s předponou vyjadřující počet vodíků a příponou odpovídající jeho oxidačnímu číslu. Číslovková předpona pro počet H je: 1 H - mono, 2 H - di, 3 H - tri, 4 H - tetra, 5 H - pentahydrogen, např. H 3 PO 4 je kyselina trihyrogenfosforečná. Oxidační čísla v kyselině jsou O-II, HI, nekov I - VIII. Součet hodnot oxidačních čísel všech atomů v kyselině je 0.

Odvození vzorce kyseliny Postup při odvození vzorce kyseliny dihyrogensírové: Napíšeme značky prvků v pořadí H, nekov, O - HSO. Zapíšeme podle předpony počet vodíků - H 2 SO. U prvků zapíšeme oxidační čísla HI, SVI podle koncovky přídavného jména, O-II - HI 2 SVIO-II Upravíme počet atomů kyslíku tak, aby součet všech oxidačních čísel v molekule byl 0 (2 · 1 + 6) : 2 = 4 - HI 2 SVIO-II 4. Vzorec kyseliny dihydrogensírové je H 2 SO 4.

Úkol 3: Napiš vzorce kyselin: a/ Kyselina monohydrogenchlorečná b/ Kyselina trihydrogenboritá c/ Kyselina dihydrogenuhličitá d/ Kyselina tetrahydrogenkřemičitá e/ Kyselina pentahydrogenjodistá

Kontrola úkolu 3 a/ HCl. O 3 b/ H 3 BO 3 c/ H 2 CO 3 d/ H 4 Si. O 4 e/ H 5 IO 6

Odvození vzorce kyseliny z kyselinotvorného oxidu Postup při odvození vzorce kyseliny sírové: Vzorec každé kyseliny lze odvodit z kyselinotvorného oxidu, který má stejnou koncovku jako kyselina, a vody, v našem případě z oxidu sírového. SO 3 + H 2 O → H 2 SO 4 Vzorec kyseliny sírové je H 2 SO 4.

Úkol 4: Odvoď vzorce kyselin z kyselinotvorného oxidu a vody: a/ Kyselina dusičná b/ Kyselina chlorná c/ Kyselina siřičitá d/ Kyselina chromová e/ Kyselina manganistá

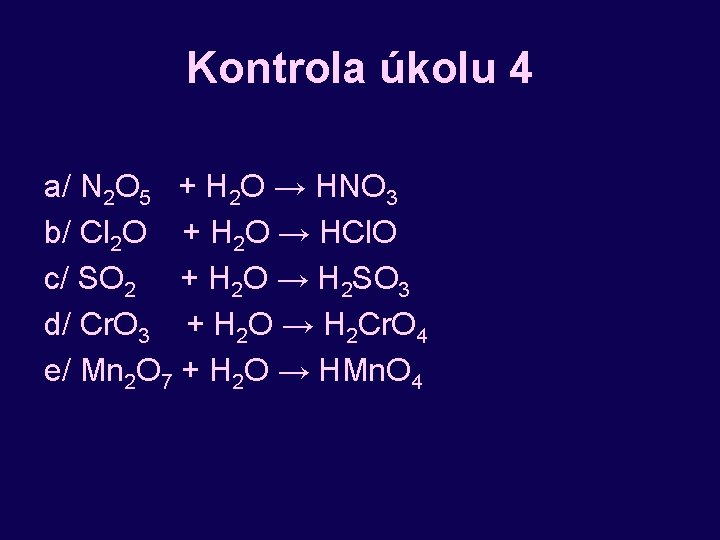
Kontrola úkolu 4 a/ N 2 O 5 + H 2 O → HNO 3 b/ Cl 2 O + H 2 O → HCl. O c/ SO 2 + H 2 O → H 2 SO 3 d/ Cr. O 3 + H 2 O → H 2 Cr. O 4 e/ Mn 2 O 7 + H 2 O → HMn. O 4

Odvození názvu kyseliny Postup při odvození názvu H 3 PO 3: Jedná se o kyselinu, neboť obsahuje H, nekov, O. Podle počtu vodíků v kyselině odvodíme předponu v našem případě kyselina trihydrogen. Napíšeme oxidační čísla vodíku a kyslíku HI 3 PO-II 3. Vypočítáme oxidační číslo fosforu 3 · 1 + x + 3 · (-2) = 0 x = 3 oxidační číslo fosforu je 3 - itá Název sloučeniny je kyselina trihydrogenfosforitá.

Úkol 5: Doplň oxidační čísla nekovů a napiš názvy kyselin: a/ HBr. O b/ H 2 Si. O 3 c/ H 3 PO 2 d/ HFO 4 e/ HIO 3 f/ HNO 2

Kontrola úkolu 5 a/ HBr. IO kyselina monohydrogenbromná b/ H 2 Si. IVO 3 kyselina dihydrogenkřemičitá c/ H 3 PIO 2 kyselina trihydrogenfosforná d/ HFVIIO 4 kyselina monohydrogenfluoristá e/ HIVO 3 kyselina monohydrogenjodičná f/ HNIIIO 2 kyselina monohydrogendusitá
 Stephanie flanagan
Stephanie flanagan Vzorce oxidov
Vzorce oxidov Kyseliny
Kyseliny Nazvoslovie soli
Nazvoslovie soli Zsad
Zsad Nitrily
Nitrily Kyslikate kyseliny
Kyslikate kyseliny Kyselinotvorny prvok
Kyselinotvorny prvok Halogenidy karboxylových kyselin
Halogenidy karboxylových kyselin Etylester kyseliny maslovej
Etylester kyseliny maslovej Vyznamne soli kyslikatych kyselin
Vyznamne soli kyslikatych kyselin Deriváty karboxylových kyselin test
Deriváty karboxylových kyselin test Realismus literatura
Realismus literatura Fiskální politika definice
Fiskální politika definice Definice managementu
Definice managementu Totální komunikace neslyšících
Totální komunikace neslyšících