Instrumentls metodes Kura mris iepazstint studentus ar dadm











































- Slides: 63

Instrumentālās metodes • Kura mērķis - iepazīstināt studentus ar dažādām instrumentālām metodēm ar pielietojumu molekulārajā un šūnu bioloģijā, bioķīmijā un citās radniecīgās nozarēs • Kurss notiks LU BF un Biomedicīnas pētījumu un studiju centrā (BMC)

Instrumentālo metožu kursa saturs • Proteīnu ekspresija, attīrīšana un elektroforēze (BF, 2 xlekc. , lab. d. ) • Mikroskopija - optiskā (BF), konfokālā (BF), elektronu (BMC), lekc. , lab. d. , demonstr. • Organellu atdalīšana centrifūgas gradientā (BF, lekc. +lab. d) • DNS sekvenēšana (BMC, lekc. +mini-lab. d. ) • Masspektrometrija (BMC, lekc. + mini-lab. d. ) • Reālā laika PCR (BMC, lekc. + mini-lab. d. ) • Plūsmas citometrija (BMC, lekc. + demonstr. ) • Radioaktīvo elementu pielietojums bioloģijā (BF, BMC, lekc. + demonstr. ) • Proteīnu struktūru noteikšanas metodes – rentgenstruktūranalīze un KMR (BMC, BF 2 xlekc. , 1 xmini lab. d. )

Prasības • Sekmīgi nokārtoti visi pārbaudes darbiņi • Apmeklēti visi laboratorijas darbi, par kuriem vēlāk iesniegti protokoli • Sekmīgi nokārtots gala tests • Kavētos pārbaudes darbiņus var uzrakstīt pēc lekcijas 331. telpā vai pēc nodarbībām BMC • Sekmīgi nokārtoto pārbaudes darbiņu pārlikšana nolūkā iegūt augstāku atzīmi netiks atbalstīta • Galīgā atzīme ir aptuveni proporcionāla nodarbību skaitam un tiks izlikta pēc formulas (1 x atzīme pirmajā testā + 2 x atzīme pie Tūra Selgas + 3 x atzīme noslēguma testā)/6. Atzīme pie Tūra Selgas tiek izlikta par mikroskopijas/konfokālās mikroskopijas nodarbībām.

Proteīnu ekspresija un attīrīšana

Kā iegūt proteīnu? • No dabīgā organisma • Mākslīgi producēt citā organismā • Sintezēt (parasti tikai relatīvi īsus peptīdus!)

Proteīna iegūšana no dabīgā organisma • Priekšrocības: • 1. Nav nepieciešamības veikt ģenētiskas manipulācijas • 2. Proteīns vienmēr ir dabīgajā formā • Trūkumi • 1. Var būt grūti iegūt lielus daudzumus • 2. Var būt ētiskas problēmas • 3. Parasti grūti attīrīt • 4. Ierobežotas iespējas pētīt modificētus proteīnus

Piemērs: Liellopu seruma albumīns (BSA) • • Asins serums satur ap 60% albumīna Viegli izolējams ar precipitēšanas metodi Liellopu asins serums ir plaši pieejams BSA plaši pielieto molekulārajā bioloģijā

Proteīnu producēšana (“ekspresija”) citā organismā • Priekšrocības -Var uzproducēt praktiski jebkuru proteīnu -Dabā reti sastopamus proteīnus var uzproducēt lielos daudzumos -Proteīnu var modificēt, lai atvieglotu tā attīrīšanu -Var vikt citas ģenētiskas modifikācijas • Trūkumi -Nepieciešams veikt laikietilpīgas manipulācijas ar rekombinanto DNS -Proteīns var nebūt dabīgajā konformācijā vai izrādīties nešķīstošs

Vektori • Lai gēnu ievietotu citā organismā, lieto t. s. vektorus • Vektori ir divu veidu: • 1. Plazmīdu vektori (vairumā gadījumu) • 2. Vīrusu vektori

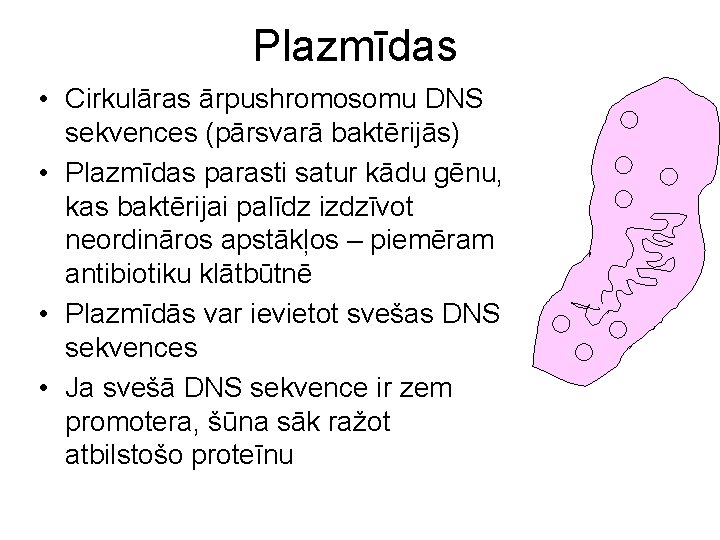
Plazmīdas • Cirkulāras ārpushromosomu DNS sekvences (pārsvarā baktērijās) • Plazmīdas parasti satur kādu gēnu, kas baktērijai palīdz izdzīvot neordināros apstākļos – piemēram antibiotiku klātbūtnē • Plazmīdās var ievietot svešas DNS sekvences • Ja svešā DNS sekvence ir zem promotera, šūna sāk ražot atbilstošo proteīnu

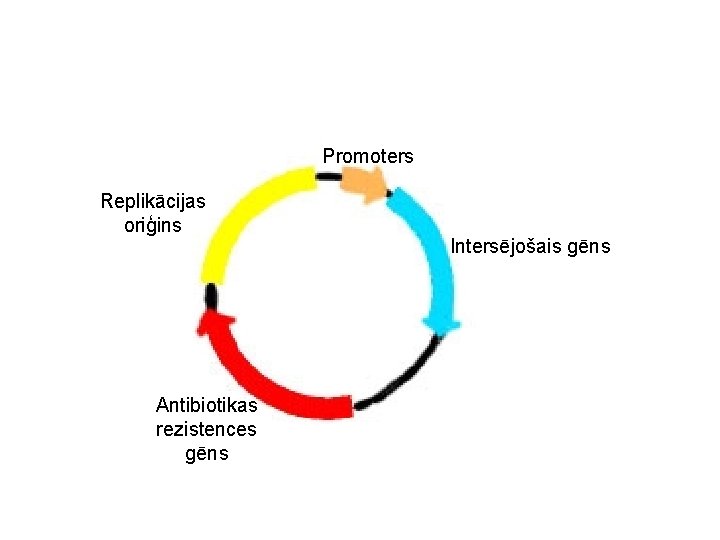
Promoters Replikācijas oriģins Antibiotikas rezistences gēns Intersējošais gēns

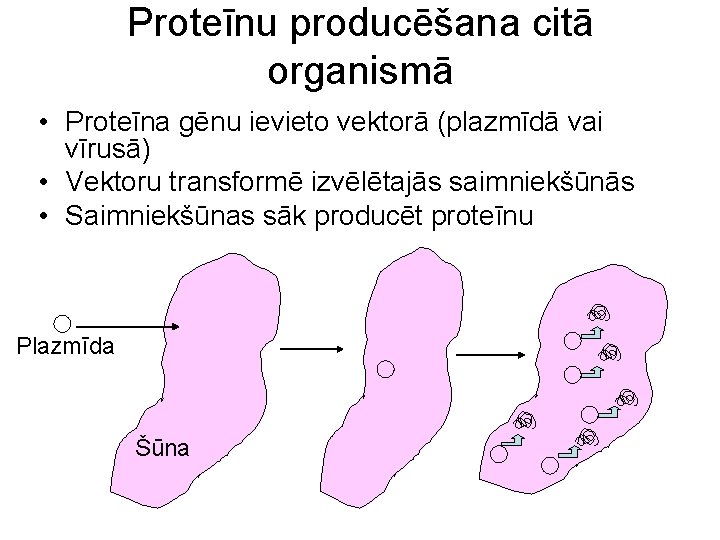
Proteīnu producēšana citā organismā • Proteīna gēnu ievieto vektorā (plazmīdā vai vīrusā) • Vektoru transformē izvēlētajās saimniekšūnās • Saimniekšūnas sāk producēt proteīnu Plazmīda Šūna

Vīrusu vektori • Var būt bakteriāli (bakteriofāgi), insektu, dzīvnieku vai augu • Parasti nebūtisku vīrusa gēnu aizvieto ar interesējošā proteīna gēnu • Šūnas inficē ar rekombinanto vīrusu • Vīrusa proteīni kopā ar interesējošo proteīnu tiek producēti saimniekšūnā

Piemērs: Bakulovīruss • Insektu vīruss • Inficē gan pašus insektus, gan arī kultivētas insektu šūnas • Polihedrīns ir proteīns, kas ietver vairākas vīrusa daļiņas • Polihedrīns palīdz vīrusam izdzīvot apkārtējā vidē • Laboratorijas apstākļos polihedrīns nav būtisks un to var aizvietot


Saimniekšūnu izvēle • Dažādas sistēmas: – Bakteriālā – Raugu – Insektu – Zīdītāju – Augu

• Saimniekšūna var ietekmēt : – Produkcijas daudzumu – Šķīdību – Aminoskābju pēctranslācijas modifikācijas (glikozilēšanu, fosforilēšanu, etc)

• Saimniekšūnas izvēlas atkarībā no: – Pielietošanas mērķa – Nepieciešamā proteīna daudzuma – Proteīna oriģinālā organisma – Cenas – Proteīna potenciālā toksiskuma – Sistēmas vienkāršības

Saimniekšūnas izvēle atkarībā no nepieciešamā proteīna daudzuma • Baktērijas > Raugi >> Insekti > Zīdītāji • Kristalogrāfijai vai NMR ir nepieciešams ļoti daudz proteīna • Šī iemesla pēc ne-bakteriālās sistēmas bieži ir nereālistiskas proteīnu strukturālajiem pētījumiem

Produkcija baktērijās (E. coli) • • • Labās ziņas: Produkcijas apjoms ir augsts Lēti Viekārši strādāt Baktērijas ātri aug Sliktās ziņas: Proteīns bieži ir nešķīstošs Nav pēctranslācijas modifikāciju Ne-baktēriju membrānu proteīnus parasti nav iespējams producēt

Raugi • • Labi: Produkcijas apjoms ir augsts Lēti Samērā vienkārši strādāt (salīdzinot ar zīdītāju šūnām ) Dažas pēctranslācijas modifikācijas ir līdzīgas zīdītāju šūnām Slikti: Ne visas pēctranslācijas modifikācijas ir tādas pašas kā zīdītāju šūnām Proteīni bieži tiek pārglikolizēti

Insektu (Bakulovīrusa) sistēma • Interesējošā proteīna gēnu ievieto bakulovīrusa genomā • Insekta šūnu kultūru vai kāpurus inficē ar rekombinanto bakulovīrusu

Insektu (Bakulovīrusa) sistēma • • Labi: Produkcijas apjoms ir salīdzinoši augsts Lētāk nekā zīdītāju šūnās Lielākā daļa pēctranslācijas modifikāciju ir tādas pašas kā zīdītāju šūnās • Slikti: • Rekombinanta bakulovīrusa konstruēšana ir samērā sarežģīta • Daudz dārgāk nekā baktērijās vai raugos

Zīdītāju šūnas • Parasti izmanto transformētas zīdītāju šūnu kultūras • Visbiežāk COS šūnas (oriģināli no Āfrikas zaļajiem pērtiķiem) vai HEK šūnas (human embryonic kidney) • Šūnas transfecē ar plazmīdām vai inficē ar rekombinantajiem vīrusiem

Zīdītāju šūnas • Labi: • Zīdītāju proteīniem ir autentiskas pēctranslācijas modifikācijas • Proteīni ir šķīstoši • Slikti: • Produkcijas apjoms ir zems • Sarežģīti strādāt • Šūnas aug lēni • Ļoti dārgi

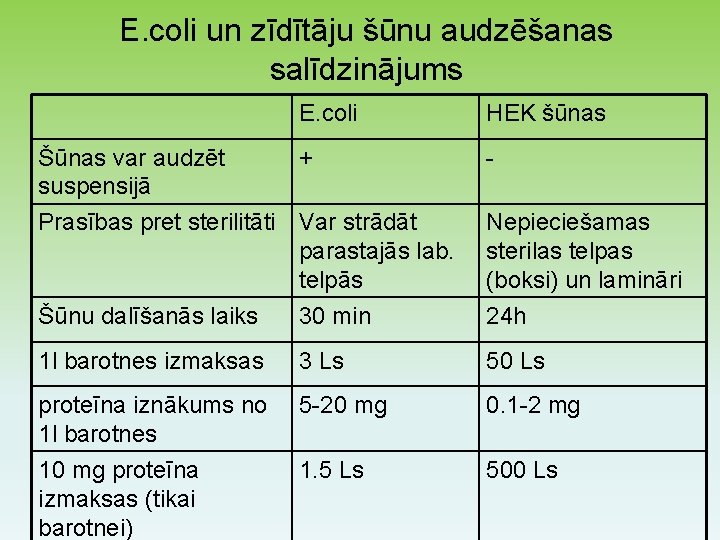
E. coli un zīdītāju šūnu audzēšanas salīdzinājums E. coli HEK šūnas Šūnas var audzēt + suspensijā Prasības pret sterilitāti Var strādāt parastajās lab. telpās - Šūnu dalīšanās laiks 30 min 24 h 1 l barotnes izmaksas 3 Ls 50 Ls proteīna iznākums no 1 l barotnes 10 mg proteīna izmaksas (tikai barotnei) 5 -20 mg 0. 1 -2 mg 1. 5 Ls 500 Ls Nepieciešamas sterilas telpas (boksi) un lamināri

Kā proteīnus dabūt ārā no šūnām ? • Iekššūnas proteīni : šūnu sagraušana • Sekretējamie proteīni – proteīni ir jau sekretēti no šūnām, bet tos nepieciešams koncentrēt • Vairumā gadījumu ir jāstrādā ar iekššūnas proteīniem

Šūnu sagraušana Fizikālās metodes • Ultraskaņa • Frenča prese • Lodīšu dzirnavas Ķīmiskās un fizioķīmiskās metodes • Deterģenti • Enzīmi (lizocīms baktēriju šūnām) • Osmotiskais šoks

Proteīnu iekoncentrēšna • Precipitēšana (ar amonija sulfātu vai polietilēnglikolu) • Ūdens ietvaicēšana vakuumā (jāņem vērā, ka pieaug sāļu koncentrācija) • Ultrafiltrācija

Šķīstošs vai nē? • • Šķīstošs – viss kārtībā! Nešķīstošs (ieslēguma ķermeņi): nav labi : ( – • Var izmēģināt refoldingu Kā mēģināt uzlabot šķīdību: Samazināt ekspresijas apjomu, pazemināt šūnu audzēšanas temperatūru • Nekas nepalīdz? 1. Izmēģināt citu saimniekšūnu veidu 2. Pamest projektu. . .

Bezšūnu proteīnu sintēze • Translāciju ir iespējams veikt in vitro • Daudz sarežģītāks process, nekā, piemēram, in vitro replikācija vai transkripcija • Nepieciešamas ribosomas, aminoskābes, t. RNS, m. RNS, aminoacil-t. RNA sintetāzes, translācijas faktori, . . . • Izmanto šūnu lizātus • Var izmantot gan eikariotisko, gan prokariotisko šūnu lizātus • Parasti izmanto trušu retiklocītu, kviešu dīgļu šūnu vai E. coli lizātus

Bezšūnu proteīnu sintēze • • Pielietojumi: Šūnām toksisku proteīnu sintēze Proteīnu iezīmēšana NMR Membrānu proteīnu sintēze Trūkumi: Ļoti dārga metode Grūti optimizējama metode

Proteīnu attīrīšana • Kāpēc? • Lai proteīnu raksturotu (enzimātiskā aktivitāte, ligandu piesaistīšana, stabilitāte, etc) • Lai noteiktu proteīna 3 D struktūru • Lai identificētu proteīnu, saistītu ar noteiktu aktivitāti • Lai zinātniskiem, industriāliem vai medicīniskiem mērķiem saražotu proteīnu ar zināmu aktivitāti

Proteīnu attīrīšana pamatojas uz: • • Molekulas izmēru Virsmas lādiņu Virsmas hidrofobitāti Afinitāti (spēju piesaistīt citus savienojumus)

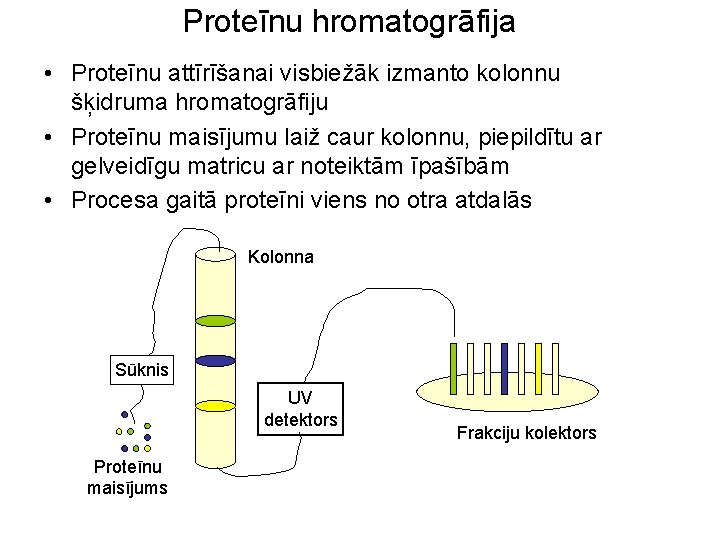
Proteīnu hromatogrāfija • Proteīnu attīrīšanai visbiežāk izmanto kolonnu šķidruma hromatogrāfiju • Proteīnu maisījumu laiž caur kolonnu, piepildītu ar gelveidīgu matricu ar noteiktām īpašībām • Procesa gaitā proteīni viens no otra atdalās Kolonna Sūknis UV detektors Proteīnu maisījums Frakciju kolektors

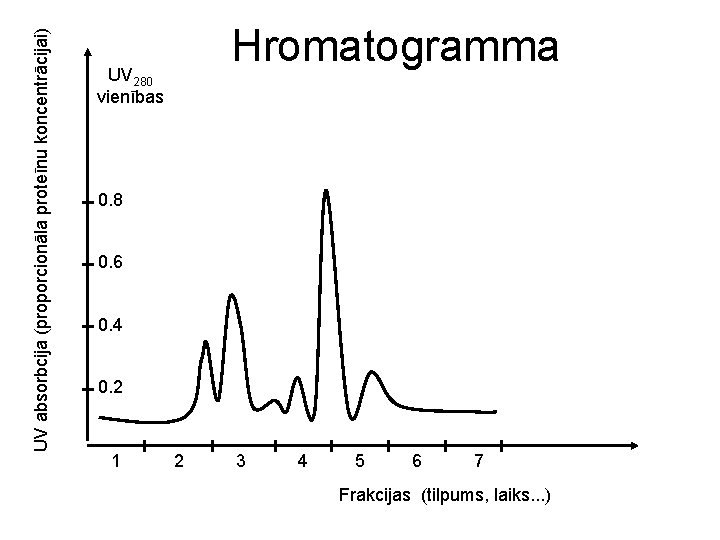
UV absorbcija (proporcionāla proteīnu koncentrācijai) Hromatogramma UV 280 vienības 0. 8 0. 6 0. 4 0. 2 1 2 3 4 5 6 7 Frakcijas (tilpums, laiks. . . )

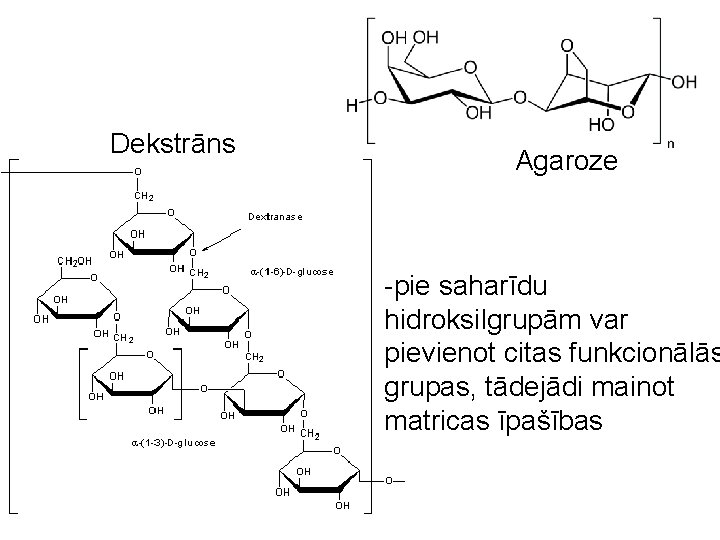
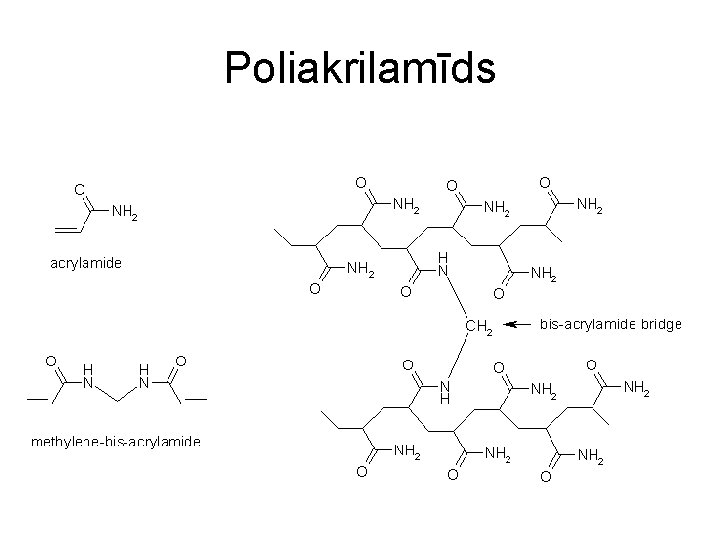
Kolonnas matricu materiāli - dekstrāni (sazaroti glikozes polimēri) - agaroze (galaktozes polimēri) - poliakrilamīds - jaukti agarozes – poliakrilamīda polimēri - pie saharīdu hidroksilgrupām var piešūt citas funkcionālās grupas, tādejādi mainot matricas īpašības

Dekstrāns Agaroze -pie saharīdu hidroksilgrupām var pievienot citas funkcionālās grupas, tādejādi mainot matricas īpašības

Poliakrilamīds

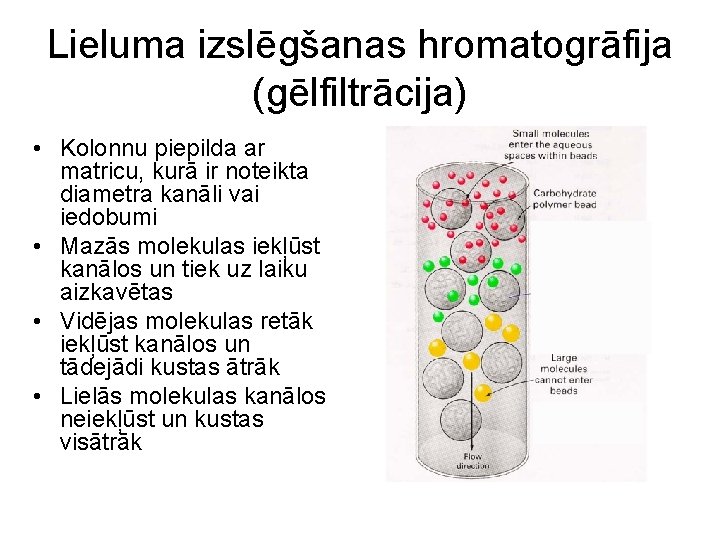
Kolonnas matricu veidi (pēc īpašībām) • • Gēlfiltrācijas (atdala pēc molekulu izmēra) Jonapmaiņas (atdala pēc molekulu lādiņa) Hidrofobās (atdala pēc molekulu šķīdības) Afinitātes (atdala pēc noteiktu proteīnu spējas piesaistīties citām molekulām)

Lieluma izslēgšanas hromatogrāfija (gēlfiltrācija) • Kolonnu piepilda ar matricu, kurā ir noteikta diametra kanāli vai iedobumi • Mazās molekulas iekļūst kanālos un tiek uz laiku aizkavētas • Vidējas molekulas retāk iekļūst kanālos un tādejādi kustas ātrāk • Lielās molekulas kanālos neiekļūst un kustas visātrāk

Lieluma izslēgšanas hromatogrāfija (gēlfiltrācija) • No matricas materiāla veido lodītes ar noteiktu poru diametru • Atšķirīgi poru (kanālu) diametri ir piemēroti dažādu lielumu molekulu attīrīšanai

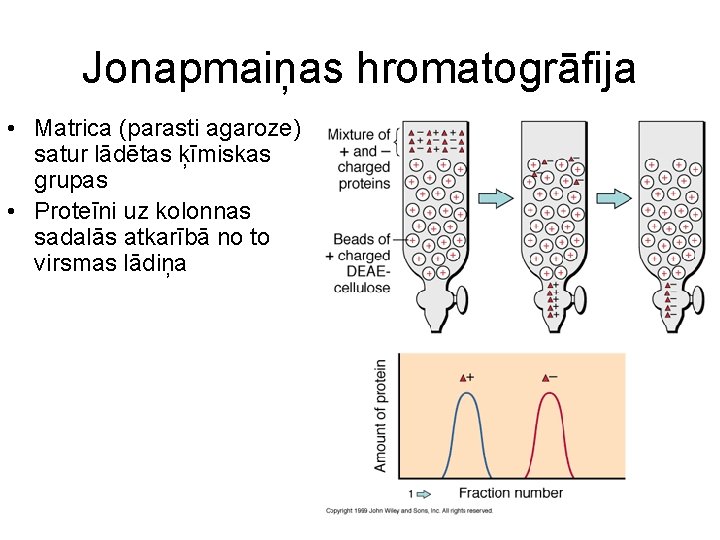
Jonapmaiņas hromatogrāfija • Matrica (parasti agaroze) satur lādētas ķīmiskas grupas • Proteīni uz kolonnas sadalās atkarībā no to virsmas lādiņa

Jonapmaiņas hromatogrāfija • Katjonapmaiņa: Matrica ir negatīvi lādēta piemēram S (Sulfo) un CM (Carboxymethyl) • Anjonapmaiņa Matrica ir pozitīvi lādēta, piem. Q (Quaternary ammonium) un DEAE (Diethylaminoethyl) • Eluēšana: Ar lineāri pieaugošu sāls gradientu, pamatojas uz konkurējošiem joniem • Lielākā daļa proteīnu ir negatīvi lādēti, tāpēc parasti izmanto anjonapmaiņu

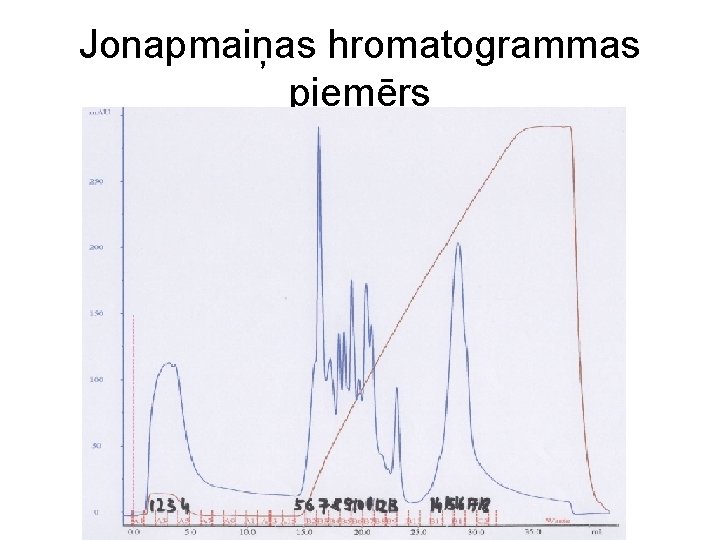
Jonapmaiņas hromatogrammas piemērs

Hidrofobā hromatogrāfija • Pamatojas uz hidrofobajām mijiedarbībām • Kolonnas matrica satur hidrofobas grupas (fenil-, butil-, oktil-, u. c. ) • Proteīnu hidrofobās aminoskābes mijiedarojas ar matriksa hidrofobajām grupām • Hidrofili proteīni kolonnā kustas ātrāk • Proteīnus uz kolonnas var adsorbēt augstā sāls koncentrācijā • Proteīnus pakāpeniski eluē ar samazinošos sāls koncentrācijas gradientu

Afinitātes hromatogrāfija • Pie matricas ir piesaistīts ligands, kurš saistās ar kādu noteiktu proteīnu • Ligands var būt: -metāla joni (Visvairāk izplatītā tehnika!) -antivielas pret noteiktu proteīnu -proteīns, kas saista noteiktu citu proteīnu -mazmolekulārs ligands, kas saista noteiktu proteīnu

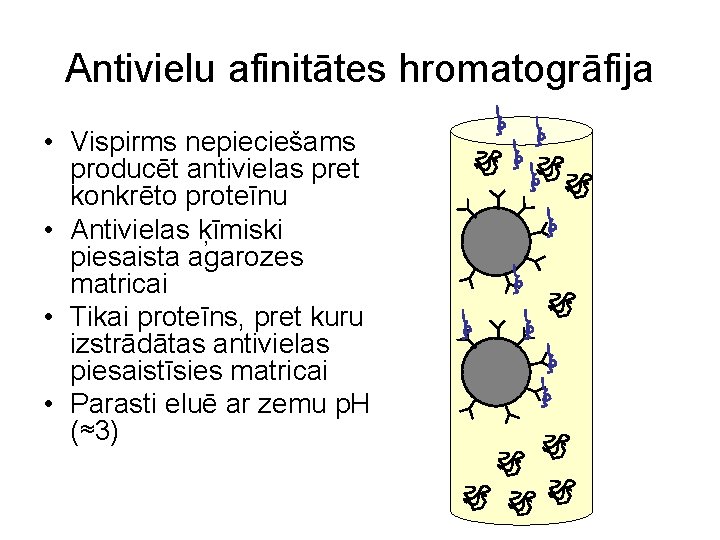
Antivielu afinitātes hromatogrāfija • Vispirms nepieciešams producēt antivielas pret konkrēto proteīnu • Antivielas ķīmiski piesaista agarozes matricai • Tikai proteīns, pret kuru izstrādātas antivielas piesaistīsies matricai • Parasti eluē ar zemu p. H (≈3)

Antivielu afinitātes hromatogrāfija • Priekšrocības: -Ļoti selektīva metode • Trūkumi: -nepieciešams producēt antivielas pret jau attīrītu proteīnu -dārgi -var būt grūtības eluēt proteīnu no kolonnas

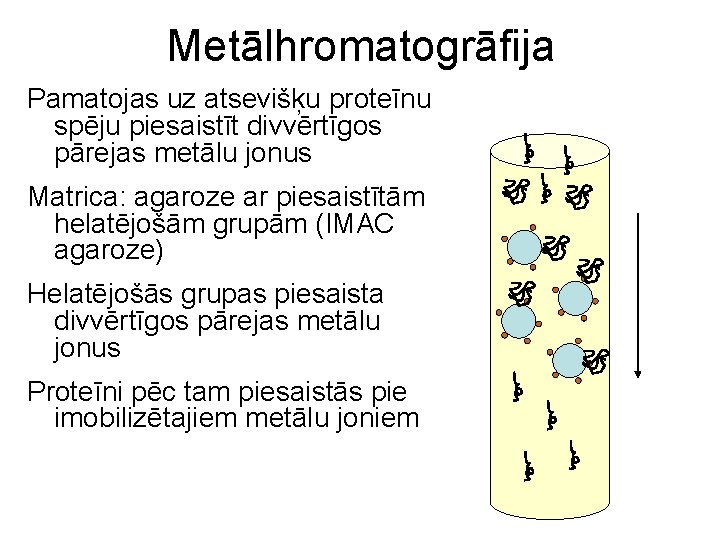
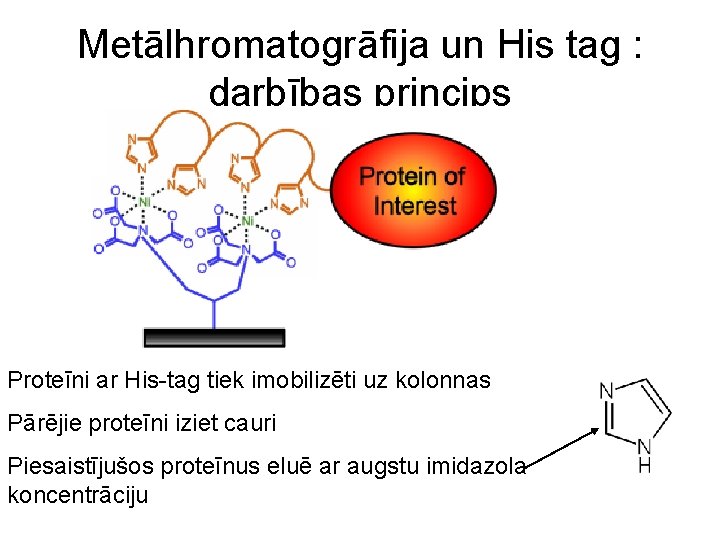
Metālhromatogrāfija Pamatojas uz atsevišķu proteīnu spēju piesaistīt divvērtīgos pārejas metālu jonus Matrica: agaroze ar piesaistītām helatējošām grupām (IMAC agaroze) Helatējošās grupas piesaista divvērtīgos pārejas metālu jonus Proteīni pēc tam piesaistās pie imobilizētajiem metālu joniem

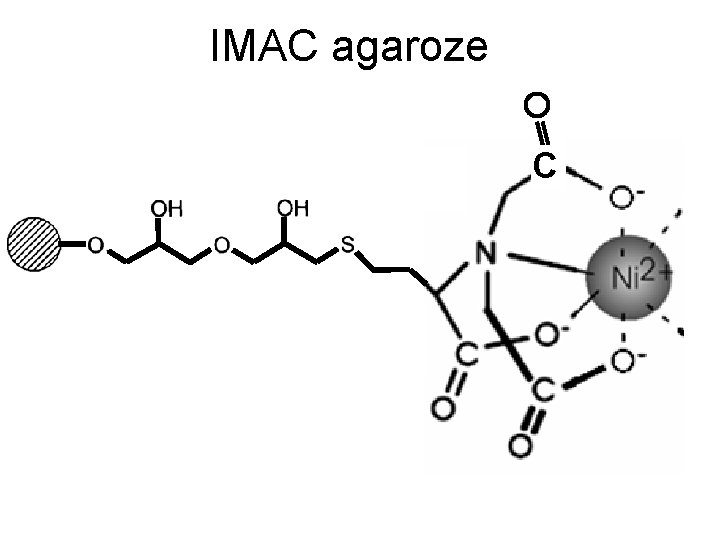
IMAC agaroze C

Kādi proteīni piesaista pārejas metālu jonus? • Tikai daži proteīnu veidi dabīgi spēj piesaistīt metāla jonus • Metāla jonus piesaistošas sekvences var ieviest mākslīgi • Parasti izmanto t. s. His-tag – 6 histidīnus pēc kārtas

His tag ieviešana proteīnos • Histidīnus ievieš mākslīgi ar gēnu inženierijas metodēm • Metodes trūkums: modificētais proteīns var būt neaktīvs • Var ieviest proteāžu saitus, lai pēc attīrīšanas His tag sekvenci varētu viegli atšķelt

Metālhromatogrāfija un His tag : darbības princips Proteīni ar His-tag tiek imobilizēti uz kolonnas Pārējie proteīni iziet cauri Piesaistījušos proteīnus eluē ar augstu imidazola koncentrāciju

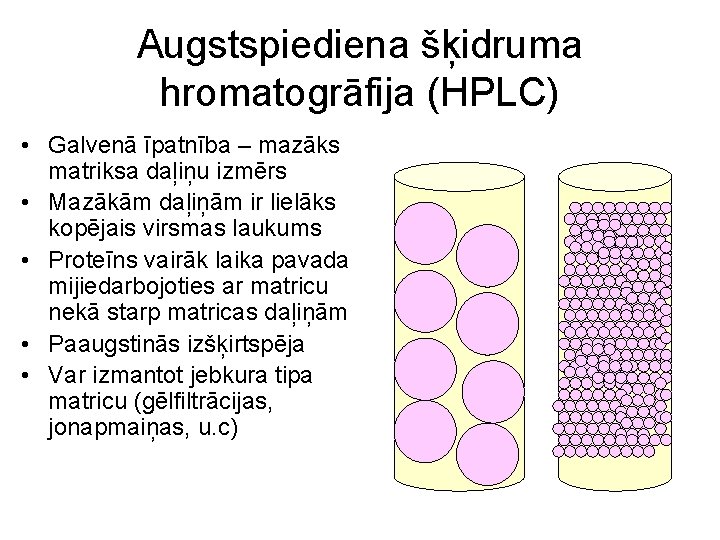
Augstspiediena šķidruma hromatogrāfija (HPLC) • Galvenā īpatnība – mazāks matriksa daļiņu izmērs • Mazākām daļiņām ir lielāks kopējais virsmas laukums • Proteīns vairāk laika pavada mijiedarbojoties ar matricu nekā starp matricas daļiņām • Paaugstinās izšķirtspēja • Var izmantot jebkura tipa matricu (gēlfiltrācijas, jonapmaiņas, u. c)

Kāpēc “augstspiediena” ? • Samazinoties matricas daļiņu izmēram, nepieciešams augstāks spiediens, lai šķīdums tecētu cauri kolonnai • Pieaugot daļiņu lineārajam izmēram, nepieciešamais spiediens pieaug kvadrātiski • 10 x mazākas daļiņas – 100 x lielāks spiediens • Spiediens var sasniegt vairākus simtus atmosfēru • HPLC kolonnas gatavo no tērauda vai bieza stikla

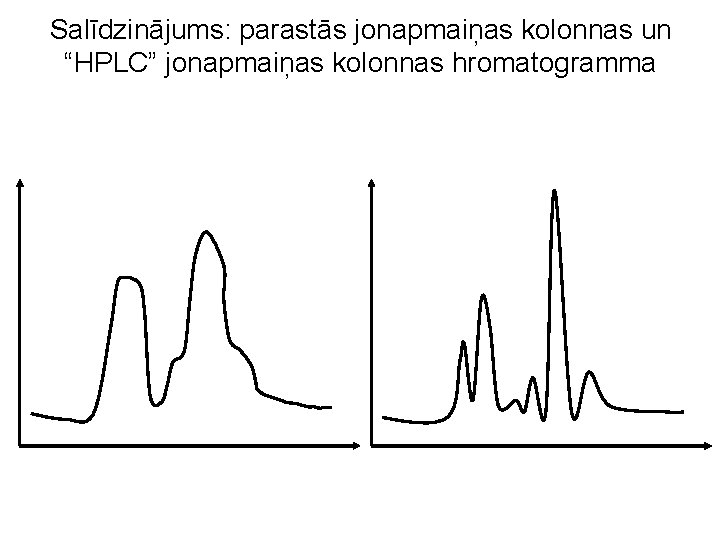
Salīdzinājums: parastās jonapmaiņas kolonnas un “HPLC” jonapmaiņas kolonnas hromatogramma

Proteīnu selektīva precipitēšana • Pamatojas uz dažādu proteīnu atšķirīgu hidrofobitāti – Organiskie precipitanti (piem. polietilēnglikols) – Neorganiskie precipitanti (piem. , amonija sulfāts) – Nav pārāk selektīva metode, var tik izmantota kā pirmais solis attīrīšanā – Efektīvāka, ja proteīns ir ļoti labi vai ļoti slikti šķīstošs

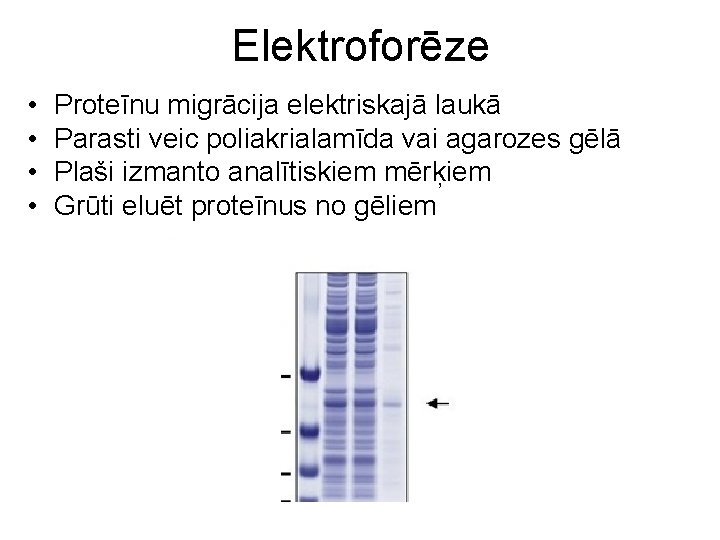
Elektroforēze • • Proteīnu migrācija elektriskajā laukā Parasti veic poliakrialamīda vai agarozes gēlā Plaši izmanto analītiskiem mērķiem Grūti eluēt proteīnus no gēliem

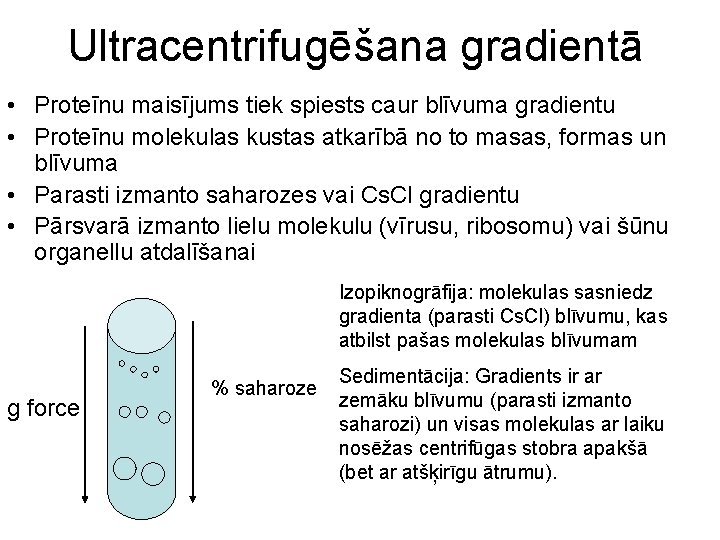
Ultracentrifugēšana gradientā • Proteīnu maisījums tiek spiests caur blīvuma gradientu • Proteīnu molekulas kustas atkarībā no to masas, formas un blīvuma • Parasti izmanto saharozes vai Cs. Cl gradientu • Pārsvarā izmanto lielu molekulu (vīrusu, ribosomu) vai šūnu organellu atdalīšanai Izopiknogrāfija: molekulas sasniedz gradienta (parasti Cs. Cl) blīvumu, kas atbilst pašas molekulas blīvumam g force % saharoze Sedimentācija: Gradients ir ar zemāku blīvumu (parasti izmanto saharozi) un visas molekulas ar laiku nosēžas centrifūgas stobra apakšā (bet ar atšķirīgu ātrumu).

Ultrafiltrēšana • Lieto filtru ar noteiktu poru izmēru, salīdzināmu ar makromolekulu izmēriem • Nav pārāk selektīva metode • Noderīga proteīnu koncentrēšanai un atsāļošanai

Siltuma izturība • Dažādiem proteīniem ir dažāda denaturēšanās temperatūra • Metode ir ļoti noderīga termostabilu proteīnu attīrīšanai • Piemērs: Thermus aquaticus DNS polimerāze, producēta E. coli -Karsē šūnu lizātu pie 80 o. C 15 min -Lielākā daļa E. coli proteīnu (ap 90 %) denaturēsies un izkritīs nogulsnēs

Kā uzzināt, kurā frakcijā ir attīrāmais proteīns? • Pēc pīķiem hromatogrammā • Pēc molmasas analītiskajā elektroforēzē • Detektēšana ar antivielām (proteīnuspecifiskām vai anti-His tag) • Proteīna enzimātiskā aktivitāte • Nav pārliecības? • Var veikt masas spektrometriju vai N–gala sekvenēšanu
 Kura kura
Kura kura Mri helium
Mri helium How mri works
How mri works Onderrig metodes
Onderrig metodes Pašizmaksas aprēķins
Pašizmaksas aprēķins Individuālais komersants priekšrocības
Individuālais komersants priekšrocības Metodes d'entrenament de la flexibilitat
Metodes d'entrenament de la flexibilitat Interaktīvās mācību metodes
Interaktīvās mācību metodes Skaņas ierakstīšanas metodes
Skaņas ierakstīšanas metodes Kttpv
Kttpv Bronchiotis
Bronchiotis Kura zinātne pēta ģerboņus?
Kura zinātne pēta ģerboņus? Sentro ng humanismo
Sentro ng humanismo Typy użytkowe kur
Typy użytkowe kur Kura domaca zaujimavosti
Kura domaca zaujimavosti Pevninské úpatí
Pevninské úpatí Eşleştirmeli kura
Eşleştirmeli kura White rock kura
White rock kura Jedle bělokorá kůra
Jedle bělokorá kůra Oceánská a pevninská zemská kůra
Oceánská a pevninská zemská kůra Eclipse kura tutorial
Eclipse kura tutorial Intensywnie tuczona kura
Intensywnie tuczona kura Salikts sakārtots teikums un salikts pakārtots
Salikts sakārtots teikums un salikts pakārtots śpiewające brzdące gdacze kura: ko, ko, ko posłuchaj
śpiewające brzdące gdacze kura: ko, ko, ko posłuchaj Punan ang angkop
Punan ang angkop Kura pingwin
Kura pingwin