I principi della termodinamica Equivalente meccanico della caloria











- Slides: 19

I principi della termodinamica

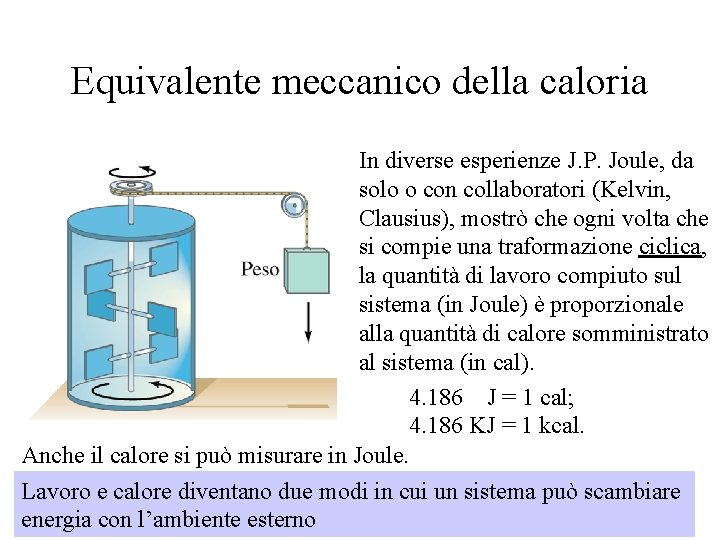
Equivalente meccanico della caloria In diverse esperienze J. P. Joule, da solo o con collaboratori (Kelvin, Clausius), mostrò che ogni volta che si compie una traformazione ciclica, la quantità di lavoro compiuto sul sistema (in Joule) è proporzionale alla quantità di calore somministrato al sistema (in cal). 4. 186 J = 1 cal; 4. 186 KJ = 1 kcal. Anche il calore si può misurare in Joule. Lavoro e calore diventano due modi in cui un sistema può scambiare energia con l’ambiente esterno

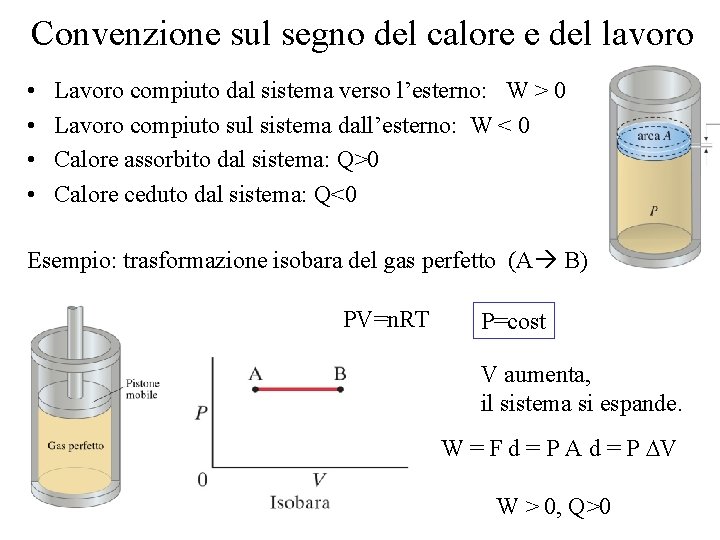
Convenzione sul segno del calore e del lavoro • • Lavoro compiuto dal sistema verso l’esterno: W > 0 Lavoro compiuto sul sistema dall’esterno: W < 0 Calore assorbito dal sistema: Q>0 Calore ceduto dal sistema: Q<0 Esempio: trasformazione isobara del gas perfetto (A B) PV=n. RT P=cost V aumenta, il sistema si espande. W = F d = P A d = P DV W > 0, Q>0

Ancora sul calore e sul lavoro Abbiamo definito le Variabili di Stato del sistema termodinamico: esempi di variabili di stato sono la Pressione, il Volume e la Temperatura. Esse sono definite solo negli stati di equilibrio del sistema. In generale nelle trasformazioni reali irreversibili, non tutte sono definite. Rappresentazione grafica di una trasformazioni irreversibile: solo nello stato iniziale e finale le variabili di stato sono definite. P B Il sistema non passa più attraverso stati di equilibrio dove tutte le variabili di stato sono definite A V Lavoro e calore non sono variabili di stato. Esse misurano le quantità di energia scambiate dal sistema nelle trasformazioni (sia essa reversibile o irreversibile)

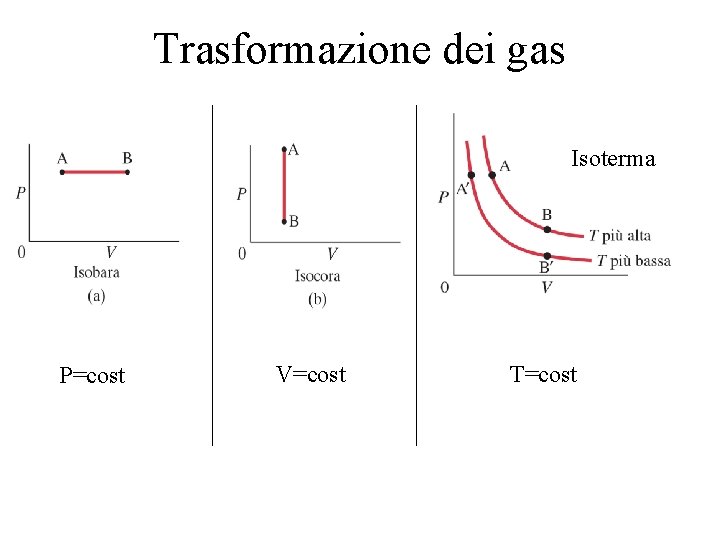
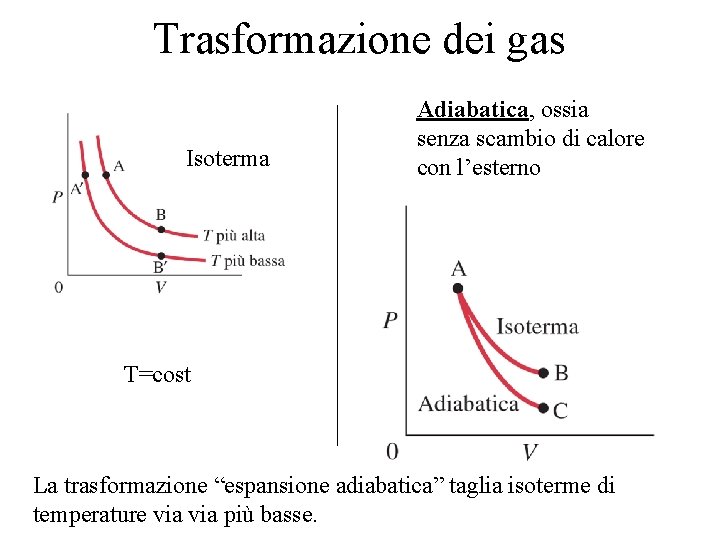
Trasformazione dei gas Isoterma P=cost V=cost T=cost

Trasformazione dei gas Isoterma Adiabatica, ossia senza scambio di calore con l’esterno T=cost La trasformazione “espansione adiabatica” taglia isoterme di temperature via più basse.

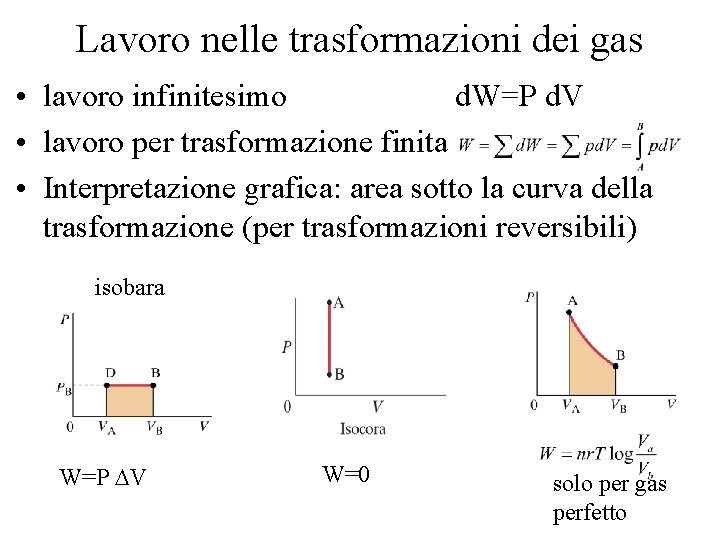
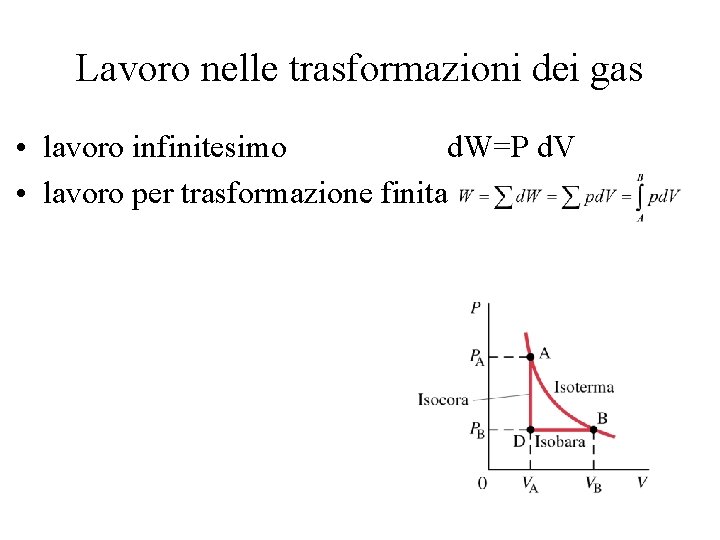
Lavoro nelle trasformazioni dei gas • lavoro infinitesimo d. W=P d. V • lavoro per trasformazione finita • Interpretazione grafica: area sotto la curva della trasformazione (per trasformazioni reversibili) isobara W=P DV W=0 solo per gas perfetto

Lavoro nelle trasformazioni dei gas • lavoro infinitesimo d. W=P d. V • lavoro per trasformazione finita









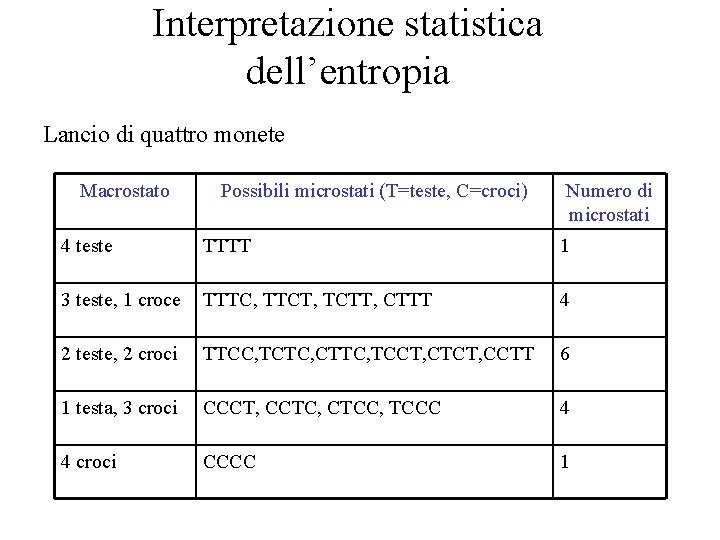
Interpretazione statistica dell’entropia Lancio di quattro monete Macrostato Possibili microstati (T=teste, C=croci) Numero di microstati 4 teste TTTT 1 3 teste, 1 croce TTTC, TTCT, TCTT, CTTT 4 2 teste, 2 croci TTCC, TCTC, CTTC, TCCT, CTCT, CCTT 6 1 testa, 3 croci CCCT, CCTC, CTCC, TCCC 4 4 croci CCCC 1

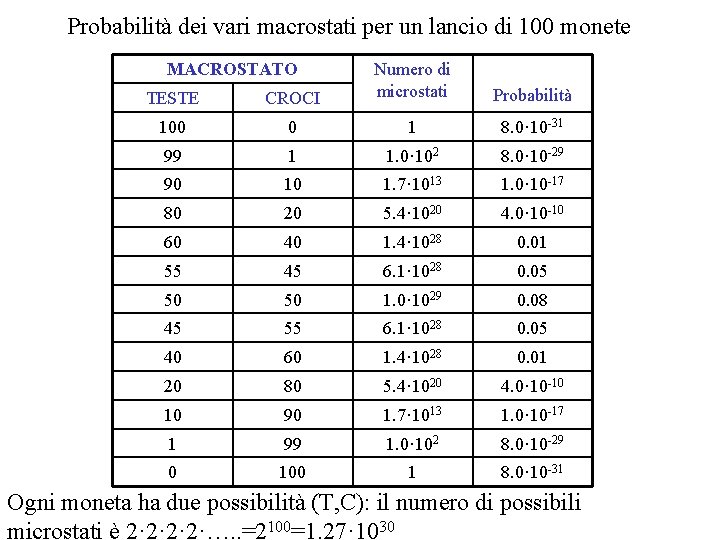
Probabilità dei vari macrostati per un lancio di 100 monete MACROSTATO TESTE CROCI Numero di microstati 100 0 1 8. 0· 10 -31 99 1 1. 0· 102 8. 0· 10 -29 90 10 1. 7· 1013 1. 0· 10 -17 80 20 5. 4· 1020 4. 0· 10 -10 60 40 1. 4· 1028 0. 01 55 45 6. 1· 1028 0. 05 50 50 1. 0· 1029 0. 08 45 55 6. 1· 1028 0. 05 40 60 1. 4· 1028 0. 01 20 80 5. 4· 1020 4. 0· 10 -10 10 90 1. 7· 1013 1. 0· 10 -17 1 99 1. 0· 102 8. 0· 10 -29 0 100 1 8. 0· 10 -31 Probabilità Ogni moneta ha due possibilità (T, C): il numero di possibili microstati è 2· 2·…. . =2100=1. 27· 1030

L’entropia in termini di probabilità Avvengono spontaneamente soltanto quei processi che sono i più probabili
 Equivalente meccanico della caloria relazione
Equivalente meccanico della caloria relazione Equivalente meccanico della caloria relazione
Equivalente meccanico della caloria relazione Primo principio della termodinamica
Primo principio della termodinamica L
L Leggi termodinamica
Leggi termodinamica 4 186 joule
4 186 joule I tre principi dell'io di fichte
I tre principi dell'io di fichte L'indicatore della situazione economica equivalente
L'indicatore della situazione economica equivalente Unidade caloria
Unidade caloria 1caloria
1caloria Principi fondamentali tecnici della pallavolo
Principi fondamentali tecnici della pallavolo Secondo principio della dinamica
Secondo principio della dinamica Principi fondamentali sicurezza sul lavoro
Principi fondamentali sicurezza sul lavoro I 3 principi della dinamica
I 3 principi della dinamica Statuto albertino e costituzione
Statuto albertino e costituzione Berkeley esse est percipi
Berkeley esse est percipi Principi fondamentali della costituzione mappa
Principi fondamentali della costituzione mappa Le tre leggi della dinamica
Le tre leggi della dinamica Principi della costituzione
Principi della costituzione Caratteristiche dello statuto albertino
Caratteristiche dello statuto albertino