CURSO DE REFRIGERACION Principios Fsicos Aplicados a la







- Slides: 19

CURSO DE REFRIGERACION Principios Físicos Aplicados a la Refrigeración Prof. CARLOS MARQUEZ Y PABLO BIANCHI 2013

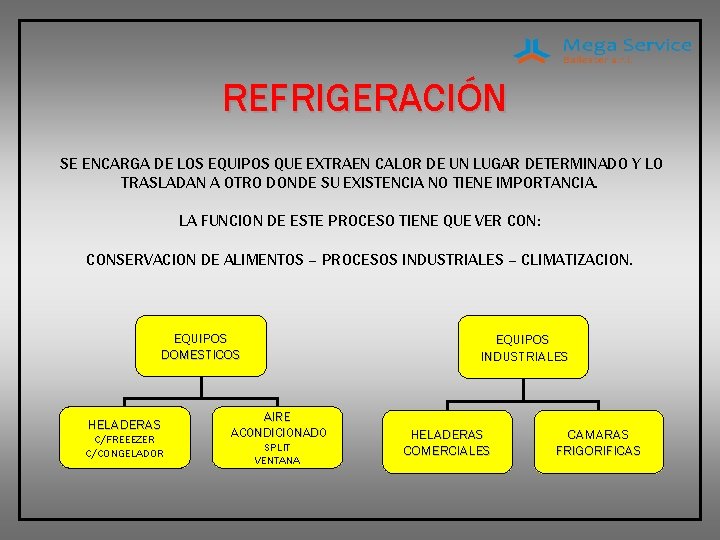
REFRIGERACIÓN SE ENCARGA DE LOS EQUIPOS QUE EXTRAEN CALOR DE UN LUGAR DETERMINADO Y LO TRASLADAN A OTRO DONDE SU EXISTENCIA NO TIENE IMPORTANCIA. LA FUNCION DE ESTE PROCESO TIENE QUE VER CON: CONSERVACION DE ALIMENTOS – PROCESOS INDUSTRIALES – CLIMATIZACION. EQUIPOS DOMESTICOS HELADERAS C/FREEEZER C/CONGELADOR EQUIPOS INDUSTRIALES AIRE ACONDICIONADO SPLIT VENTANA HELADERAS COMERCIALES CAMARAS FRIGORIFICAS

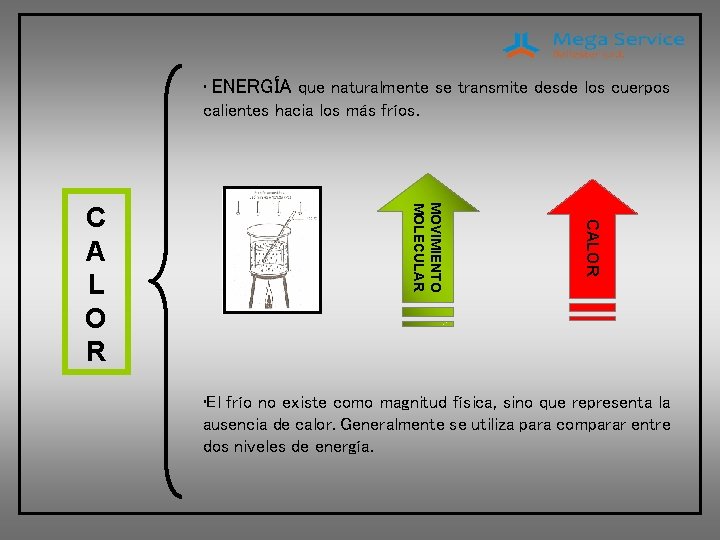
• ENERGÍA que naturalmente se transmite desde los cuerpos calientes hacia los más fríos. CALOR MOVIMIENTO MOLECULAR C A L O R • El frío no existe como magnitud física, sino que representa la ausencia de calor. Generalmente se utiliza para comparar entre dos niveles de energía.

PROCESO DE REFRIGERACIÓN tenemos que entenderlo como: UN PROCESO DE ABSORCIÓN DE CALOR NO COMO UN PROCESO DE PRODUCCIÓN DE FRÍO

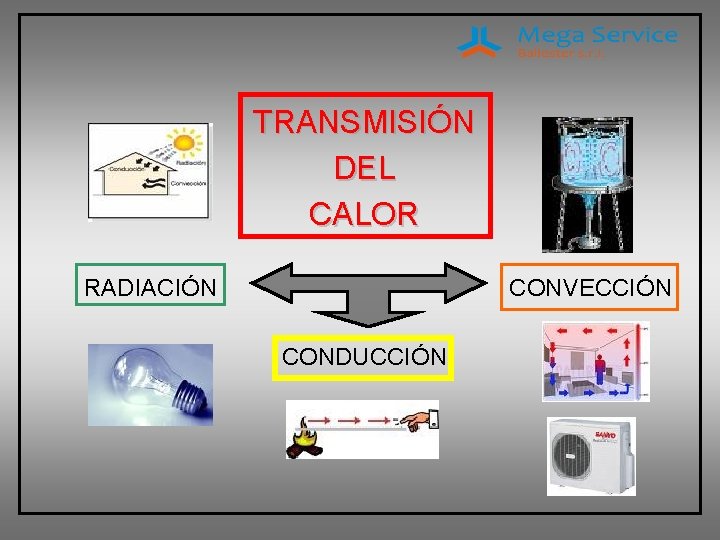
TRANSMISIÓN DEL CALOR RADIACIÓN CONVECCIÓN CONDUCCIÓN

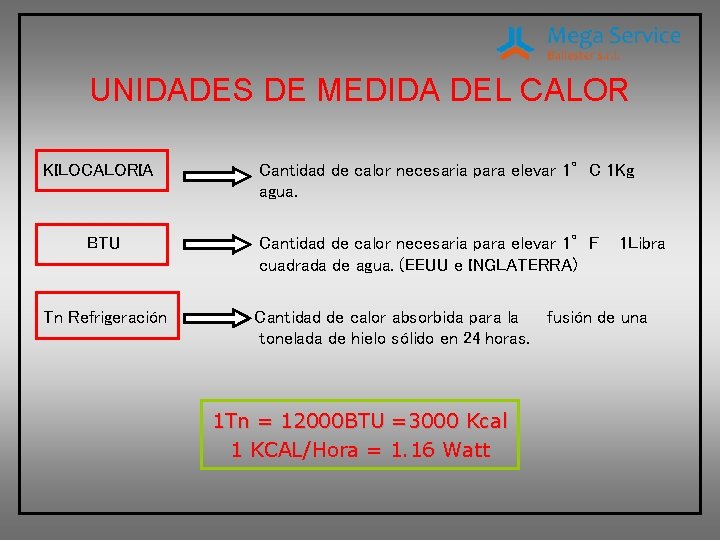
UNIDADES DE MEDIDA DEL CALOR KILOCALORIA BTU Tn Refrigeración Cantidad de calor necesaria para elevar 1°C 1 Kg agua. Cantidad de calor necesaria para elevar 1°F cuadrada de agua. (EEUU e INGLATERRA) 1 Libra Cantidad de calor absorbida para la fusión de una tonelada de hielo sólido en 24 horas. 1 Tn = 12000 BTU =3000 Kcal 1 KCAL/Hora = 1. 16 Watt

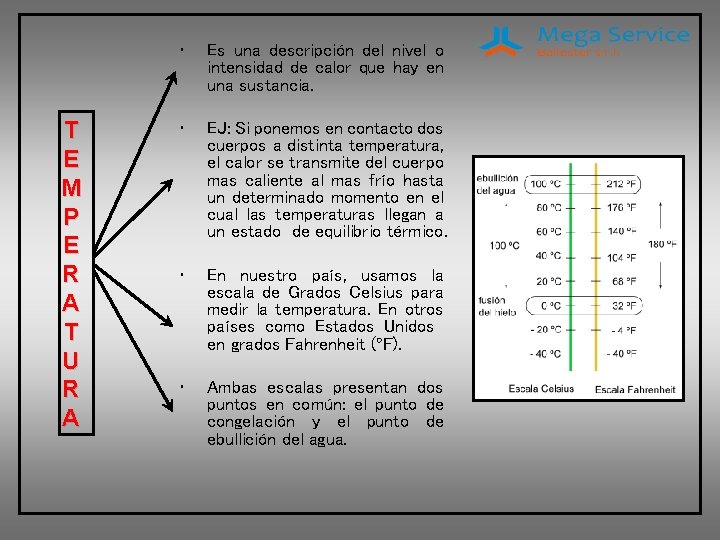
T E M P E R A T U R A • Es una descripción del nivel o intensidad de calor que hay en una sustancia. • EJ: Si ponemos en contacto dos cuerpos a distinta temperatura, el calor se transmite del cuerpo mas caliente al mas frío hasta un determinado momento en el cual las temperaturas llegan a un estado de equilibrio térmico. • En nuestro país, usamos la escala de Grados Celsius para medir la temperatura. En otros países como Estados Unidos en grados Fahrenheit (ºF). • Ambas escalas presentan dos puntos en común: el punto de congelación y el punto de ebullición del agua.

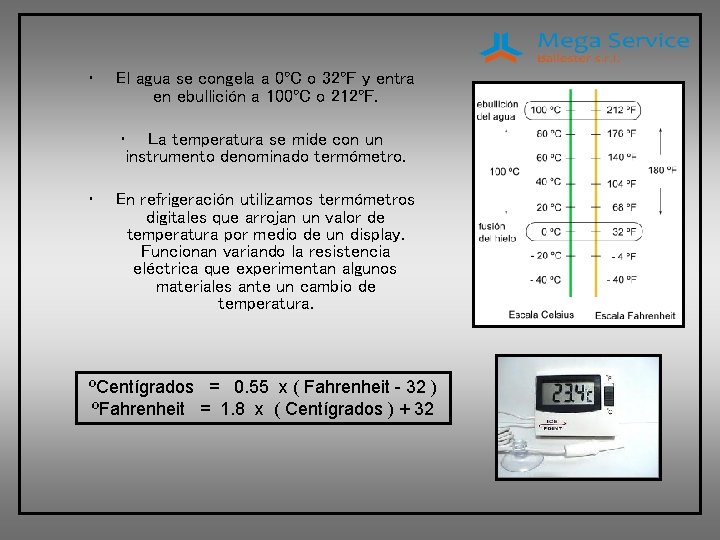
• El agua se congela a 0ºC o 32ºF y entra en ebullición a 100ºC o 212ºF. • • La temperatura se mide con un instrumento denominado termómetro. En refrigeración utilizamos termómetros digitales que arrojan un valor de temperatura por medio de un display. Funcionan variando la resistencia eléctrica que experimentan algunos materiales ante un cambio de temperatura. ºCentígrados = 0. 55 x ( Fahrenheit - 32 ) ºFahrenheit = 1. 8 x ( Centígrados ) + 32

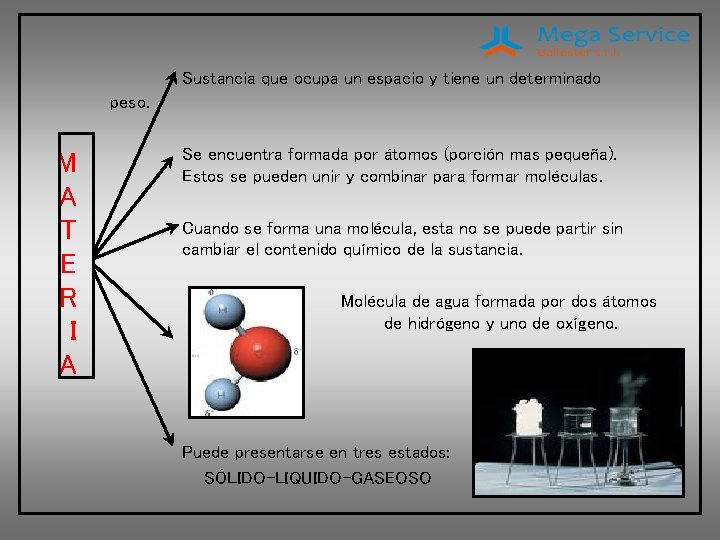
Sustancia que ocupa un espacio y tiene un determinado peso. M A T E R I A Se encuentra formada por átomos (porción mas pequeña). Estos se pueden unir y combinar para formar moléculas. Cuando se forma una molécula, esta no se puede partir sin cambiar el contenido químico de la sustancia. Molécula de agua formada por dos átomos de hidrógeno y uno de oxígeno. Puede presentarse en tres estados: SÓLIDO-LIQUIDO-GASEOSO

EFECTO DEL CALOR SOBRE EL ESTADO FÍSICO DE LA MATERIA (Cambio de estado) • El cambio de estado en un cuerpo o sustancia se produce cuando ocurre una variación energética. • La sustancia debe absorber o ceder calor.

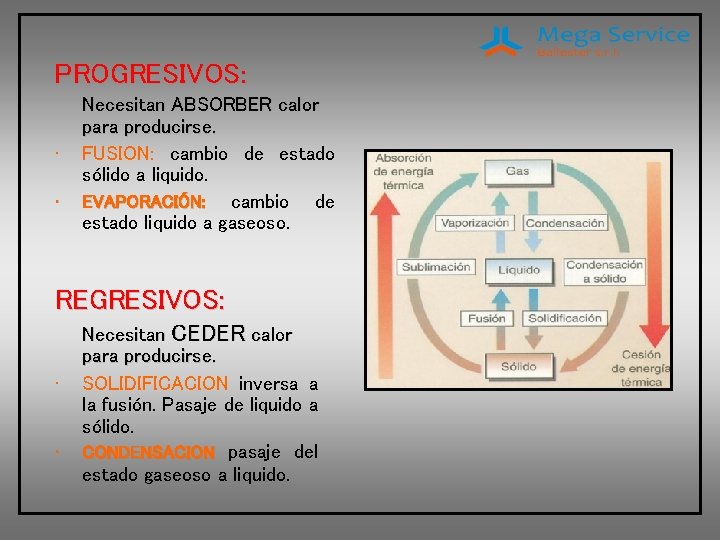
PROGRESIVOS: • • Necesitan ABSORBER calor para producirse. FUSION: cambio de estado sólido a liquido. EVAPORACIÓN: cambio de estado liquido a gaseoso. REGRESIVOS: • • Necesitan CEDER calor para producirse. SOLIDIFICACION inversa a la fusión. Pasaje de liquido a sólido. CONDENSACION pasaje del estado gaseoso a liquido.

CALOR SENSIBLE: • • • Puede ser apreciado por nuestro sentido al tacto. A medida que se agrega calor al sistema, los cambios de temperatura pueden ser registrados por los termómetros. No hay cambio de estado. CALOR LATENTE: • • • Es el calor que se utiliza para cambiar el estado. Existe pero no se expresa porque la temperatura es constante. Toda la energía absorbida por el sistema es utilizada para romper los enlaces Intermoleculares (no para variar la temperatura).

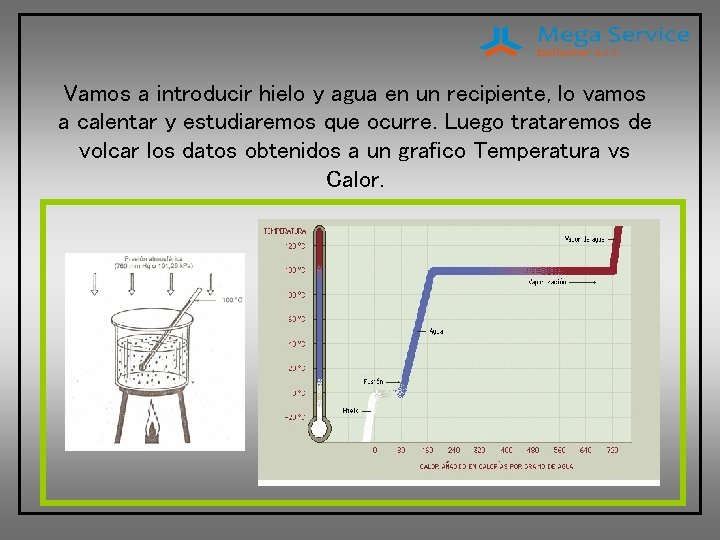
Vamos a introducir hielo y agua en un recipiente, lo vamos a calentar y estudiaremos que ocurre. Luego trataremos de volcar los datos obtenidos a un grafico Temperatura vs Calor.

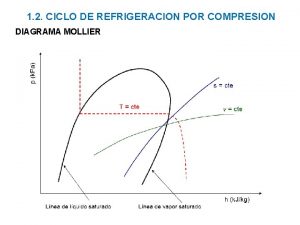
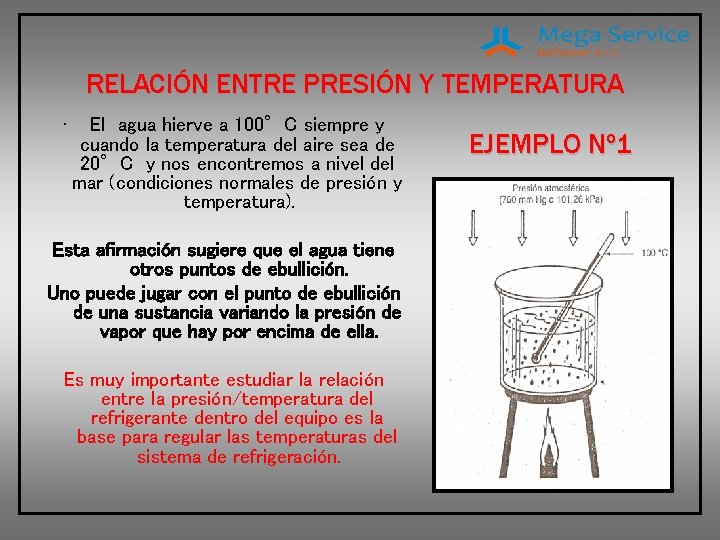
RELACIÓN ENTRE PRESIÓN Y TEMPERATURA • El agua hierve a 100°C siempre y cuando la temperatura del aire sea de 20°C y nos encontremos a nivel del mar (condiciones normales de presión y temperatura). Esta afirmación sugiere que el agua tiene otros puntos de ebullición. Uno puede jugar con el punto de ebullición de una sustancia variando la presión de vapor que hay por encima de ella. Es muy importante estudiar la relación entre la presión/temperatura del refrigerante dentro del equipo es la base para regular las temperaturas del sistema de refrigeración. EJEMPLO Nº 1

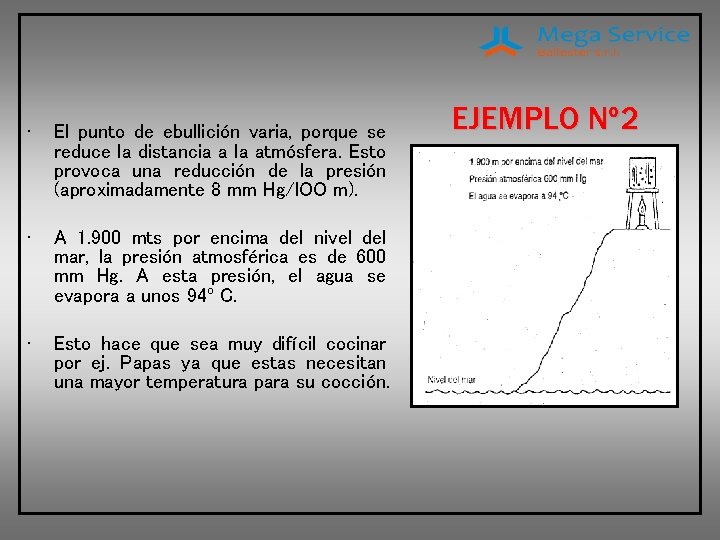
• El punto de ebullición varia, porque se reduce la distancia a la atmósfera. Esto provoca una reducción de la presión (aproximadamente 8 mm Hg/l. OO m). • A 1. 900 mts por encima del nivel del mar, la presión atmosférica es de 600 mm Hg. A esta presión, el agua se evapora a unos 94º C. • Esto hace que sea muy difícil cocinar por ej. Papas ya que estas necesitan una mayor temperatura para su cocción. EJEMPLO Nº 2

Si ahora ponemos las papas en una olla a presión y dejamos que la presión suba hasta unos 100 k. Pa por encima de la atmosférica (200 k. Pa). podremos observar como se eleva el punto de ebullición del agua a 120 °C. Estos ejemplos demuestran que cuando la presión se incrementa el punto de ebullición aumenta, y que, al reducir la presión, disminuye el punto de ebullición. EJEMPLO Nº 3

DEFINICION DE REFRIGERANTE • Se puede definir al refrigerante como el medio para transportar calor desde donde lo absorbe por evaporación, a baja temperatura y presión, hasta donde lo rechaza al condensarse a alta temperatura y presión. • Existen una gran variedad de refrigerantes dependiendo del rango de temperaturas a la que funcione cada equipo. • Se selecciona el refrigerante apropiado para cada aplicación. mas


• El refrigerante debe ser capaz dé sufrir los cambios de estado de manera repetida sin que sus características se vean alteradas. • La presión y la temperatura de un refrigerante se corresponderán con las de la tabla cuando haya presentes tanto líquido como vapor bajo dos condiciones. Cuando esté teniendo lugar el cambio de estado (Ebullición o condensación). Cuando el refrigerante esté en equilibrio (No se añade ni se elimina calor).
 Sugerencia que es
Sugerencia que es Conceptos basicos de refrigeracion
Conceptos basicos de refrigeracion Banco didáctico de refrigeración
Banco didáctico de refrigeración Compresion imagenes
Compresion imagenes Capex y opex ejemplos
Capex y opex ejemplos Sistema de refrigeración del motor
Sistema de refrigeración del motor Dibujos de refrigeracion
Dibujos de refrigeracion Curso intensivo de teologia do ministério ide
Curso intensivo de teologia do ministério ide Curso cerâmica e cozedura a lenha
Curso cerâmica e cozedura a lenha Nagios revenue
Nagios revenue Tareas que realiza el tesorero
Tareas que realiza el tesorero Curso realidad aumentada
Curso realidad aumentada Tipos de participantes en un curso
Tipos de participantes en un curso Senati reclamos
Senati reclamos Curso de ingenieria economica
Curso de ingenieria economica Curso de ingreso psicología unlp
Curso de ingreso psicología unlp Sinfo senati
Sinfo senati Qué es el enunciado oracional
Qué es el enunciado oracional Suela de labor
Suela de labor Identifica la idea principal del texto
Identifica la idea principal del texto