CLASSE DELLE LAUREE TRIENNALI DELLE PROFESSIONI SANITARIE TECNICHE















- Slides: 20

CLASSE DELLE LAUREE TRIENNALI DELLE PROFESSIONI SANITARIE TECNICHE GAS TERMODINAMICA üGAS PERFETTI E GAS REALI üTRASFORMAZIONI TERMODINAMICHE üTRASMISSIONE DEL CALORE A. A. 2019 - 2020 P. Montagna dic-21 Alessandro Lascialfari I fenomeni termici Fisica Medica – Lauree triennali nelle Professioni Sanitarie pag. 1

Gas perfetti Un gas si dice perfetto (o ideale) se: ha molecole puntiformi e’ trascurabile il volume proprio delle molecole subiscono urti elastici dopo l’urto le particelle rimangono sempre le stesse situazione analoga ai liquidi ideali (v. Teorema di Bernoulli), cioè si trascurano gli attriti. (il gas perfetto è il sistema termodinamico più semplice, caratterizzato solo dai 3 parametri termodinamici pressione, volume e temperatura) P. Montagna dic-21 I fenomeni termici Fisica Medica – Lauree triennali nelle Professioni Sanitarie pag. 2 2

Leggi dei gas perfetti Per i gas perfetti valgono 3 (+1) leggi sperimentali: 1) legge di Boyle: a t cost. , p. V = costante 2) 1 a legge di Gay-Lussac: a p cost. , Vt = V 0(1+ t) 3) 2 a legge di Gay-Lussac: a V cost. , pt = p 0(1+bt) con = b = 1 273° 4) legge di Avogadro: per due gas diversi, se p 1=p 2, V 1=V 2 e t 1=t 2, allora N 1=N 2 (cioè se hanno la stessa pressione, lo stesso volume e la stessa temperatura, allora hanno anche lo stesso numero di molecole) P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 3 3

Relazioni tra p, V, t a t cost. , p. V = costante Boyle p 1/V p. V = cost. a p cost. , Vt = V 0(1+ t) Gay-Lussac 1 V t V/t = cost. p t p/t = cost. a V cost. , pt = p 0(1+bt) Gay-Lussac 2 -> Le tre leggi dei gas perfetti stabiliscono proporzionalità “a due” tra i 3 parametri p, V, t. Combinando le diverse situazioni (cioè facendo variare successivamente tutti e 3 i parametri), si dimostra che vale la proporzionalità p. V t p. V/t = costante nota come P. Montagna dic-21 equazione di stato dei gas perfetti -> I fenomeni termici Fisica Medica – Lauree triennali nelle Professioni Sanitarie pag. 4 4

Equazione di stato dei gas perfetti condiz. iniziali p 0 V 0 t 0 DIMOSTRAZIONE trasf. a t costante condiz. intermedie p’ V t con p’ V = p 0 V 0 condiz. finali con p = p’ (1+ t) trasf. a V costante p V t Alla fine: equazione di stato dei gas perfetti P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 5 5

Temperatura assoluta Def. temperatura assoluta: (unità di misura: Kelvin) tenendo conto che 0 o. C = 273 K, l’equazione di stato diventa: Importante implicazione: da Vt = V 0(1+at) = V 0(1+t/273) segue: se t = -273 o. C = 0 K V = 0 se t < -273 o. C = 0 K V < 0 ->ASSURDO! P. Montagna dic-21 T = t (°C) + 273° p. V = p 0 V 0 T T 0 t = – 273°C = 0 K zero assoluto, limite in natura I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 6 6

Condizioni iniziali dei gas perfetti Legge di Avogadro: in qualunque gas perfetto a NTP = condizioni normali di temperatura e pressione (cioè p = 1 atm, t = 0°C) una mole di gas (cioè N = N 0 = 6. 022 • 1023 molecole) occupa sempre un volume V 0 = 22. 414 litri. P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 7 7

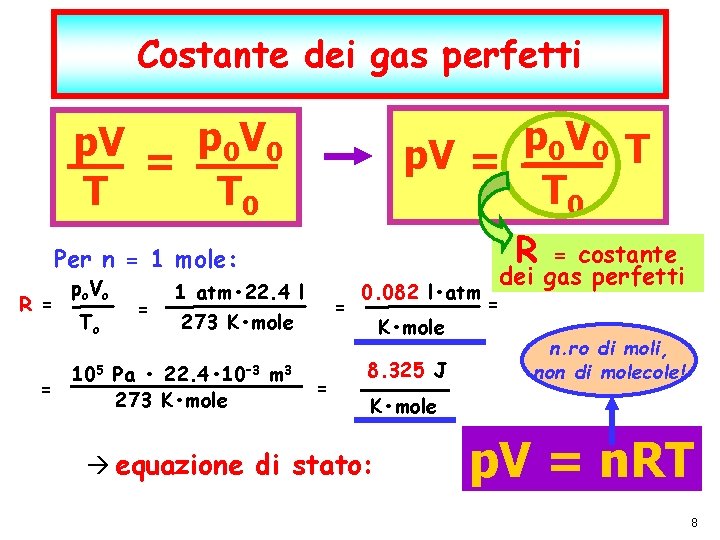
Costante dei gas perfetti p V 0 0 T p. V = T 0 p. V = p 0 V 0 T T 0 R Per n = 1 mole: R = po Vo To = 1 atm • 22. 4 l 273 K • mole 105 Pa • 22. 4 • 10– 3 m 3 = 273 K • mole = = 0. 082 l • atm K • mole 8. 325 J = n. ro di moli, non di molecole! K • mole equazione di stato: P. Montagna dic-21 = costante dei gas perfetti p. V = n. RT I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 8 8

Equazione di stato dei gas perfetti p. V = n. RT T = t (°C) + 273° R =( po Vo To = pressione, V=volume, n=numero di moli (non molecole!), T=temperatura assoluta e R=costante dei gas perfetti 1 atm • 22. 4 l 273 K • mole 105 Pa • 22. 4 • 10– 3 m 3 =( 273 K • mole )= )= 0. 082 l • atm K • mole = 8. 325 J K • mole 1 mole = 6. 022 • 1023 molecole (n. ro di Avogadro NA) P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 9 9

Gas reali Un gas si dice reale se non è perfetto: ha molecole non puntiformi non è trascurabile il volume proprio delle molecole subiscono anche urti non elastici dopo l’urto le particelle possono non rimanere sempre le stesse Un gas reale può condensare (-> liquido) e solidificare (-> solido). Tc = temperatura critica Per T > Tc il gas non può passare alla fase liquida, a causa dell’agitazione termica. P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 10 10

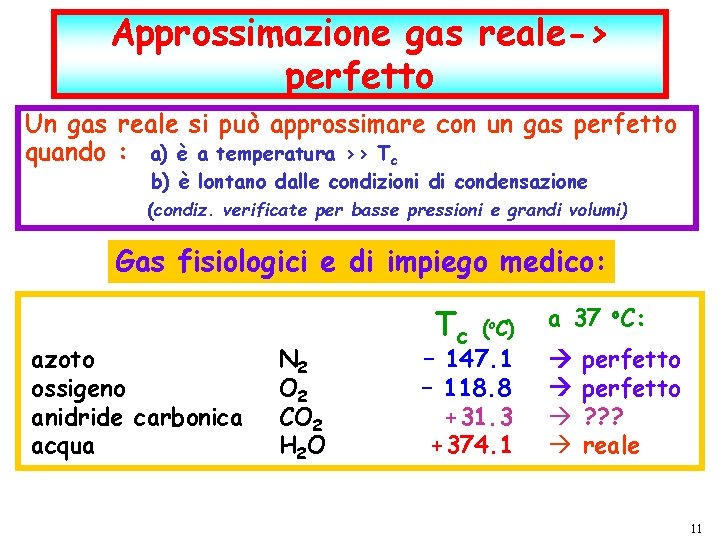
Approssimazione gas reale-> perfetto Un gas reale si può approssimare con un gas perfetto quando : a) è a temperatura >> Tc b) è lontano dalle condizioni di condensazione (condiz. verificate per basse pressioni e grandi volumi) Gas fisiologici e di impiego medico: azoto ossigeno anidride carbonica acqua P. Montagna dic-21 N 2 O 2 CO 2 H 2 O Tc (o. C) – 147. 1 – 118. 8 +31. 3 +374. 1 a 37 o. C: I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie perfetto ? ? ? reale pag. 11 11

Trasformazioni termodinamiche E’ impossibile “seguire” il moto di agitazione termica di un numero di particelle così elevato (~NA=6. 022 • 1023) descrizione fenomenologica descrizione statistica SISTEMA TERMODINAMICO: (insieme di particelle con uguali proprietà termodinamiche) isolato: non scambia né materia né energia con l’esterno chiuso: non scambia materia ma scambia energia con l’esterno aperto : scambia materia e energia con l’esterno TRASFORMAZIONI TERMODINAMICHE: pressione costante isobara volume costante isocora temperatura costante isoterma Q= 0 adiabatica P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 12 12

1 o principio della Termodinamica È la conservazione dell’energia per i fenomeni termici: il calore fornito (o sottratto) va in parte in variazione di energia interna ( variaz. di temperatura), in parte in lavoro compiuto dal sistema (o sul sistema) Q = DEint - L Quantità di calore Variazione di energia interna Lavoro compiuto L<0 dal sistema DEint>0 aumento di temp. . (espansione) Q>0 calore fornito DEint<0 diminuzione L>0 sul sistema Q<0 calore sottratto di temperatura (compressione) P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 13 13

2 o principio della Termodinamica In natura, non tutte le trasformazioni ammesse dal 1° principio avvengono spontaneamente: è sempre possibile trasformare tutto il lavoro in calore (es. : arresto di una macchina mediante freni per attrito) MA è impossibile trasformare tutto il calore in lavoro utilizzando una sola sorgente di calore (per farlo, servono almeno due sorgenti) Il calore non può passare Enunciato da un corpo più freddo a uno più caldo equivalente: spontaneamente, cioè senza compiere lavoro dall’esterno P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 14 14

L’energia nelle macchine termiche “Macchina” = ogni dispositivo che sfrutta una forma di energia per produrre lavoro, o in generale un’altra forma di energia In teoria, tutte le macchine potrebbero avere rendimento h = 100 %, tranne quelle che trasformano il calore in lavoro (lo impedisce il 2 o principio della Termodinamica) Es. Cascata: energia potenziale energia elettrica lavoro meccanico hteor=100% Pila: energia elettrica lavoro meccanico hteor=100% Sistemi biologici (corpo umano): energia chimica calore lavoro meccanico + altro calore h<100% P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 15 15

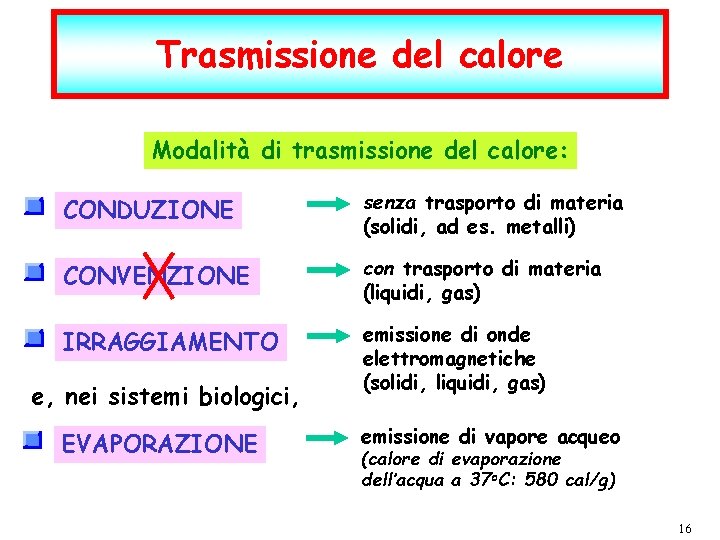
Trasmissione del calore Modalità di trasmissione del calore: CONDUZIONE senza trasporto di materia (solidi, ad es. metalli) CONVENZIONE con trasporto di materia (liquidi, gas) IRRAGGIAMENTO emissione di onde elettromagnetiche (solidi, liquidi, gas) e, nei sistemi biologici, EVAPORAZIONE P. Montagna dic-21 emissione di vapore acqueo (calore di evaporazione dell’acqua a 37 o. C: 580 cal/g) I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 16 16

Conduzione e convezione Conduzione senza trasporto di materia Convezione con trasporto di materia Quantità di calore trasmessa nell’unità di tempo: 1)convezione: Q/Dt (cal/s) S • DT dir. prop. alla superficie e alla variaz. di temperatura 2) conduzione: Q/Dt (cal/s) S • DT/d dir. prop. alla superficie e alla variaz. di temperatura, e inv. prop. alla distanza Dipende dalla conducibilità termica K [kcal/(m • s • o. C)], che è diversa per ogni sostanza: conduttori termici (K “grande”) , ad es. metalli (K~10 -2), acqua (K~10 -4) isolanti termici (K “piccolo”), ad es. legno (K~10 -5), polistirolo (K~10 -5), aria (K~10 -6)… P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 17 17

Irraggiamento termico ogni corpo emette radiazione termica (=onde elettromagnetiche), dipendentemente dalla sua temperatura assoluta T intensità = quantità di radiazione tempo • superficie I = Q/(Dt • DS) W/m 2 Leggi dell’emissione termica: I T 4 (temperatura assoluta!) legge di Stefan-Boltzmann lunghezza d’onda massima: l 1/T legge di Wien Radiazione emessa dal corpo umano con febbre a 40 o C (rispetto a 37 o. C): Es. I 40/I 37 = T 440(T 437) = [(273+40)/(273+37)]4 = (313/310)4 = 1. 0393 (3. 93 % in più) P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 18 18

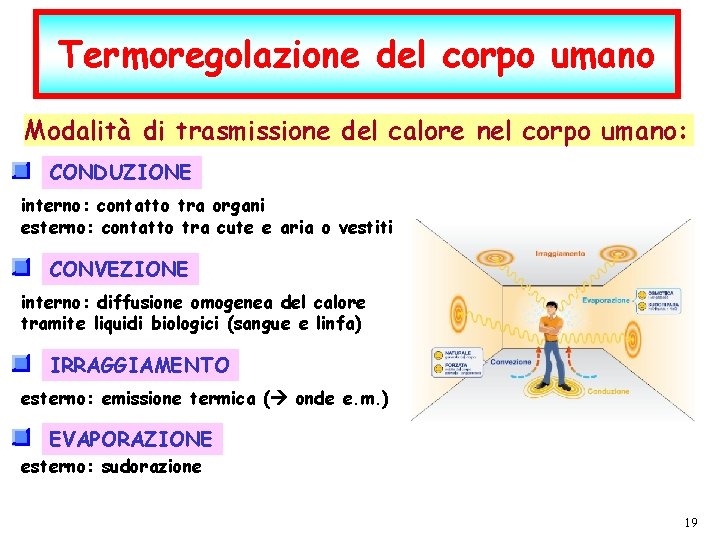
Termoregolazione del corpo umano Modalità di trasmissione del calore nel corpo umano: CONDUZIONE interno: contatto tra organi esterno: contatto tra cute e aria o vestiti CONVEZIONE interno: diffusione omogenea del calore tramite liquidi biologici (sangue e linfa) IRRAGGIAMENTO esterno: emissione termica ( onde e. m. ) EVAPORAZIONE esterno: sudorazione P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 19 19

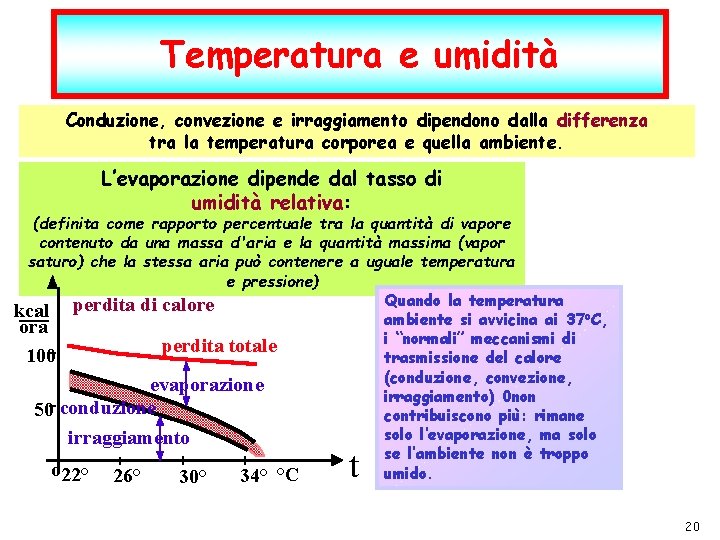
Temperatura e umidità Conduzione, convezione e irraggiamento dipendono dalla differenza tra la temperatura corporea e quella ambiente. L’evaporazione dipende dal tasso di umidità relativa: (definita come rapporto percentuale tra la quantità di vapore contenuto da una massa d'aria e la quantità massima (vapor saturo) che la stessa aria può contenere a uguale temperatura e pressione) Quando la temperatura kcal perdita di calore ambiente si avvicina ai 37 o. C, ora i “normali” meccanismi di perdita totale 100 trasmissione del calore (conduzione, convezione, evaporazione irraggiamento) 0 non 50 conduzione contribuiscono più: rimane solo l’evaporazione, ma solo irraggiamento se l’ambiente non è troppo o 22° 26° umido. 34° °C 30° t P. Montagna dic-21 I fenomeni termici F. Fisica Ballarini – Fisica Applicata Medica – Lauree triennali nelle Professioni Sanitarie pag. 20 20
 Breastfeeding assessment score
Breastfeeding assessment score Carta delle professioni museali
Carta delle professioni museali Professioni museali
Professioni museali Ingegneria gestionale parthenope
Ingegneria gestionale parthenope Moodle logopedia unipd
Moodle logopedia unipd Professioni isfol
Professioni isfol Classe en soi et classe pour soi
Classe en soi et classe pour soi Comment analyser la structure sociale
Comment analyser la structure sociale Classe en soi et classe pour soi
Classe en soi et classe pour soi Le fiabe e i diritti dei bambini
Le fiabe e i diritti dei bambini L'esperienza delle cose moderne e la lezione delle antique
L'esperienza delle cose moderne e la lezione delle antique La lezione delle antique cose
La lezione delle antique cose La nascita delle lingue e delle letterature romanze
La nascita delle lingue e delle letterature romanze Metodi e tecniche del servizio sociale slide
Metodi e tecniche del servizio sociale slide Cos'è lo schema narrativo
Cos'è lo schema narrativo Tecniche analitiche di laboratorio
Tecniche analitiche di laboratorio Sezioni di solidi con piani inclinati
Sezioni di solidi con piani inclinati Foundation subjects traduzione
Foundation subjects traduzione Testo narrativo: schema
Testo narrativo: schema Tecniche di conduzione dei gruppi slide
Tecniche di conduzione dei gruppi slide Migi jodan
Migi jodan