CLASIFICACIN DE MINERALES Elementos nativos Sulfuros xidos Hidrxidos






















- Slides: 25

CLASIFICACIÓN DE MINERALES § § § § Elementos nativos Sulfuros Óxidos -Hidróxidos Haluros Carbonatos Nitratos Boratos Fosfatos § Wolframatos § Silicatos

LOS ELEMENTOS NATIVOS METALES 1 -GRUPO DEL ORO SEMIMETALES 1 -GRUPO DEL ARSÉNICO ORO PLATA COBRE ARSÉNICO BISMUTO Au Ag Cu As Bi 2 -GRUPO DEL PLATINO Pt NO METALES 3 -GRUPO DEL HIERRO Fe (KARMACITA Fe-Ni) (TAENITA Fe-Ni) AZUFRE DIAMANTE GRAFITO S C C

PROPIEDADES DE LOS METALES NATIVOS § Dúctiles, maleables, séctiles, blandos § Buenos conductores del calor y la electricidad § Brillo metálico § Fractura astillosa § Puntos de fusión más bien bajos, densidades elevadas § Cristalizan en el sistema cúbico, con redes cúbicas centrada en las caras con átomos idénticos de coordinación 12


ORO-Au CRISTALOGRAFÍA: Cúbico o Isométrico PROPIEDADES FÍSICAS: H=2 ½ -3 G=19. 3 Fractura: irregular Color: varias tonalidades de amarillo Raya: amarilla Brillo: metálico Otros: Muy maleable y dúctil COMPOSICIÓN Y ESTRUCTURA: La mayor parte del oro contiene plata. La estructura del oro está basada en el empaquetamiento cúbico compacto de los átomos de Au FORMA DE PRESENTARSE: La forma más común es en masas arborescentes, con cristales alargados, también diseminado en capas aplastadas, escamoso o macizo. La forma más frecuente en placeres es la llamada “pepita”. DIAGNÓSTICO: El oro se distingue de otros sulfuros amarillos por su sectilidad y gran peso específico. YACIMIENTOS: Sudáfrica, Comunidad de Estados Independientes (CIS), China, Canadá, Estados Unidos y Brasil EMPLEO: Se utiliza como garantía de pagos internacionales (lingotes), como inversión, joyería, instrumentos científicos, prótesis dentales. ETIMOLOGÍA: Deriva de la palabra latina “aurus”

PLATA-Ag CRISTALOGRAFÍA: Isométrico PROPIEDADES FÍSICAS: H= 2 ½ -3 G= 10. 5 Fractura: astillosa Brillo: metálico Color y Raya: blanco de plata Otros: Maleable y dúctil COMPOSICIÓN Y ESTRUCTURA: La plata nativa contiene frecuentemente mercurio, cobre y oro en aleación. La amalgama es una solución sólida de plata y mercurio. La estructura de la plata está basada en un empaquetamiento cúbico compacto de átomos de Ag. FORMA DE PRESENTARSE: Comúnmente se da en cristales mal formados y en grupos ramosos, arborescentes y reticulados. Masas irregulares, placas y escamas. DIAGNÓSTICO: Naturaleza maleable, su color de superficie fresca y su alto peso específico. YACIMIENTOS: Noruega, Canadá, Perú, España, México y los Estados Unidos. EMPLEO: Emulsiones fotográficas, plateado, aleaciones con cobre, cubiertos de mesa y equipos electrónicos. Como mena de plata aunque la mayor parte de la producción mundial proviene de otros minerales (acantita, proustita, pirargirita)

COBRE-Cu CRISTALOGRAFÍA: Isométrico PROPIEDADES FÍSICAS: H=2 ½ -3 G=8. 9 Fractura: astillosa Brillo: metálico Color: rojo cobre Raya: roja Otros: Muy dúctil y maleable COMPOSICIÓN Y ESTRUCTURA: El cobre nativo contiene generalmente pequeñas cantidades de plata, bismuto, mercurio, arsénico y antimonio. La estructura del cobre está basada en el empaquetamiento cúbico compacto de los átomos de Cu. FORMA DE PRESENTARSE: Los cristales aparecen normalmente mal formados y en ramas o grupos arborescentes. Generalmente se da en masas, placas y escamas irregulares, en formas torcidas y en alambre. DIAGNÓSTICO: El cobre nativo puede reconocerse por su color rojo en superficie reciente, su fractura astillosa, su gran peso específico y su maleabilidad. . YACIMIENTOS: Los depósitos de cobre nativo más importantes en el mundo se hallan en la Península de Keweenaw, Michigan. También en Estados Unidos y Bolivia. EMPLEO: Los sulfuros de cobre son la principal mena del metal. Usos eléctricos, cables, aleaciones como bronce. ETIMOLOGÍA: de cuprus (Siria), donde se encontró por primera vez.

PLATINO-Pt CRISTALOGRAFÍA: Isométrica PROPIEDADES FÍSICAS: H=4 -4 ½ G=21. 45 puro Color: gris de acero Brillo: reluciente Raya: gris Otros: es magnético cuando es rico en hierro. Maleable y dúctil COMPOSICIÓN Y ESTRUCTURA: contiene normalmente en aleación diversos porcentajes de Fe y pequeñas cantidades de Ir, Os, Rh, Pd, tb Cu, Au y Ni. La estructura del platino está basada en un empaquetamiento cúbico compacto de átomos de Pt. FORMA DE PRESENTARSE: Los cristales cúbicos normalmente están deformados. Se encuentra por lo general en granos y escamas, en masas irregulares y pepitas de gran tamaño. DIAGNÓSTICO: Queda determinado por su alto peso específico, su maleabilidad y su color acerado. YACIMIENTOS: Colombia, Canadá, Sudáfrica, CIS, Estados Unidos. EMPLEO: Como catalizador para controlar las emisiones de escape de los automóviles y las industrias químicas y de petróleo. También lo usan odontólogos, en joyería. ETIMOLOGÍA: Recibió su nombre por su parecido con la plata con la que inicialmente se confundió.

HIERRO-Fe CRISTALOGRAFÍA: Isométrico PROPIEDADES FÍSICAS: H= 4 ½ G= 7. 3 a 7. 9 Fractura: astillosa Color: Gris acerado a negro Brillo: metálico Otros: Magnético y Maleable COMPOSICIÓN Y ESTRUCTURA: siempre con algo de níquel y pequeñas cantidades de Co, Cu, Mn, S, C. La kamacita tiene un 5. 5 % de Ni. La taenita varía su % en Ni. FORMA DE PRESENTARSE: cristales raros. Terrestre: en nódulos y masas grandes, meteórico: en placas grandes y masas laminares, y en regular intercrecimiento con ferroníquel (taenita) DIAGNÓSTICO: Puede reconocerse por su fuerte magnetismo, su maleabilidad y la pátina de óxido que cubre su superficie. GÉNESIS: Aparece como hierro terrestre y en meteoritos. El hierro está normalmente presente como Fe 2+ o Fe 3+ en magnetita o hidróxidos como la goethita (Fe. O. OH). YACIMIENTOS: Groenlandia, Oregón.

SEMIMETALES NATIVOS: As Sb Bi • Hexagonal • Fácil exfoliación debido al débil enlace entre las capas paralelas. • Son quebradizos y conducen el calor y la electricidad mucho peor que los metales nativos. • Estas propiedades reflejan un tipo de enlace intermedio entre el metálico y el covalente. • El arsénico y el bismuto nativos son poco comunes como minerales. • Empleo: El bismuto se utiliza en aleaciones para fusibles eléctricos y tapones de seguridad.

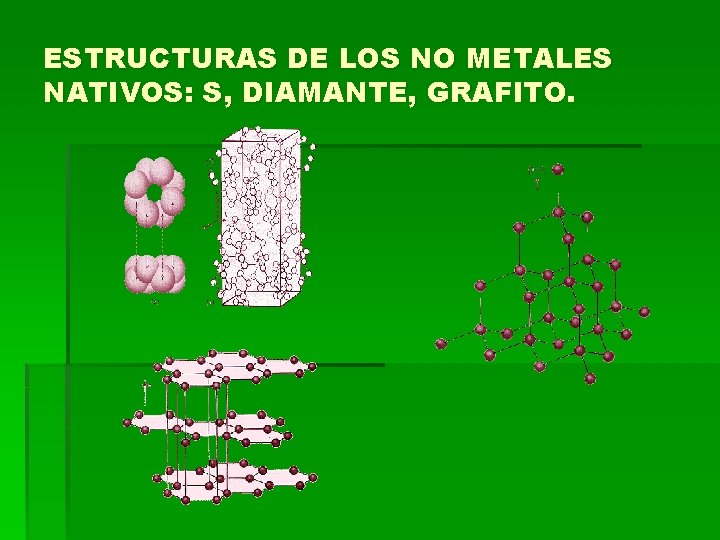
NO METALES NATIVOS AZUFRE CRISTALOGRAFÍA: PROPIEDADES FISICAS: H= 1. 5 -2. 5 G=2. 07 Color: Amarillo Raya: Más clara Brillo: Graso o sedoso Fractura: concoidea Otros: arde con facilidad COMPOSICIÓN Y ESTRUCTURA: Azufre puro pero puede contener varias partes de selenio. La celda unitaria de la forma ortorrómbica contiene 128 átomos de S. GÉNESIS: En terrenos con actividad volcánica, como producto de sublimación. Filoniano, asociado a sulfuros y formado por la oxidación de estos. YACIMIENTOS: Cádiz, Islas Canarias EMPLEO: Como abono e insecticida; para la fabricación de ácido sulfúrico y de caucho. También se usa en producción de jabón, textiles, papel, piel, tintes y en refinado de petróleo. ETIMOLOGÍA: Del latín "sulphur", nombre del mineral.

ESTRUCTURAS DE LOS NO METALES NATIVOS: S, DIAMANTE, GRAFITO.

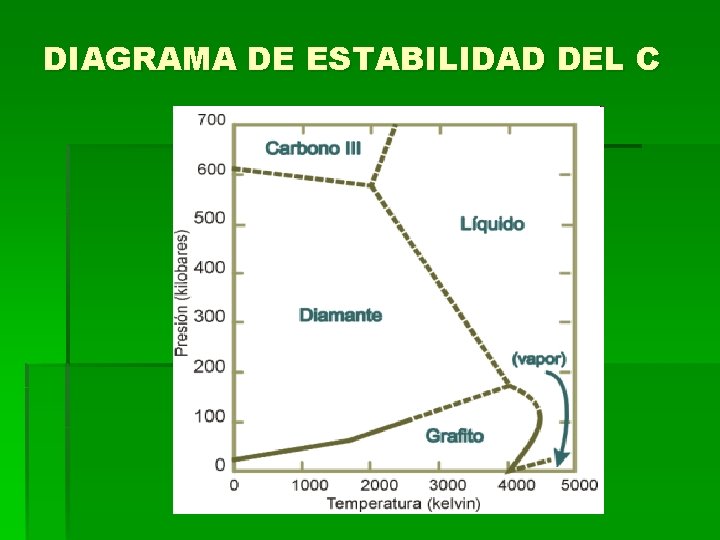
DIAMANTE CRISTALOGRAFÍA: Cúbico holoédrico Grupo espacial: Fm 3 ma = 3. 567 Å; Z = 8. PROPIEDADES FÍSICAS: H= 10 G= 3. 515 Color: Habitualmente amarillo claro o incoloro, también tonalidades claras azules, verdes, naranjas, rosas, marrones (negro para la variedad Carbonado) Raya: Es imposible hacerla Brillo: Adamantino o graso. Otros: Transparente a los rayos ultravioletas. COMPOSICIÓN Y ESTRUCTURA: Es carbono puro aunque puede contener escasas cantidades de N y B. La estructura del diamante muestra un empaquetamiento mucho más compacto que la del grafito fruto de su estabilidad a más alta presión. FORMA DE PRESENTARSE: Habitualmente en cristales de hábito octaédrico, pero también forma cubos y dodecaedros, presentando curvaturas en las caras. DIAGNÓSTICO: Se distingue por su gran dureza, su brillo adamantino y su exfoliación. YACIMIENTOS: África, Norteamérica, China, Venezuela, Australia, India y Siberia. La roca donde aparecen de denomina kimberlita. La variedad carbonada se encuentra en Brasil. EMPLEO: Es la gema más importante. En la industria se emplea para cortar vidrio, el polvo fino se emplea para triturar y pulir diamantes y otras gemas. ETIMOLOGÍA: Del griego "adamas" que significa invencible.

GRAFITO CRISTALOGRAFÍA: Hexagonal PROPIEDADES FÍSICAS: H= 1 -2 G=2. 23 Brillo: metálico Color: negro Raya: negra Otros: tacto es graso con hojas flexibles pero no elásticas. Exfoliación perfecta ( 0001 ) COMPOSICIÓN Y ESTRUCTURA: Carbono. FORMA DE PRESENTARSE: Aparece normalmente en masas hojosas o escamosas, pero puede ser radiado o granular. DIAGNÓSTICO: Se reconoce por su color, su naturaleza hojosa y su tacto graso. . YACIMIENTOS: México, Groenlandia, China, CIS, Corea del Norte, Corea del Sur, India. EMPLEO: Se emplea en la fabricación de crisoles refractarios para las industrias de acero, latón y bronce. Se emplea mucho como lubricante, mezclado con aceite. Mezclado con arcilla fina, forma la mina de los lápices. ETIMOLOGÍA: Derivado de la palabra griega que significa escribir, como alusión a su empleo en los lápices.

DIAGRAMA DE ESTABILIDAD DEL C

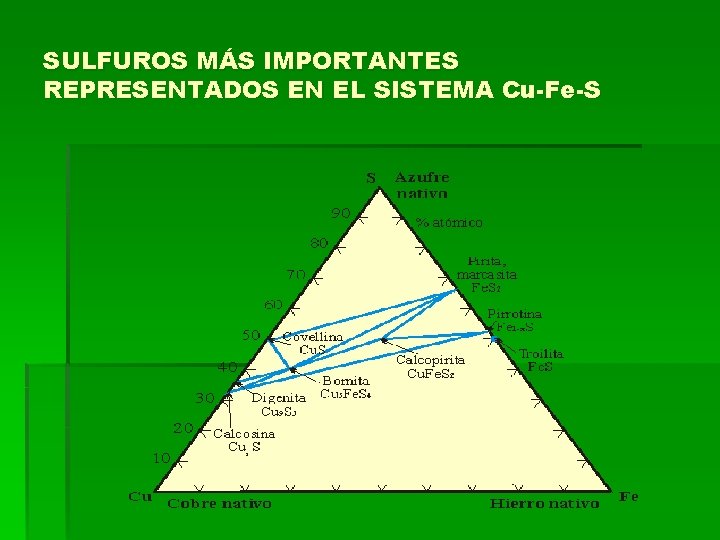
SULFUROS § Los sulfuros incluyen también los sulfoarseniuros, arseniuros y telururos. § La mayoría son opacos y tienen colores distintivos y huellas características. Algunos transmiten la luz en los bordes. Brillo metálico. § La fórmula general de los sulfuros es Xm. Zn donde X=elementos metálicos y Z=elemento no metálico (S, Te, Se, As, Sb) § El número de especies que forman esta clase es superior a 300, aunque tan sólo 30 pueden considerarse importantes, por encontrarse en grandes cantidades y estar más o menos difundidos. § Densidades elevadas (hasta 9). § Elevados índices de refracción. § Gran conductividad calorífica y eléctrica § El tipo de enlace que presentan estos compuestos es, sobre todo covalente, aunque muchos de ellos poseen un marcado carácter metálico (algunos son casi aleaciones), también existen sulfuros con un cierto carácter iónico. § Entre los sulfuros importantes y que están considerados como menas metálicas, se mencionan los siguientes: esfalerita, calcopirita, marcasita y covelina.

SULFUROS MÁS IMPORTANTES REPRESENTADOS EN EL SISTEMA Cu-Fe-S

ESFALERITA-Zn. S § § § § § Isométrico Los cristales son frecuentemente mal formados, suelen ser maclas polisintéticas Exfoliación perfecta (011). Brillo no metálico y resinoso. Incolora cuando es pura y verde cuando es casi pura. Huella blanca a amarillo y castaño. Composición: Zn 67%, S 33% cuando es pura. La estructura de la esfalerita es similar al diamante con la mitad de los átomos de C reemplazados por Zn y la otra mitad por S. La esfalerita se considera como el polimorfo cúbico a baja Tº del Zn. S y la wurtzita como el polimorfo de alta Tº, estable por encima de 1020ºC a 1 atmósfera de presión. El polimorfo wurtzita con átomos de Zn en empaquetamiento hexagonal compacto. La blenda puede reconocerse por su brillo resinoso brillante y su exfoliación perfecta. Es la mena más importante del Zn, es un mineral extremadamente corriente. Los países productores más importantes: Canadá, CIS, EE. UU, Australia, Perú, México, España y Japón. El uso principal es la galvanización del hierro, la obtención de latón, una aleación de cobre y zinc, las baterías eléctricas y se emplea como planchas de Zn.

CALCOPIRITA-Cu. Fe. S 2 § § § § Tetragonal 42 m. Tetraédrico por la presencia de caras diesfenodales p (112) dominantes. Brillo metálico. Color amarillo de latón, con pátina bronceada o iridiscente. Huella negra verdosa. Frágil. Composición: Cu 34. 6% Fe 30. 4% S 35. 0%. Su estructura puede considerarse como un derivado de la esfalerita, en la cual la mitad del Zn es sustituido por Cu y la otra mitad por Fe. Esto se conduce a la duplicación de la celda unitaria. Se reconoce por su color amarillo de latón, huella negra verdosa. La calcopirita es el mineral de Cu más corriente y una de las fuentes más importantes de este metal. La mayor parte de las menas de sulfuros poseen calcopirita, pero los filones más importantes económicamente son los hidrotérmicos y los depósitos de reemplazamiento. Es muy frecuente en los Estados Unidos. La calcopirita se altera frecuentemente transformándose en malaquita, covelina. Es la mena más importante de cobre.

PIRITA-Fe. S 2 § § § § § Isométrico 2/m 3. Generalmente aparece en cristales. Las formas más corrientes son el cubo, cuyas caras están normalmente rayadas con estrías. Fractura concoide. Frágil. H=6 -6 ½ G= 5. 02 Brillo metálico, resplandeciente. Color amarillo latón pálido, puede ser oscuro debido a la pátina. Huella verdosa o pardonegra. Opaco. Paramagnético. Composición: Fe 46. 6% S 53. 4%. La pirita tiene estructura tipo Na. Cl modificada, con el Fe ocupando la posición del Na y con grupos S 2 ocupando la posición del Cl. El Fe. S 2 se presenta en dos polimorfos, pirita y marcasita. Se distingue de la calcopirita por su color más pálido y mayor dureza y de la marcasita por su color más intenso y la forma de los cristales. La marcasita tiene cristales corrientemente tabulares, se dan maclas con la formación de cresta de gallo o punta de espada. La pirita se altera fácilmente a óxidos de hierro, normalmente limonita. Sin embargo es mucho más estable que la marcasita. Las rocas que contienen pirita no pueden usarse en arquitectura, puesto que la rápida oxidación serviría tanto para desintegrarla como para mancharla de óxido de hierro. La pirita es el sulfuro más corriente y extendido. Se forma tanto en alta como en baja Tº. Se utiliza para suministrar azufre para la producción de ácido sulfúrico y caparrosa.

ÓXIDOS § § Los minerales de óxidos comprenden aquellos compuestos naturales en los cuales el oxígeno aparece combinado con uno o más metales. Hay óxidos simples con relaciones diferentes de X: O y óxidos múltiples XY 2 O 4, que tienen 2 posiciones con átomos metálicos diferentes. El tipo de enlace en las estructuras de óxidos es por lo general fuertemente iónico, en contraste con la estructura de los sulfuros con enlaces iónicos, covalentes y metálicos. Tipo X 2 O y XO Cuprita-Cu 2 O Cincita-Cu. O Tipo X 2 O 3 Grupo de los hematites: corindón-Al 2 O 3, hematites-Fe 2 O 3, ilmenita-Fe. Ti. O 3 Tipo XY 2 O 4 Grupo de la espinela: espinela-Mg. Al 2 O 4, Ghanita-Zn. Al 2 O 4, magnetita-Fe 3 O 4 Tipo XO 2 Grupo del rutilo: rutilo-Ti. O 2, pirolusita. Mn. O 2, casilerita-Sn. O 2

CUPRITA-Cu 2 O § § § Isométrico 4/m 32/m. Se da en forma de cristales cúbicos, octaédricos y dodecaédricos, como cristales cúbicos alargados conocidos como calcotriquita. H=3 ½ -4 G=6. 1 Brillo metálico adamantino en las variedades cristalizadas claras. Color rojo en varios tonos. Huella rojo castaño. Composición: Cu 88. 8% O 11. 2%. La estructura está basada en átomos de Cu en los vértices y centros de grupos tetraédricos. Se distingue de los otros minerales rojos por la forma de sus cristales, fuerte brillo, huella. La cuprita es una mena importante del cobre. Países notables por ser ellos la cuprita una mena son Chile, Bolivia, Australia y Zaire. También en España y Estados Unidos.

HEMATITES-Fe 2 O 3 § § § § Hexagonal 32/m. Los cristales normalmente son tabulares gruesos o delgados (0001). Empaquetamiento compacto hexagonal de O con los cationes en coordinación octaédrica entre ellos. Lámina basal de octaedros con una vacante octaédrica por c/ 2 octaedros. En la sección vertical mostrando la posición de los octaedros llenos y vacíos. Partición en (1011) con ángulos casi cúbicos. H=5 ½ -6 ½ G=5. 26 Brillo metálico en cristales y mate en las variedades terrosas. Color castaño rojizo a negro. Huella de color rojo claro a oscuro que se vuelve negro al calentarlo. Translúcido. Composición: Fe 70% O 30%. Se reconoce por la huella característica roja. Es un mineral que se halla en rocas de todas las edades y formas, la mena más abundante del hierro.

GRUPO DE LA ESPINELA-XY 2 O 4 § § Basados en la distribución de los O en un empaquetamiento aproximadamente cúbico compacto proyectada a lo largo de planos (111) en la estructura. Los cationes que ocupan posiciones intersticiales en la estructura del O están en poliedros de coordinación octaédrica y tetraédrica con el O. En una celda unitaria de espinela con una longitud de arista de unos 8 A, existen 32 posiciones octaédricas y 64 tetraédricas donde 16 y 8 respectivamente están ocupadas por cationes. Existen 2 tipos de estructuras de espinela: normal y inversa. En la normal los 8 cationes X ocupan las 8 posiciones tetraédricas y los cationes Y ocupan las 16 posiciones octaédricas dando la fórmula X 8 Y 16 O 32. En la estructura inversa, 8 de los 16 cationes Y ocupan las 8 posiciones tetraédricas, dando lugar a la fórmula Y(YX)O 4. En la estructura de la espinela normal los conceptos generales de relación de radios no se aplican, realmente el catión mayor está en el poliedro menor y viceversa.

HIDRÓXIDOS § § § Brucita Mg(OH)2, Manganita Mn. O(OH), Grupo de la goethita: Diásporo α Al. O(OH), Goethita αFe. O(OH). La presencia de los grupos (OH) ocasiona un debilitamiento en los enlaces de las estructuras en comparación con las de los óxidos. La estructura de la Brucita consta de Mg coordinado octaédricamente al (OH), con los octaedros compartiendo las aristas que forman una capa. Normalmente el cristal de la brucita es hojoso, macizo. Tiene exfoliación perfecta (0001) paralela a las láminas octaédricas. Láminas flexibles no elásticas. Mg. O 69% H 2 O 31%. La Brucita se reconoce por su aspecto hojoso, color claro y brillo perlado en la cara de exfoliación. Se distingue del talco por su dureza y por no tener tacto graso, y de la mica, por no ser elástica. La Brucita es una fuente secundaria de magnesio metálico.
 Nativos e inmigrantes digitales por marc prensky
Nativos e inmigrantes digitales por marc prensky Sulfuros masivos volcanogénicos (vms)
Sulfuros masivos volcanogénicos (vms) Sulfuros masivos volcanogénicos (vms)
Sulfuros masivos volcanogénicos (vms) Elementos minerales
Elementos minerales Hidrxidos
Hidrxidos Espinela inversa
Espinela inversa Hidrxidos
Hidrxidos Clasificacin
Clasificacin Clasificacin de empresas
Clasificacin de empresas Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Los animales ppt
Los animales ppt Clasificacin
Clasificacin Mark ahumada
Mark ahumada Clasificacion de los aceros
Clasificacion de los aceros Clasificacion de deuda publica
Clasificacion de deuda publica Propiedad del capital privado
Propiedad del capital privado Xidos
Xidos Xidos
Xidos Xidos
Xidos Xidos
Xidos Compostos ionicos
Compostos ionicos A cal viva é um material muito usado
A cal viva é um material muito usado Xidos
Xidos Xidos
Xidos Feeder dike
Feeder dike