Chemie I Contact Dit document is samengesteld door

















- Slides: 29

Chemie I Contact Dit document is samengesteld door onderwijsbureau Bijles en Training. Wij zijn DE expert op het gebied van bijlessen en trainingen in de exacte vakken, van VMBO tot universiteit. Zowel voor individuele lessen op maat als voor doelgerichte groepstrainingen die je voorbereiden op een toets of tentamen. Voor meer informatie kun je altijd contact met ons opnemen via onze website: http: //www. wiskundebijlessen. nl of via e-mail: marc_bremer@hotmail. com Disclaimer Alle informatie in dit document is met de grootst mogelijke zorg samengesteld. Toch is het niet uit te sluiten dat informatie niet juist, onvolledig en/of niet up-to-date is. Wij zijn hiervoor niet aansprakelijk. Op geen enkele wijze kunnen rechten worden ontleend aan de in dit document aangeboden informatie. Auteursrecht Op dit document berust auteursrecht. Het is niet toegestaan om dit document zonder voorafgaande schriftelijke toestemming van de auteur te kopieren en/of te verspreiden in welke vorm dan ook.

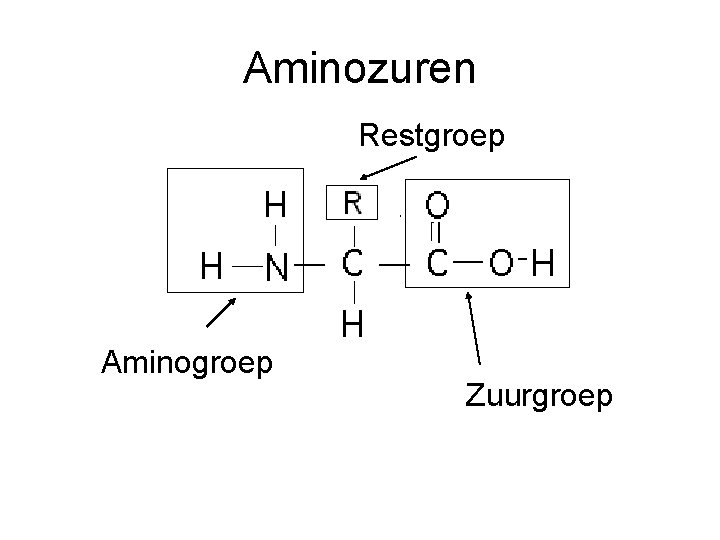
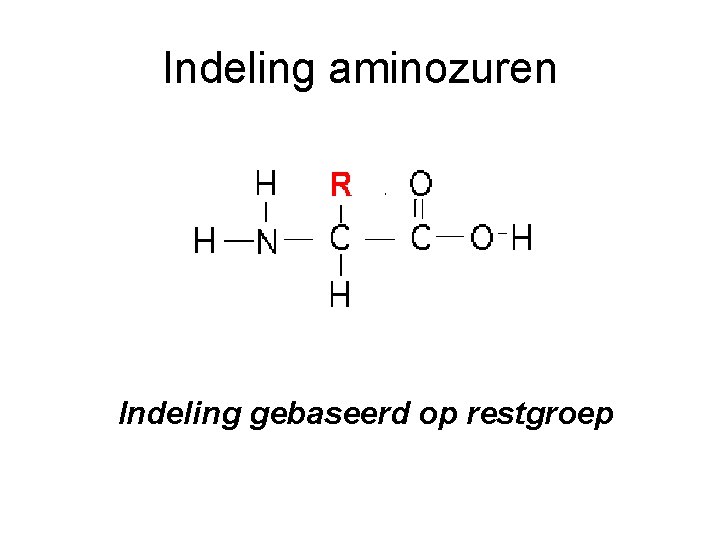
Aminozuren Restgroep Aminogroep Zuurgroep

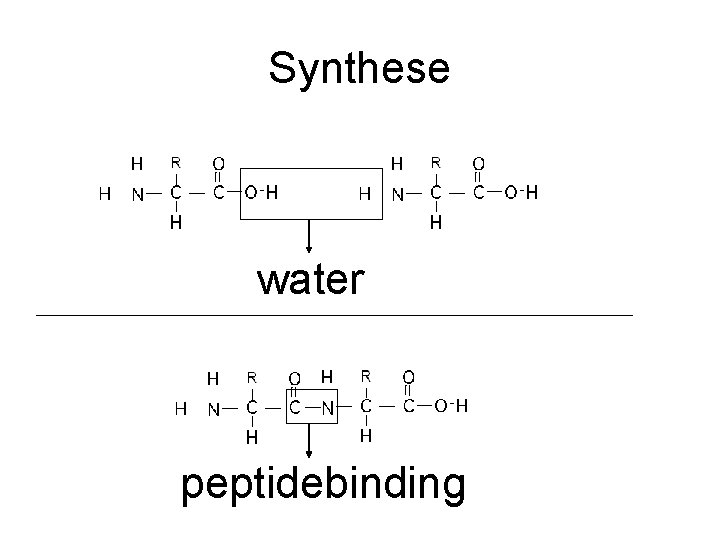
Synthese water peptidebinding

Koolhydraten en eiwitten I Koolhydraten: 3 verschillende bouwstenen Eiwitten: ongeveer 21 verschillende bouwstenen

Koolhydraten en eiwitten II Koolhydraten: Ketenstructuur en vertakkingen Eiwitten: 4 verschillende complexe structuurlagen

Koolhydraten en eiwitten III Koolhydraten: Verbinding door afstaan water Verbreking door opnemen water Eiwitten: Verbinding door afstaan water Verbreking door opnemen water

Vetzuren en eiwitten Vetten: Indeling in essentiele en niet-essentiele vetzuren Eiwitten: Indeling in essentiele en niet-essentiele aminozuren

Indeling aminozuren Indeling gebaseerd op restgroep

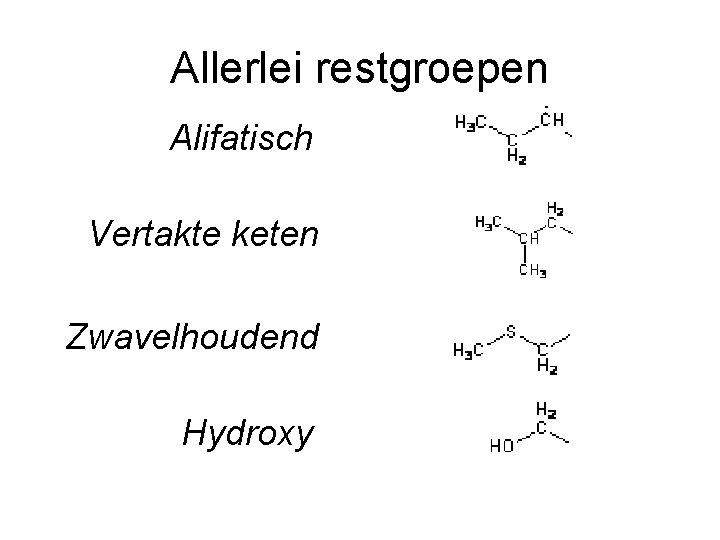
Allerlei restgroepen Alifatisch Vertakte keten Zwavelhoudend Hydroxy

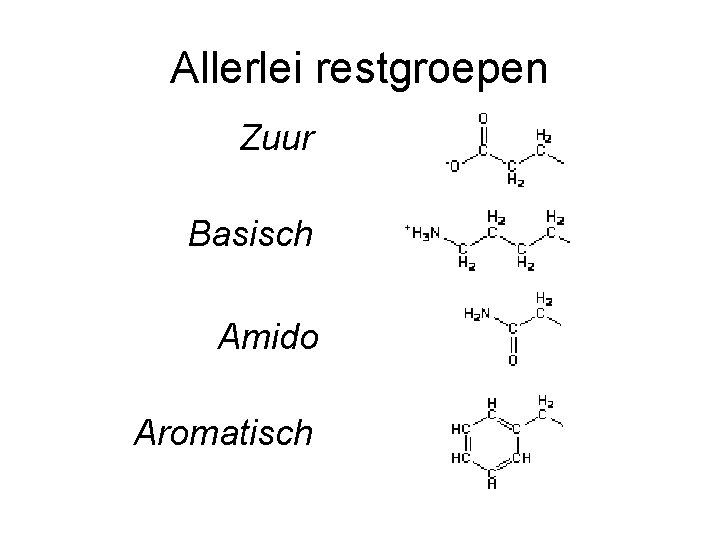
Allerlei restgroepen Zuur Basisch Amido Aromatisch

Oude tentamenvragen 1 Welk van onderstaande stoffen bevat de minste aminozuren? a) oligopeptiden b) polypeptiden c) proteines d) tripeptiden 2 Welk van onderstaande aminozuren hebben een ringstructuur ? a) aromatische aminozuren b) vertakte-keten aminozuren c) zure aminozuren d) zwavelhoudende aminozuren

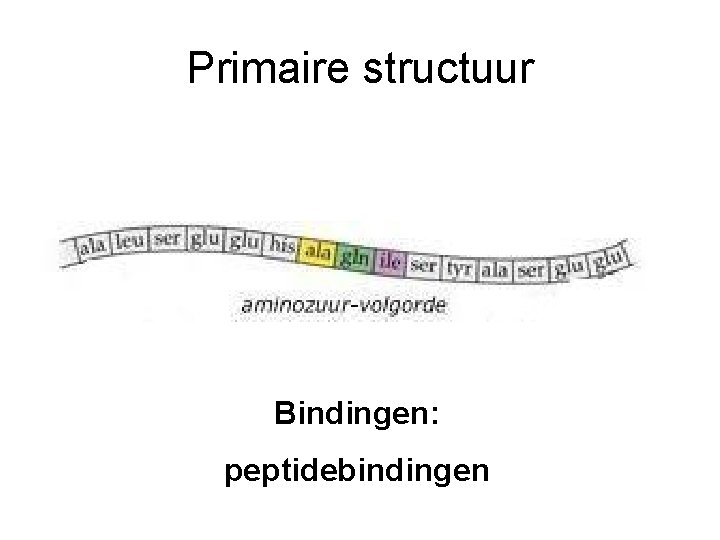
Primaire structuur Bindingen: peptidebindingen

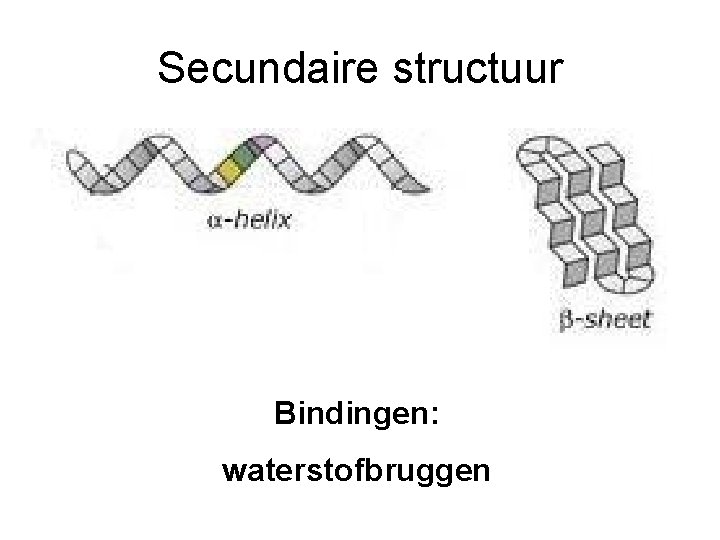
Secundaire structuur Bindingen: waterstofbruggen

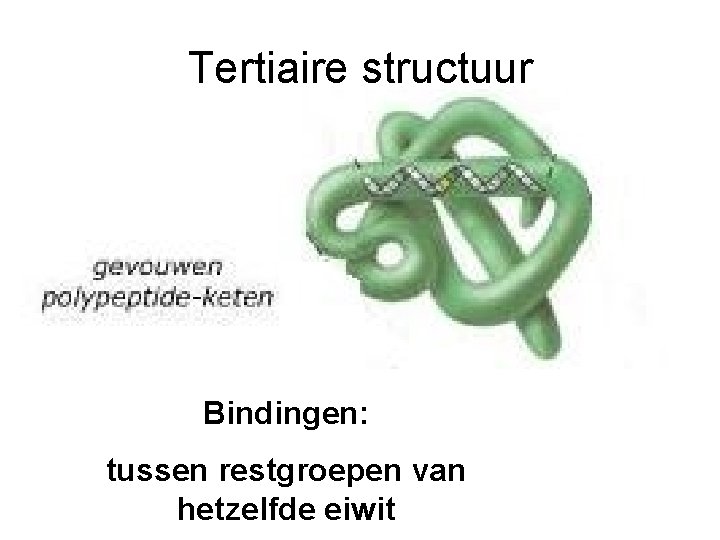
Tertiaire structuur Bindingen: tussen restgroepen van hetzelfde eiwit

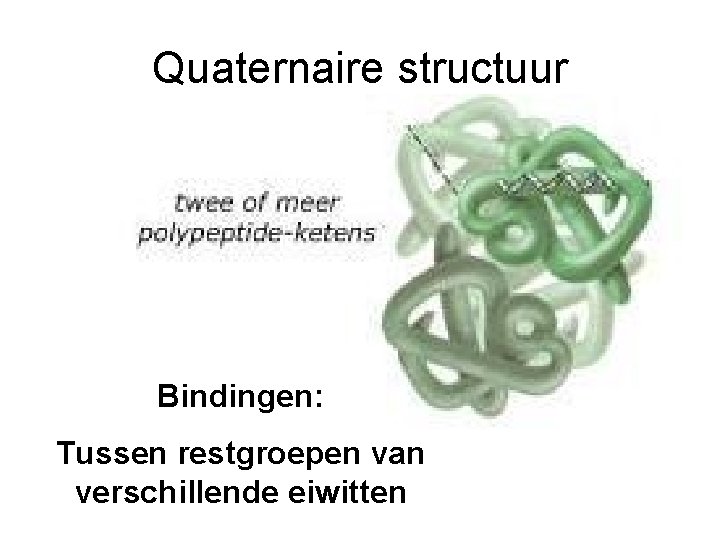
Quaternaire structuur Bindingen: Tussen restgroepen van verschillende eiwitten

Oude tentamenvragen 3 De tertiaire structuur van een eiwit wordt bepaald door de a) Bindingen tussen restgroepen van aminozuren b) Bindingen tussen verschillende proteïne moleculen c) Volgorde van de aminozuren d) Alle bovengenoemde mogelijkheden zijn juist 4 Gegeven twee stellingen: I Hydrolyse van een eiwit leidt tot verandering in de primaire structuur II Hydrolyse van een eiwit gaat samen met verandering van de secundaire structuur a) I en II zijn juist b) Alleen I is juist c) Alleen II is juist d) I en II zijn niet juist

Denaturatie I Een eiwit zit door al die bindingen opgerold:

Denaturatie II Door allerlei oorzaken kunnen die bindingen verbroken worden: 1. Toevoegen van een zuur 2. Toevoegen van een base 3. Toevoegen van een zout 4. Verhitting 5. Schudden

Denaturatie III Hierdoor rolt het eiwit uit: denaturatie

Coagulatie Gevolg: veel meer restgroepen aan de buitenkant van het eiwit Gevolg: eiwitten kunnen zich veel makkelijker aan elkaar hechten Gevolg: een veel steviger structuur van lange eiwitketens: het eiwit is gecoaguleerd (gestold)

Voorbeelden

Voorbeelden Melk wordt opgeklopt Daardoor denatureren eiwitten en worden er luchtbelletjes ingebracht Eiwitten coaguleren (vormen een vangnet) en sluiten luchtbelletjes in

Voorbeelden Eiwitten (caseine zit in gescheiden bundeltjes Stremsel heft scheiding op Zuursel knipt bundeltjes aan stukken Hierdoor vormt het caseine een compact netwerk en slaat het neer

Oude tentamenvragen 5 Gegeven twee stellingen: I Bij het kloppen van kippeneiwit tot schuim wordt de primaire structuur van het eiwit verbroken II Bij het koken van melk wordt de primaire structuur van het eiwit verbroken a) I en II zijn juist b) Alleen I is juist c) Alleen II is juist d) I en II zijn niet juist 6 Welk van onderstaande factoren kan leiden tot denaturatie van een eiwit? a) Verhoogde p. H b) Verhoogde temperatuur c) Verlaagde p. H d) Alle bovengenoemde mogelijkheden zijn juist

Enzymen 1. Versnellen een reactie 2. 2. Ondergaan zelf geen verandering bij de reactie

Voorbeeld: alfa-amylase Kan maar op 1 stof werken (in dit geval zetmeel Kan maar 1 reactie uitvoeren (in dit geval 1 glucosemolecuul verwijderen)

Voorbeeld: alfa-amylase Na afloop is het enzym onveranderd En kan het dezelfde reactie heel vaak herhalen

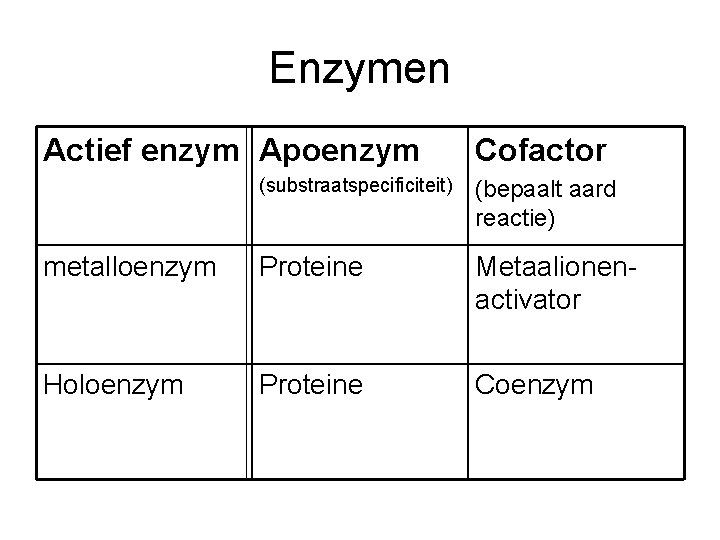
Enzymen Actief enzym Apoenzym Cofactor (substraatspecificiteit) (bepaalt aard reactie) metalloenzym Proteine Metaalionenactivator Holoenzym Proteine Coenzym

Oude tentamenvragen 7 Wanneer een enzym de omzetting van een bepaalde stereoisomeer bevordert spreekt met van: a) Hydrolysespecificiteit b) Reactiespecificiteit c) Stereospecificiteit d) Substraatspecificiteit 8 Het eiwitgedeelte van een enzym is het a) Apoenzym b) Coenzym c) Holoenzym d) Metalloenzym
 J'aime les gros nichons
J'aime les gros nichons Plurianal
Plurianal Papa m a dit
Papa m a dit Dit liv dit valg
Dit liv dit valg Enkelvoudig blad
Enkelvoudig blad Samengesteld lijndiagram
Samengesteld lijndiagram Door to door luggage service switzerland
Door to door luggage service switzerland Direct energy door to door
Direct energy door to door Air resistance contact force
Air resistance contact force Sliding contact bearing
Sliding contact bearing Noncontact force definition
Noncontact force definition What is a contact force
What is a contact force Post encounter stage in service marketing
Post encounter stage in service marketing Schottky contact vs ohmic contact
Schottky contact vs ohmic contact Non contact forces portfolio
Non contact forces portfolio What is contact force
What is contact force Non contact force examples
Non contact force examples Atopic dermatitis vs contact dermatitis
Atopic dermatitis vs contact dermatitis Document
Document Le sage a dit
Le sage a dit Welkom in het eerste leerjaar
Welkom in het eerste leerjaar Wie is dit
Wie is dit Waarom dit onderwerp
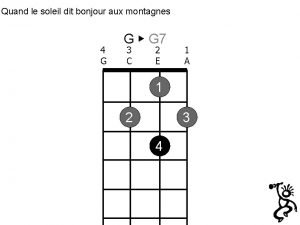
Waarom dit onderwerp Quand le soleil dit bonjour aux montagnes
Quand le soleil dit bonjour aux montagnes Monsieur baudelaire
Monsieur baudelaire Types of nucleation
Types of nucleation Fft dit
Fft dit J'ai mal dit le coeur
J'ai mal dit le coeur Dit case
Dit case Je suis dans la joie quand on me dit
Je suis dans la joie quand on me dit