CASO 29 Sergio Lpez Diguez FIR 4 ANTECEDENTES









- Slides: 11

CASO 29 Sergio López Diéguez, FIR 4

ANTECEDENTES DE LOS PACIENTES Pareja que acude a la consulta de Reproducción de la unidad de Ginecología y Medicina Fetal del H. U. Virgen del Rocío de Sevilla debido a que tienen un hijo afecto de DM 1 y presentan deseo reproductivo con descendencia libre de la enfermedad. La mujer tiene 26 años de edad, B-. El hombre tiene 35 años, 0+. Diagnostivado de DM 1. Aporta informe genético en el que hay una expansión del triplete CTG en el gen DMPK (>67, rango patológico). Aporta también informe de seminograma en el que se detecta una oligozoospermia con 3 mill /m. L (≥ 15 mill/ml). El hijo que tienen en común tiene también un estudio genético en el que se constata su DM 1 por ser portador de la expansión del triplete CTG en el gen DMPK, pero con 18 meses de edad no presenta síntomas.

UNA VEZ EN EL HOSPITAL Se repite el análisis genético (? ) y el seminograma. Se confirma la expansión del triplete en padre e hijo, así como la oligozoospermia. El análisis de los marcadores microsatélites permite establecer la combinación específica asociada al alelo mutado presente en el padre y en el hijo afecto de DM 1, lo que permitirá el estudio genético indirecto en la blastómero del embrión en caso de que fuera necesario. Se acepta la inclusión de la pareja Diagnóstico Genético Preimplantatorio con semen conyugal en el que se realizará el análisis genético de los embriones obtenidos transfiriendo sólo embriones no afectos de DM 1.

EXPLORACIONES COMPLEMENTARIAS A la mujer se le realiza una ecografía para determinar su probable respuesta ovárica. La exploración ginecológica de la mujer muestra una buena dotación folicular, buena accesibilidad ovárica, y un cérvix y útero normal. Entre el segundo y cuarto día del ciclo menstrual se determinan las hosmonas sexuales. HORMONAS Resultado Rango TSH 7, 4 UI/L 3, 5 – 12, 5 UI/L LH 8, 4 UI/L 2, 4 – 12, 6 UI/L EST 31 UI/L 46 – 607 UI/L

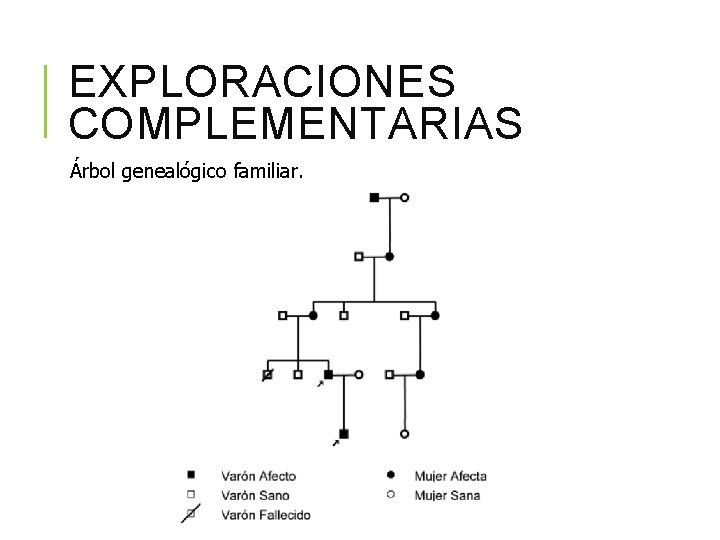
EXPLORACIONES COMPLEMENTARIAS Árbol genealógico familiar.

DIAGNÓSTICO DEFINITIVO Tanto el padre como el hijo son afectos de la Enfermedad de Steinert (DM 1). Se recomienda la familia que se realice un ciclo de fecundación “in Vitro” con semen conyugal y un análisis genético de los embriones obtenidos, para así poder descartar DM 1 en la descendencia (Ciclo de DGP). Se recomienda un posterior análisis genético mediante Diagnóstico Prenatal.

EVOLUCIÓN La pareja se somete a una estimulación ovárica previa a la fecundación in vitro. A la punción ovárica transvaginal para la obteción de los ovocitos le sigue una microinyección intracitoplasmática de espermatozoides (ICSI). Los embriones se cultivan hasta el estadio 7 -8 células, realizando entonces la biopsia del blastómero embrionaria. El cultivo prosigue hasta la fase blastocisto (dos días). Durante ese periodo se estudia si la combinación alélica mutada está presente en cada uno de los embriones estudiados.

EVOLUCIÓN Se estudia la expansión CTG del gen DMPK, así como de tres marcadores polimórficos extragénicos (APOC 2, D 19 S 219 y D 19 S 112) mediante PCR de fluorescencia. Estos marcadores se ubican antes y después del gen DMPK y sirven para cerciorarse que el número de copias del triplete CTG del gen DMPK corresponde al tamaño real y no a una recombinación genética, lo que no permitiría llegar a una conclusión definitiva. En el primer ciclo la gestación es fallida. En el segundo intento se obtienen ocho ovocitos, de los cuales seis son maduros y aptos para el ICSI. De estos seis se obtienen cuatro embriones pero sólo dos pueden ser biopsiados el día de cultivo óptimo. Uno de ellos se considera no afecto y se transfiere a la madre. Catorce días después da positivo a βHCG y dos semanas más tarde se observa un saco gestacional por ecografía. La pareja decide rechazar el diagnóstico prenatal. El embarazo concluye con normalidad y nace un varón sano de 2. 700 g.

LA ENFERMEDAD La Distrofia Miotónica tipo 1 (DM 1) o enfermedad de Steinert es la distrofia muscular de origen genético más común en adultos (1/8000 individuos en la población general). Su patrón de transmisión es autosómico dominante. Es una enfermedad caracterizada por la aparición de debilidad muscular progresiva, atrofia y miotonía, cataratas, alteraciones endocrinas, retraso mental y disfunción cardiorespiratoria y gastrointestinal… La expresión fenotípica y la edad de aparición de los síntomas presentan una variación muy amplia, comprendiendo un rango desde el adulto asintomático hasta la forma congénita capaz de producir la muerte del neonato.

LA ENFERMEDAD La DM 1 está causada por una alteración genética basada en el aumento del número de repeticiones del triplete CTG en el extremo 3’ del gen DMPK (localizado en 19 q 13. 3). Este gen codifica la miotonincinasa, una proteína de membrana muscular implicada en la fosforilación proteica. En los individuos afectos, la severidad del cuadro clínico depende del número de repeticiones CTG. Los alelos con un tamaño superior a las 50 repeticiones se asocian a la DM 1, siendo altamente inestables en la línea germinal, pudiéndose expandir a varios de cientos o incluso a miles de repeticiones CTG. El alelo patológico se asocia a un número mayor de 200 copias, presentándose entonces el fenotipo severo de la enfermedad. En varones afectos está descrita una disminución en la fertilidad. Esta deficiencia en la espermatogénesis ha sido relacionada con la disminución de la expresión del gen Six 5, gen flanqueante al DMPK. Las expansiones CTG en varones con DM 1 causan el silenciamiento del gen Six 5 contiguo, provocando de forma indirecta una disminución de su fertilidad debida a una disminución progresiva de la masa testicular e incremento de la apoptosis de las células germinales masculinas.

FIN




















