CAPITOLO 8 CAPITOLOdegli 8 IL SISTEMA PERIODICO DEGLI







- Slides: 10

CAPITOLO 8 CAPITOLOdegli 8. IL SISTEMA PERIODICO DEGLI ELEMENTI La tavola periodica elementi Indice 1. La tavola periodica di Mendeleev 2. La tavola periodica moderna 3. Proprietà periodiche degli elementi 4. Proprietà di alcuni gruppi della tavola periodica 5. I periodi © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

1 La tavola periodica di Mendeleev CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI Nel 1869, il chimico russo Dmitrij Mendeleev (1834 -1907) disponendo gli elementi in ordine di massa atomica crescente notò che si presentavano proprietà chimiche e fisiche simili ogni otto o diciotto elementi. Per rispettare tale periodicità, il chimico russo dispose gli elementi con proprietà simili in colonne verticali. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

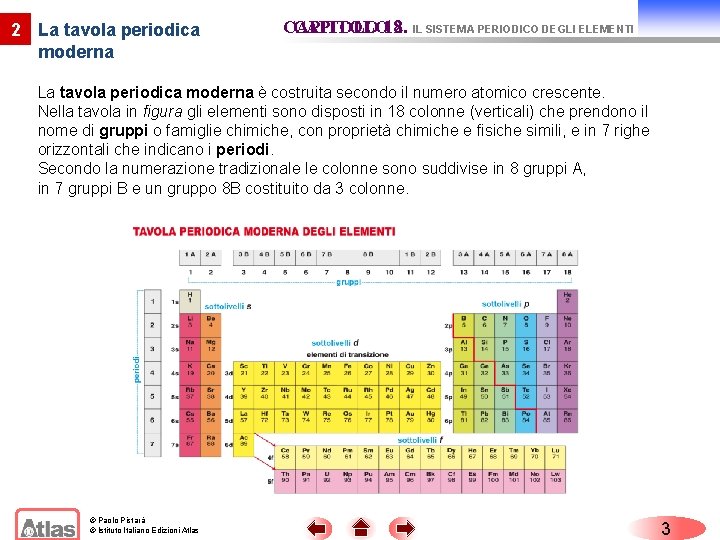
2 La tavola periodica moderna CAPITOLO 12. 8. IL SISTEMA PERIODICO DEGLI ELEMENTI La tavola periodica moderna è costruita secondo il numero atomico crescente. Nella tavola in figura gli elementi sono disposti in 18 colonne (verticali) che prendono il nome di gruppi o famiglie chimiche, con proprietà chimiche e fisiche simili, e in 7 righe orizzontali che indicano i periodi. Secondo la numerazione tradizionale le colonne sono suddivise in 8 gruppi A, in 7 gruppi B e un gruppo 8 B costituito da 3 colonne. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 3

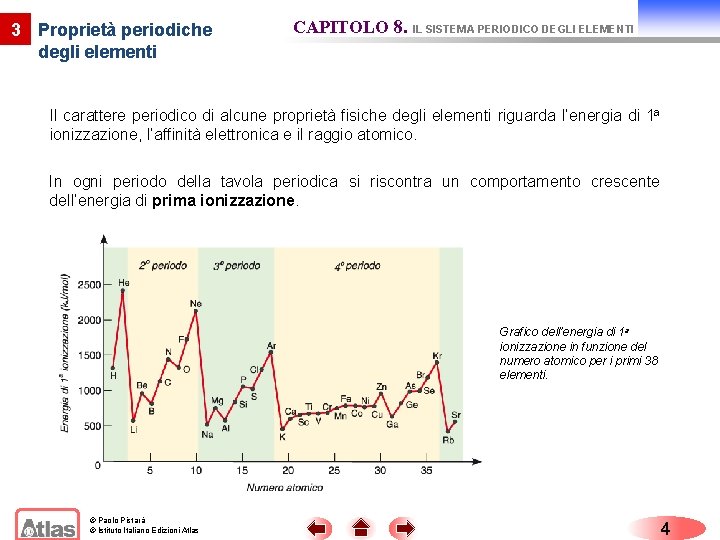
3 Proprietà periodiche degli elementi CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI Il carattere periodico di alcune proprietà fisiche degli elementi riguarda l’energia di 1 a ionizzazione, l’affinità elettronica e il raggio atomico. In ogni periodo della tavola periodica si riscontra un comportamento crescente dell’energia di prima ionizzazione. Grafico dell’energia di 1 a ionizzazione in funzione del numero atomico per i primi 38 elementi. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

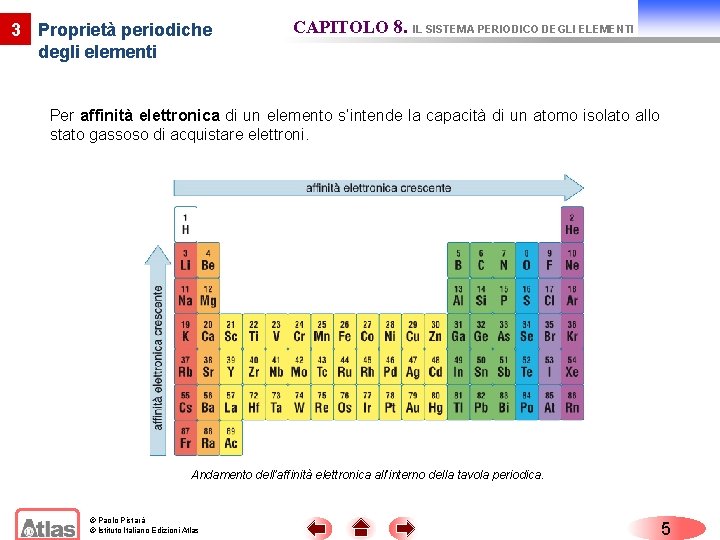
3 Proprietà periodiche degli elementi CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI Per affinità elettronica di un elemento s’intende la capacità di un atomo isolato allo stato gassoso di acquistare elettroni. Andamento dell’affinità elettronica all’interno della tavola periodica. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

3 Proprietà periodiche degli elementi CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI Un’altra proprietà che varia in modo regolare e periodico con il numero atomico è il raggio atomico. Il raggio atomico diminuisce con gradualità lungo un periodo da sinistra verso destra, mentre aumenta, nell’ambito di un gruppo, mano che si scende verso il basso. I raggi atomici e i raggi ionici in picometri (pm). © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

4 Proprietà di alcuni gruppi della tavola periodica CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI In ciascun gruppo gli elementi hanno proprietà simili perché hanno lo stesso numero di elettroni nel livello più esterno. Infatti sono gli elettroni del livello esterno, chiamati elettroni di valenza, che partecipano ad una reazione con altri atomi. Come esempio consideriamo gli elementi del gruppo 1 A, i metalli alcalini. Le configurazioni elettroniche per Li, Na e K sono: 3 Li © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1 s 2 2 s 1 11 Na 1 s 2 2 p 6 3 s 1 19 K 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 7

4 Proprietà di alcuni gruppi della tavola periodica CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI Gli elementi del gruppo 1 A tendono a perdere facilmente l’elettrone più esterno trasformandosi in uno ione con una carica positiva. Ad esempio: © Paolo Pistarà © Istituto Italiano Edizioni Atlas 8

4 Proprietà di alcuni gruppi della tavola periodica CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI Gli elementi del gruppo 7 A, gli alogeni (non metalli), hanno sette elettroni nel livello più esterno del tipo ns 2 np 5. Questi elementi tendono ad acquistare un elettrone trasformandosi in ioni negativi. Atomi o ioni che presentano la stessa configurazione elettronica sono detti isoelettronici. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 9

CAPITOLO 8. IL SISTEMA PERIODICO DEGLI ELEMENTI 5 I periodi Nella tavola periodica si individuano sette periodi. In ciascun periodo ogni elemento ha un elettrone in più rispetto a quello che lo precede, per cui si ha una modificazione delle proprietà che passano con gradualità da un carattere metallico (1 A) ad uno non metallico (7 A). Na Mg Al Si P S Cl In figura sono rappresentati gli elementi del 3° periodo. Tali elementi mostrano una modificazione delle proprietà. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 10